Kombinasi Obat Sinergis yang Diperantarai Nanosistem yang Disamarkan Membran RBC untuk Terapi Anti-Tumor yang Ditingkatkan
Abstrak
Mencapai pengiriman obat secara langsung ke lokasi tumor merupakan prasyarat untuk pengembangan obat yang berhasil, yang mengharuskan molekul obat dapat menembus sel. Sejumlah penelitian telah menunjukkan bahwa peptida penembus sel (CPP) dapat menambah kemanjuran berbagai agen terapeutik dengan meningkatkan penyerapan seluler, yang mendorong kemajuannya ke dalam studi praklinis. Namun, sifat non-spesifisitas dan kationik CPP menghambat aplikasi klinisnya. Dikaitkan dengan kapasitas yang mudah diakses dan biokompatibilitas sel darah merah (RBC) yang sangat baik, di sini, sistem pengiriman obat berbasis peptida penembus sel yang disamarkan membran RBC R8-(RRRRRRRR) dibangun untuk mencapai kombinasi sinergis senyawa alami triptolide (TP) dan celastrol (Cel), sehingga secara tepat menginduksi penghambatan tumor. Nanosistem yang disamarkan membran RBC lolos dari sistem retikuloendotelial (RES) dan diendositosis oleh sel tumor yang dimediasi oleh R8. Melepaskan apoptosis sel tumor yang diinduksi TP dan Cel, mengurangi invasi metastasis tumor dan memicu gangguan autofagi pada kanker payudara dan kanker hati. Secara keseluruhan, nanosistem biomimetik mewujudkan terapi kombinasi obat yang ditingkatkan dengan biosafety tingkat tinggi, yang menyediakan strategi yang mudah untuk meningkatkan aplikasi klinis kombinasi obat berbasis CPP.
1 Pendahuluan
Tumor ganas tetap menjadi salah satu jenis penyakit paling mematikan di seluruh dunia. [ 1 ] Saat ini, kemoterapi tetap menjadi modalitas utama untuk mengobati tumor ganas dibandingkan dengan pembedahan dan terapi radiasi, yang hanya dapat memberikan efek terapeutik lokal. Pengiriman agen kemoterapi yang efektif ke lokasi tumor merupakan titik fokus dari banyak penelitian. Pengembangan strategi penargetan menjanjikan peningkatan pengiriman obat spesifik ke sel tumor. [ 2 ] Teknologi yang ada biasanya bergantung pada penargetan pasif atau aktif untuk mengangkut muatan ke lokasi tertentu, sehingga mengurangi efek samping sistemik dan menambah hasil terapeutik. Pengenalan biologis aktif oleh antibodi atau biomolekul lain untuk mengarahkan obat ke lokasi intraseluler tertentu sering digunakan untuk meningkatkan efisiensi penargetan, [ 3 ] yang mengharuskan molekul obat menjadi permeabel sel. Penyeberangan membran plasma menghadirkan tantangan bagi agen terapeutik tertentu, karena banyak obat menunjukkan aktivitas optimal secara in vitro tetapi menunjukkan aktivitas yang berkurang secara signifikan secara in vivo. [ 4 ] Akibatnya, mengoptimalkan pengiriman seluler agen terapeutik menjadi sangat penting. Banyak penelitian telah menunjukkan bahwa CPP, misalnya, R8 (RRRRRRRR), dapat menambah kemanjuran berbagai agen terapeutik dengan meningkatkan penyerapan seluler, yang mendorong kemajuan mereka ke dalam studi praklinis. [ 5 ] Namun, CPP umumnya menunjukkan kurangnya selektivitas jaringan, yang mampu menembus semua membran seluler. [ 6 ] Lebih jauh lagi, karena muatan positifnya, R8 mengikat protein plasma selama sirkulasi, sehingga mengurangi stabilitas in vivo mereka. Keterbatasan ini secara signifikan menghambat aplikasi klinis CPP. [ 7 ] Oleh karena itu, ada kebutuhan mendesak untuk mengembangkan strategi pengiriman obat yang biokompatibel untuk memecahkan masalah konversi klinis.
Nanopartikel yang disamarkan oleh membran sel biomimetik telah muncul sebagai generasi berikutnya dari terapi berbasis partikel, dengan aplikasi yang semakin meluas sambil memberikan berbagai fungsi biologis permukaan sel pada nanopartikel. [ 8 ] Biasanya, nanopartikel biomimetik ini dibentuk dengan melapisi nanopartikel dengan membran sel yang diekstraksi dan diisolasi dari sel darah merah (RBC), trombosit, sel kanker, sel punca mesenkimal, atau sel darah putih, yang menciptakan struktur inti/kulit. Di antara mereka, membran RBC, karena peran transportasi alaminya dalam sirkulasi darah, muncul sebagai bahan biomimetik membran yang sangat baik, menunjukkan biokompatibilitas yang baik, imunogenisitas rendah, dan sifat sirkulasi yang diperpanjang. [ 9 ] Misalnya, telah dilaporkan bahwa melapisi nanopartikel PLGA dengan membran RBC dapat memperpanjang waktu sirkulasi darah dan mengurangi fagositosis makrofag, [ 10 ] yang dikaitkan dengan protein “penanda diri” CD47 yang diekspresikan pada membran, yang menghambat respons imun. [ 11 ] Selain itu, deformabilitas sel darah merah meningkatkan penetrasi obat, sehingga memudahkan akumulasi dalam jaringan tumor. [ 12 ]
Dengan demikian, dalam penelitian ini, dirancanglah sistem penghantaran obat liposom berdasarkan peptida transmembran R8 dan strategi kamuflase membran sel darah merah. Sebagai bukti konsep, senyawa alami triptolide (TP) dan celastrol (Cel), sebagai agen antikanker alami yang potensial, dimasukkan ke dalam liposom. Sebagai dua komponen utama Tripterygium wilfordii, hanya sedikit penelitian yang menggabungkan TP dan Cel untuk menyelidiki efek sinergisnya. Laporan terbatas juga menggunakan obat bebas, tetapi efek samping yang disebabkan oleh kelarutan dan penargetan obat secara serius menghambat penerapan TP dan Cel. Secara khusus, kombinasi TP dan Cel dapat meningkatkan kemanjuran dengan efek sinergis, yang darinya, TP dapat memberikan efek antitumor melalui berbagai jalur seperti induksi apoptosis, penghentian siklus, antioksidan, penghambatan invasi dan metastasis, induksi autofagi, dan mediasi imunitas sel kanker. [ 13 ] Komponen homolognya, Cel, penghambat proteasom, dapat menghambat aktivitas proteasom dalam sel tumor, mengakumulasi protein target proteasom untuk menginduksi apoptosis, dan memiliki efek penghambatan yang baik pada banyak jenis sel tumor. [ 14 ] Desain liposom biomimetik TP/Cel ini memiliki beberapa keuntungan potensial. Terutama, baik TP maupun Cel dapat dienkapsulasi sepenuhnya ke dalam liposom dan secara bersamaan diangkut ke lokasi tumor dengan rasio sinergis. Dalam sirkulasi, liposom mimetik membran sel darah merah menjaga stabilitas dan secara efektif melindungi peptida transmembran R8. Setelah tiba di lokasi tumor, R8 terekspos, secara bersamaan memfasilitasi internalisasi liposom ke dalam sel tumor. Studi ini menyajikan sistem penghantaran obat yang menampilkan liposom yang dihias bersama dengan membran sel darah merah dan peptida transmembran. Ini meneliti pengaruh protein permukaan pada kapasitas penyerapan seluler dan penghindaran imun. Selain itu, kemanjuran penargetan in vivo, farmakodinamik, dan mekanisme yang mendasari sistem ini dinilai dalam model kanker payudara dan kanker hati.
2 Hasil dan Pembahasan
2.1 Efek Sinergis TP dan Sel
Pertama, efek sinergis TP dan Cel dievaluasi terhadap sel kanker HepG2 dan MCF-7. Seperti yang ditunjukkan pada Gambar S1 (Informasi Pendukung), campuran TP/Cel menginduksi efek signifikan pada proliferasi sel pada kedua lini sel HepG2 dan MCF-7 pada rasio molar TP terhadap Cel sebesar 1:100 dengan berbagai konsentrasi secara sinergis jika dibandingkan dengan kelompok TP bebas dan Cel bebas. [ 15 ] Nilai IC50 campuran TP/Cel adalah 1028±8.501 n M pada sel HepG2 dan 1695±7.496 n M pada sel MCF7, berturut-turut. Sementara TP menunjukkan efek minimal dalam kisaran konsentrasi yang kami gunakan. Dan nilai IC50 Cel pada sel HepG2 dan MCF-7 masing-masing adalah 1223 ± 7.491 dan 2099 ± 7.081 n M . Hasil-hasil ini menunjukkan bahwa campuran TP dan Cel dapat memungkinkan efek sinergi efisien yang cocok untuk terapi kanker dalam terapi kombinasi.
2.2 Persiapan dan Karakterisasi Cel+TP/RBCm@R8-Lip
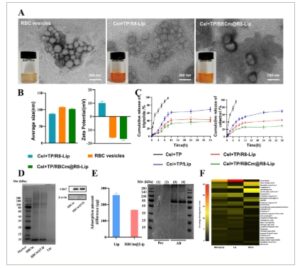
Berikutnya, Cel dan TP dienkapsulasi ke dalam liposom yang dihias R8 (Cel+TP/R8-Lip) menggunakan metode injeksi etanol. Kemudian vesikel RBC dikumpulkan untuk modifikasi permukaan. Cel+TP/RBCm@R8-Lip disiapkan dengan menggabungkan Cel+TP/R8-Lip dengan membran RBC melalui sonikasi ( Skema 1 ). Gambar Mikroskop Elektron Transmisi (TEM) menunjukkan morfologi Cel+TP/RBCm@R8-Lip biasanya berbentuk bulat, dan lapisan dalam dan luar terlihat jelas ( Gambar 1A ). Analisis Dynamic Light Scattering (DLS) menunjukkan distribusi ukuran partikel yang sangat baik dari vesikel RBC dan Cel+TP/RBCm@R8-Lip. Selain itu, diameter hidrodinamik Cel+TP/R8-Lip dan Cel+TP/RBCm@R8-Lip adalah 88,69 nm dengan Indeks Dispersitas Polimer (PDI) masing-masing 0,205 dan 99,61 nm dengan PDI 0,201. Analisis potensi zeta Cel+TP/RBCm@R8-Lip menunjukkan muatan permukaan vesikel RBC yang negatif (Gambar 1B ), yang menunjukkan keberhasilan pelapisan membran Cel+TP/RBCm@R8-Lip. [ 16 ] Efisiensi enkapsulasi (EE) TP dan Cel masing-masing adalah 86,3 ± 1,63% dan 95,6±1,33%. Selanjutnya, profil pelepasan obat in vitro TP dan Cel dari Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip dalam PBS diperiksa. Seperti yang diilustrasikan pada Gambar 1C , selama 6 jam pertama, 40,32%, 28,46%, dan 19,76% Cel dilepaskan dari Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip, masing-masing. Pada 10 jam, 55,6%, 37,4%, dan 26,29% TP dilepaskan dari Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip, masing-masing, yang menunjukkan bahwa ketiga liposom menunjukkan profil pelepasan obat yang berkelanjutan. Namun, karena pelapisan ganda vesikel R8 dan RBC, Cel+TP/RBCm@R8-Lip menunjukkan profil pelepasan obat yang relatif lebih lambat dibandingkan dengan Cel+TP/Lip selama pelepasan 36 jam, laju pelepasan kumulatif TP dan Cel dari Cel+TP/RBCm@R8-Lip pada 36 jam terakhir adalah 37,56% dan 29,15%.
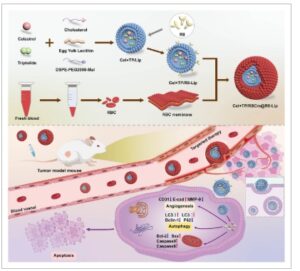
Skema 1
Buka di penampil gambar
Presentasi PowerPoint
Proses penyiapan Cel+TP/RBCm@R8-Lip dan terapi sinergis TP dan Cel yang dimuat bersama dalam liposom tersamar membran RBC dan berbasis peptida transmembran R8.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Karakterisasi Cel+TP/RBCm@R8-Lip dan analisis korona protein. A) Foto representatif dan gambar TEM suspensi berair vesikel sel darah merah, Cel+TP/R8-Lip, Cel+TP/RBCm@R8-Lip. B) Ukuran partikel dan potensi zeta vesikel sel darah merah, Cel+TP/R8-Lip dan Cel+TP/RBCm@R8-Lip dianalisis dengan DLS. C) Profil pelepasan obat triptolide dan celastrol (n = 3). D) Pita protein karakteristik vesikel sel darah merah, Lip, RBCm@Lip yang dipisahkan dengan SDS-PAGE dan Western blotting. E) Analisis kuantitatif dan kualitatif perubahan protein setelah Lip dan RBCm@Lip diinkubasi bersama serum, masing-masing. 1) Lip sebelum diinkubasi bersama. 2) RBCm@Lip sebelum diinkubasi bersama. 3) Bibir setelah ko-inkubasi dan (4) RBCm@Lip setelah ko-inkubasi. F) Peta panas protein yang paling banyak terdapat di korona protein. Protein yang menyusun setidaknya 1% korona protein pada liposom ditunjukkan. Semua data disajikan sebagai mean ± SD.
2.3 Karakterisasi Permukaan dan Analisis Korona Protein
Membran sel darah merah dari molekul endogen dapat menimbulkan sirkulasi darah yang lama dan penghindaran imun. Untuk memverifikasi pewarisan protein membran pada RBCm@R8-Lip yang berasal dari sel darah merah (RBC), profil protein dari nanocarrier ini diteliti melalui analisis Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE). Gambar 1D menunjukkan bahwa profil protein RBCm@Lip identik dengan membran sel darah merah. Lebih jauh, hilangnya pita β-aktin dalam analisis uji Western Blot (WB) menunjukkan bahwa selama proses ekstraksi membran eritrosit, eritrosit pecah secara memadai, yang menyebabkan pelepasan lengkap isinya. Selain itu, retensi antigen membran kunci CD47, yang menghalangi fagositosis makrofag, dikonfirmasi pada permukaan membran RBC dan RBCm@Lip, yang mengindikasikan keberhasilan modifikasi membran RBC pada liposom, mempertahankan fungsi biologis membran RBC, dengan demikian mengembangkan efek terselubung untuk pengiriman obat potensial.
Karena, saat memasuki sirkulasi darah, nanopartikel akan menghadapi berbagai komponen termasuk enzim, protein plasma, sistem retikuloendotelial (RES), fagosit, dan lainnya, sehingga mengakibatkan terbentuknya mahkota protein, lapisan protein, pada permukaannya. [ 17 ] Nanopartikel berlapis protein ini mudah dikenali oleh sistem imun, yang selanjutnya menyebabkan pembersihan cepat oleh sistem fagosit mononuklear (MPS). [ 18 ] Untuk menyelidiki apakah pelapisan dengan membran RBC dapat mengurangi pembentukan mahkota protein pada RBCm@Lip, kandungan protein, komposisi, dan kategori mahkota protein dianalisis menggunakan kit Bicinchoninic Acid Assay (BCA), SDS-PAGE, dan Liquid Chromatograph Mass Spectrometer/Mass Spectrometry (LC-MS/MS). Khususnya, seperti yang digambarkan pada Gambar 1E , perlu diperhatikan bahwa lebih sedikit protein yang diserap oleh RBCm@Lip dibandingkan dengan liposom murni setelah diinkubasi dengan plasma selama 0,5 jam. Analisis lebih lanjut dari jenis protein spesifik dalam mahkota protein (PC) dengan LC–MS/MS, peta panas protein yang terkandung dalam korona protein menunjukkan bahwa jumlah opsonin respons imun seperti imunoglobulin, fibrinogen, dan protein komplemen yang diserap pada RBCm@Lip berkurang drastis dibandingkan dengan kelompok Lip (Gambar 1F ). Oleh karena itu, melalui strategi kamuflase membran RBC, penyerapan imunoglobulin yang diminimalkan dalam korona protein RBCm@Lip mencegah interaksi dengan protein komplemen dan dapat menunjukkan imunogenisitas yang lebih rendah secara in vivo.
2.4 Penyerapan Seluler dan Sitotoksisitas In Vitro
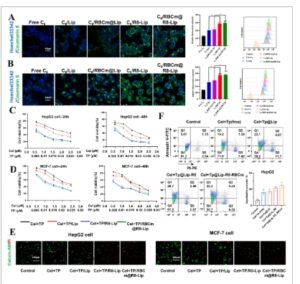
Sistem penghantaran obat saat ini sering menghadapi pembersihan cepat oleh Sistem Fagosit Mononuklear (MPS) sebelum mencapai lokasi tumor. [ 19 , 20 ] Oleh karena itu, makrofag (RAW 264.7) digunakan untuk menyelidiki perilaku penyerapan seluler RBCm@R8-Lip secara kualitatif dan kuantitatif dengan mikroskop pemindaian laser confocal (CLSM) dan flow cytometry (FCM). Untuk melacak fluoresensi liposom dalam sel dengan lebih baik, C6, pewarna fluoresensi hijau, dienkapsulasi ke dalam liposom sebagai pelacak fluoresensi. Seperti yang ditunjukkan pada Gambar S2A (Informasi Pendukung), fluoresensi lemah diamati dalam makrofag setelah inkubasi C6/RBCm@R8-Lip dan C6/RBCm@Lip selama 4 jam. Sebagai perbandingan, kelompok C6/Lip dan C6/R8-Lip menunjukkan fluoresensi yang kuat, yang menunjukkan bahwa liposom yang disamarkan oleh membran sel darah merah dapat memberikan strategi yang efektif untuk lolos dari pembersihan MPS, yang menguntungkan sirkulasi in vivo yang berkepanjangan. Setelah terakumulasi di lokasi tumor, R8 akan meningkatkan perilaku penyerapan obat oleh sel tumor. Dengan demikian, perilaku penyerapan seluler sel tumor, sel HepG2 dan MCF-7, dilakukan dengan analisis CLSM dan FCM. Seperti yang ditunjukkan pada Gambar 2A, B dan S5 (Informasi Pendukung), gambar CLSM mengungkapkan penyerapan seluler yang cepat dari kedua liposom yang dimodifikasi R8 C6/R8-Lip dan C6/RBCm@R8-Lip dengan fluoresensi hijau yang kuat yang diamati pada sel HepG2 dan MCF-7 setelah inkubasi selama 4 jam. Sebaliknya, sel tumor yang diobati dengan C6/Lip dan C6/RBCm@Lip memiliki fluoresensi yang relatif lebih lemah. Hasil kuantifikasi yang diukur dengan flow cytometry juga mengonfirmasi bahwa liposom yang dimodifikasi R8 memiliki perilaku penyerapan seluler yang lebih cepat oleh sel HepG2 dan MCF-7 karena adanya peningkatan efek penyerapan sel dari peptida R8 yang menembus sel.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Penyerapan seluler dan sitotoksisitas in vitro. Gambaran penyerapan seluler representatif dari A) HepG2 dan B) sel MCF-7 setelah inkubasi dengan Free C6, C6/Lip, C6/RBCm@Lip, C6/R8-Lip, C6/RBCm@R8-Lip, masing-masing, selama 4 jam dengan pengamatan CLSM dan dengan FCM. Skala batang: 40 µm (n = 3). Dan Sitotoksisitas Free Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip, Cel+TP/RBCm@R8-Lip terhadap C) HepG2 dan D) sel MCF-7 dengan perlakuan 24 jam dan 48 jam dalam media kultur yang berbeda. E) Deteksi sel hidup/mati setelah berbagai terapi. Skala batang: 100 µm. F) Kualitatif dan kuantitatif pewarnaan AnnexinV-FITC dan PI-PE pada sel HepG2 yang diobati dengan Free Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip, Cel+TP/RBCm@R8-Lip selama 24 jam (n = 3). Semua data disajikan sebagai mean ± SD. ANOVA satu arah dengan uji perbandingan berganda Tukey digunakan untuk analisis statistik. * p < 0,05.
Selanjutnya, obat kemoterapi Cel dan TP dienkapsulasi ke dalam liposom ini. Sitotoksisitas in vitro dari Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip dievaluasi terhadap sel tumor HepG2 dan MCF-7 menggunakan uji Cell Counting Kit-8 (CCK-8). Seperti yang ditunjukkan pada Gambar 2C,D , kelompok Cel+TP/R8-Lip dan kelompok Cel+TP/RBCm@R8-Lip menunjukkan toksisitas tergantung dosis terhadap sel tumor HepG2 dan MCF-7, yang lebih beracun daripada kelompok lain. Lebih jauh, pewarnaan sel hidup/mati juga dilakukan, seperti yang ditunjukkan pada Gambar 2E dan S6 (Informasi Pendukung), baik kelompok Cel+TP/R8-Lip maupun kelompok Cel+TP/RBCm@R8-Lip menunjukkan fluoresensi merah intens yang menunjukkan efek penghambatan pertumbuhan sel yang kuat, yang konsisten dengan hasil analisis CCK-8. Kami selanjutnya mengevaluasi apakah Cel+TP/RBCm@R8-Lip akan meningkatkan apoptosis pada sel tumor. Percobaan apoptosis dianalisis melalui pewarnaan annexin V-fluorescein isothiocyanate (FITC)/propidium iodide-phycoerythrin (PI-PE). Seperti yang ditunjukkan pada Gambar 2F , setelah inkubasi dengan konsentrasi setara 0,01 µ M TP dan 1 µ M Cel selama 24 jam, semua formulasi liposom menghasilkan tingkat apoptosis yang lebih tinggi daripada TP dan Cel bebas. Khususnya, Cel+TP/RBCm@R8-Lip menginduksi tingkat apoptosis tertinggi, yang berkontribusi pada perilaku penyerapan seluler yang lebih baik.
2.5 Biodistribusi In Vivo dan Khasiat Antitumor terhadap Tikus yang Membawa Tumor H22
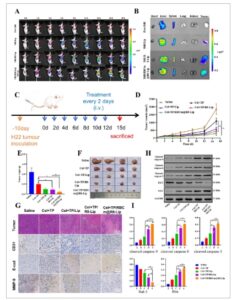
Untuk mengevaluasi biodistribusi RBCm@R8-Lip dalam jaringan tumor in vivo, liposom yang dimuat DiR disuntikkan secara intravena ke tikus nude pembawa tumor H22 dan dipantau oleh sistem pencitraan in vivo (IVIS) pada titik waktu yang dijadwalkan. Seperti yang ditunjukkan pada Gambar 3A , sinyal fluoresensi DiR/RBCm@R8-Lip terdeteksi secara jelas di lokasi tumor pada 1 jam pasca-injeksi dan secara bertahap meningkat seiring waktu, dan dipertahankan pada tingkat tinggi hingga 48 jam, yang secara signifikan lebih tinggi daripada DiR bebas, DiR/Lip dan DiR/R8-Lip. Bukti tersebut menunjukkan bahwa efek sirkulasi panjang dari strategi kamuflase membran RBC dan efek penargetan peptida R8 dapat membantu RBCm@R8-Lip secara efisien terkirim ke lokasi tumor H22. Setelah 48 jam pasca-perawatan, tikus dikorbankan, dan organ utama serta jaringan tumor diangkat untuk pencitraan ex vivo. Pada Gambar 3B , intensitas fluoresensi DiR/RBCm@R8-Lip di sekitar tumor jauh lebih tinggi daripada kelompok DiR/@R8-Lip, DiR/Lip, Free DiR. Hasil ini menunjukkan bahwa sirkulasi yang diperluas secara in vivo dan akumulasi yang ditargetkan pada tumor dapat ditingkatkan secara efisien dengan enkapsulasi dalam RBCm@R8-Lip. Berikutnya, kami mengevaluasi efek antitumor dari liposom biomimetik. Tikus dibagi secara acak menjadi lima kelompok, dan diberikan secara intravena dengan saline, TP+Cel, Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip dengan dosis TP 0,024 mg kg −1 dan dosis Cel 3 mg kg −1 setiap dua hari untuk total tujuh perawatan pada tikus pembawa tumor H22 (Gambar 3C ). Selama periode perawatan, kurva pertumbuhan tumor diukur. Seperti yang ditunjukkan pada Gambar 3D , pemberian Cel+TP/RBCm@R8-Lip memperlambat laju pertumbuhan tumor secara signifikan, yang menunjukkan peningkatan kemanjuran terapi terhadap tumor secara dramatis. Selain itu, berat tumor (Gambar 3E ) menunjukkan tren yang sama dengan volume tumor (Gambar 3F ) pada setiap kelompok, kelompok liposom biomimetik juga menunjukkan berat tumor minimum dibandingkan dengan kelompok lain. Temuan ini menunjukkan bahwa liposom biomimetik juga memiliki efek antitumor yang lebih baik secara in vivo.
Buka di penampil gambar
Presentasi PowerPoint
Biodistribusi in vivo dan efek anti-tumor liposom biomimetik pada model tikus tumor pembawa H22. A) Distribusi fluoresensi tikus pembawa tumor H22 setelah injeksi vena pada interval waktu yang telah ditentukan, yaitu, 0, 1, 2, 6, 8, 12, 24, 36, dan 48 jam setelah injeksi. B) Gambar fluoresensi ex vivo tikus pembawa tumor H22 dari organ yang dibedah pada tikus 48 jam pasca-injeksi. C) Diagram skema pemberian obat. D) Kurva pertumbuhan tumor dari berbagai kelompok dalam seluruh periode percobaan. E) Berat jaringan tumor yang dipanen ini. F) Foto representatif tumor yang diangkat dari setiap kelompok perlakuan pada hari ke-15. G) Pewarnaan imunohistokimia jaringan tumor yang berasal dari tikus tumor pembawa H22. Pewarnaan H&E dan pewarnaan imunohistokimia CD31, E-cad, MMP-9. H) Ekspresi protein yang berhubungan dengan jalur apoptosis (caspase 9 terbelah, caspase 8 terbelah, caspase 3 terbelah, Bcl-2, dan BAX) dievaluasi dengan western blot. I) Evaluasi kuantitatif tingkat ekspresi protein ini. Semua percobaan diulang empat kali (n = 4), dan data disajikan sebagai mean ± SD. ANOVA satu arah dengan uji perbandingan berganda Tukey digunakan untuk analisis statistik. * p < 0,05.
Sementara itu, efek liposom biomimetik dalam metastasis migrasi dan jalur terkait apoptosis dianalisis lebih lanjut. Seperti yang ditunjukkan pada Gambar 3G , kerusakan apoptosis parah ditemukan pada tumor H22 pada kelompok yang diobati Cel+TP/RBCm@R8-Lip dibandingkan dengan kelompok lain, yang konsisten dengan hasil percobaan hewan yang disebutkan di atas. Temuan ini juga dievaluasi dengan imunohistokimia untuk CD31, E-cad, dan MMP-9. Diketahui bahwa CD31 adalah salah satu penanda sel endotel vaskular yang dapat digunakan untuk menilai angiogenesis tumor, dan tingkat ekspresi E-cad dan MMP-9 dapat mencerminkan metastasis sel tumor. [ 21 ] Kami menemukan bahwa tingkat ekspresi CD31 dan MMP-9 berkurang secara signifikan pada kelompok Cel+TP/RBCm@R8-Lip dibandingkan dengan kelompok lain, sementara jumlah sel positif E-cad lebih tinggi daripada kelompok lain, yang menunjukkan kemampuan antiangiogenik liposom biomimetik yang sangat baik. Analisis WB juga digunakan untuk mengevaluasi kadar protein jalur apoptosis seperti kaspase 9 terbelah, kaspase 8 terbelah, kaspase 3 terbelah, Bcl-2, dan Bax. Seperti yang ditunjukkan pada Gambar 3H,I , dibandingkan dengan kelompok kontrol, kadar protein kaspase 9 terbelah, kaspase 8 terbelah, kaspase 3 terbelah, dan BAX meningkat secara signifikan oleh Cel+TP/RBCm@R8-Lip, dan lebih sedikit ekspresi Bcl-2 yang muncul dalam kelompok liposom biomimetik.
2.6 Biodistribusi In Vivo dan Khasiat Antitumor Terhadap Tikus yang Membawa Tumor 4T1
Untuk menyelidiki fleksibilitas liposom biomimetik dalam terapi anti-tumor in vivo, model tikus pembawa tumor 4T1 lebih lanjut ditetapkan. Kami pertama-tama menyelidiki nasib liposom in vivo pada tikus pembawa tumor 4T1. Demikian pula, DiR/RBCm@R8-Lip juga menunjukkan sinyal fluoresensi terkuat di lokasi tumor dibandingkan dengan DiR bebas, DiR/Lip, dan DiR/R8-Lip ( Gambar 4A ). Pencitraan organ utama secara ex vivo setelah 48 jam pasca-perawatan, DiR/RBCm@R8-Lip menunjukkan akumulasi yang jauh lebih tinggi di lokasi tumor, karena perlindungan membran sel darah merah dan endositosis yang dimediasi R8 (Gambar 4B ). Selanjutnya, kami mengevaluasi efek antitumor liposom biomimetik terhadap tikus pembawa tumor 4T1. Tikus dibagi secara acak ke dalam lima kelompok, dan diberikan secara intravena dengan saline, TP+Cel, Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip dengan dosis obat yang sama setiap dua hari untuk total sepuluh perlakuan (Gambar 4C ). Seperti yang ditunjukkan pada Gambar 4D , kelompok perlakuan Cel+TP/RBCm@R8-Lip menunjukkan efek penghambatan tumor yang ditingkatkan. Ditemukan bahwa ada sedikit perbedaan dalam ukuran tumor antara kelompok Cel+TP/RBCm@R8-Lip dan kelompok Cel+TP/R8-Lip, tetapi berat tumor berkurang secara signifikan pada kelompok Cel+TP/RBCm@R8-Lip, seperti yang ditunjukkan pada Gambar 4E,F . Temuan ini menunjukkan liposom biomimetik juga memiliki efek anti-tumor yang lebih baik pada model tumor 4T1.
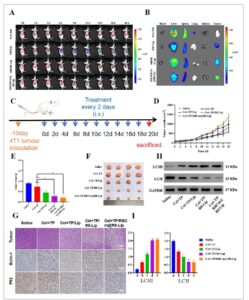
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Biodistribusi in vivo dan efek anti-tumor liposom biomimetik pada model tikus tumor pembawa 4T1. A) Distribusi fluoresensi tikus pembawa tumor 4T1 in vivo setelah injeksi vena pada interval waktu yang telah ditentukan, yaitu, 0, 1, 2, 6, 8, 12, 24, 36, dan 48 jam setelah injeksi. B) Gambar fluoresensi ex vivo tikus pembawa tumor 4T1 dari organ tikus yang dibedah 48 jam pasca-injeksi. C) Diagram skema pemberian obat. D) Kurva pertumbuhan tumor dari berbagai kelompok dalam seluruh periode percobaan. E) Berat jaringan tumor yang dipanen ini. F) Foto representatif tumor yang diangkat dari setiap kelompok perlakuan pada hari ke-20. G) Pewarnaan imunohistokimia jaringan tumor yang berasal dari tikus tumor pembawa 4T1. Pewarnaan H&E dan pewarnaan imunohistokimia Bclin-1, P62. H) Ekspresi protein yang berhubungan dengan jalur autofagi (LC3II, LC3I) dievaluasi dengan western blot. I) Evaluasi kuantitatif tingkat ekspresi protein ini. Semua percobaan diulang empat kali (n = 4), dan data disajikan sebagai mean ± SD. ANOVA satu arah dengan uji perbandingan berganda Tukey digunakan untuk analisis statistik. * p < 0,05.
Lebih jauh, imunohistokimia dan analisis WB juga digunakan untuk mengevaluasi kadar jalur autofagi. Seperti yang ditampilkan dalam Gambar 4G , kadar Bclin-1 dan P62 mengindikasikan bahwa Cel+TP/RBCm@R8-Lip dapat memberikan efek antitumor dengan mendorong autofagi sel tumor. Dalam Gambar 4H, liposom biomimetik secara signifikan meningkatkan kadar protein LC3II, dan menurunkan ekspresi LC3I. Hasil tersebut mengindikasikan bahwa liposom biomimetik dapat memberikan efek antitumor dengan bekerja pada jalur terkait autofagi.
2.7 Biokompatibilitas
Untuk memastikan biosafety formulasi obat untuk injeksi intravena lebih lanjut, analisis hemolisis R8-Lip dan RBC@R8-Lip dilakukan terhadap sel darah merah. PBS dan air masing-masing digunakan sebagai kontrol positif dan negatif. Seperti yang ditunjukkan pada Gambar S2B (Informasi Pendukung), R8-Lip menunjukkan sedikit hemolisis yang mungkin disebabkan oleh sifat kation. Sebaliknya, RBCm@R8-Lip menunjukkan aktivitas hemolitik yang hampir dapat diabaikan (kurang dari 3%) pada konsentrasi hingga 50 µg/mL tidak menginduksi eritrosit untuk melepaskan hemoglobin, dan tidak ada aglutinasi yang terlihat selama inkubasi dengan RBC, yang menyiratkan bahwa strategi kamuflase membran RBC mengurangi interaksi non-spesifik dengan membran RBC, sehingga menghasilkan biokompatibilitas yang baik untuk pemberian intravena.
Mengingat toksisitas parah TP dan Cel, kami menilai efek toksik liposom biomimetik melalui analisis biokimia serum dan H&E pada model H22 dan 4T1. Seperti yang ditunjukkan pada Gambar S3 dan S4 (Informasi Pendukung), kelompok liposom biomimetik memiliki lesi yang tidak terlalu parah. Selain itu, kadar ALT, AST, CREA, UA, dan UREA dalam darah secara signifikan lebih tinggi pada kelompok Cel+TP dan liposom, bukan pada kelompok liposom biomimetik.
3 Kesimpulan
Singkatnya, kami berhasil mengembangkan liposom biomimetik yang dilapisi membran sel darah merah dan dimodifikasi dengan peptida yang menembus sel. Cel+TP/RBCm@R8-Lip yang diperoleh menunjukkan enkapsulasi obat yang sangat tinggi dan stabilitas yang sangat baik. Disebabkan oleh kamuflase membran sel darah merah dan internalisasi sel tumor yang dimediasi R8, liposom biomimetik telah terbukti menunjukkan efek antitumor yang sangat baik baik pada model kanker payudara maupun kanker hati. Analisis imunohistokimia dan WB selanjutnya menggambarkan bahwa Cel+TP/RBCm@R8-Lip mencapai efek antikanker yang terkait dengan jalur migrasi sel tumor, autofagi, dan apoptosis. Mengingatkan pada kemotaksis alami, karya ini memberikan strategi modifikasi ganda yang mudah untuk pengiriman obat yang ditargetkan, menawarkan solusi baru untuk aplikasi klinis obat berbasis CPP.
4 Bagian Eksperimen
Efek Sinergis TP dan Sel
Sitotoksisitas campuran TP/Cel dengan peningkatan konsentrasi TP dan Cel tetapi rasio molar konstan (TP/Cel = 1/100) dipelajari dengan uji CCK-8 untuk HepG2 (garis sel kanker hati manusia) dan MCF-7 (garis sel kanker payudara manusia). Secara singkat, sel diperlakukan dengan konsentrasi yang berbeda (7,5, 10, 15, 20, 25, dan 30 nm ) TP, Cel dan rasio molar TP dan Cel adalah 1:100 selama 48 jam. Kemudian, larutan CCK-8 ditambahkan ke setiap sumur dan diinkubasi dengan sel selama 4 jam. OD produk formazan diukur pada 450 nm menggunakan pembaca mikroplat (Thermo Fisher Scientific, Inc.). Perangkat lunak GraphPad digunakan untuk menghitung setengah konsentrasi penghambatan 50 (IC 50 ). [ 22 ]
Persiapan Vesikel RBC
Vesikel sel darah merah disiapkan mengikuti metode yang dilaporkan sebelumnya dengan beberapa modifikasi. [ 23 ] Darah segar utuh dikumpulkan dari tikus dan disimpan dalam tabung heparin untuk antikoagulasi. Kemudian, darah disentrifugasi pada 3000 rpm selama 5 menit pada suhu 4 °C untuk menghilangkan plasma. Setelah mencuci sel darah merah yang dikumpulkan dengan garam penyangga fosfat (PBS) sebanyak 3 kali, sel darah merah yang dihasilkan melalui perlakuan hipotonik dengan mendispersikan kembali sel darah merah yang telah dicuci ke dalam 0,25×PBS selama 1 jam pada suhu 4 °C. Selanjutnya, larutan sel darah merah disentrifugasi pada 12.000 rpm selama 5 menit pada suhu 4 °C hingga supernatan tampak tidak berwarna. Akhirnya, hantu sel darah merah diperoleh dan ditempatkan dalam lemari es −80 °C untuk penyimpanan. Kemudian, RBCv (vesikel membran sel darah merah) disiapkan dari sel darah merah yang diperoleh melalui ekstrusi sonik. Secara singkat, sel darah merah disuspensikan kembali dalam air dengan sonikasi selama 3 menit pada frekuensi 40 kHz dan daya 100 W. RBCv yang dihasilkan disimpan dalam air pada suhu 4 °C sebelum digunakan.
Persiapan dan Karakterisasi Cel+TP/RBCm@R8-Lip
Liposom inti yang dimuat Cel/TP terutama dibuat dengan metode injeksi etanol biasa. [ 24 ] Secara khusus, larutan stok TP dan Cel disiapkan pada konsentrasi 1 dan 10 mg mL −1 , campuran lesitin kuning telur, kolesterol dan dspe-peg 2000-mal pada rasio massa 10,5:2,625:3 dilarutkan dalam 335 µL etanol. Masing-masing. Dan dicampur dengan larutan TP 65 µL dan larutan Cel 600 µL. Kemudian, penambahan tetes demi tetes campuran di atas ke dalam 9 mL air deionisasi dilakukan dengan pengadukan terus-menerus pada suhu 60 °C selama 1 jam. Suspensi liposom disonikasi selama 5 menit pada amplitudo 50% dalam penangas es menggunakan sistem disrupsi sel ultrasonik. dan kemudian dilewatkan melalui filter milipore 0,45 µm. Suspensi liposom disimpan pada suhu 4 °C. Untuk menyiapkan Cel+TP/R8-Lip, larutan stok R8 disiapkan pada konsentrasi 1 mg mL −1 , 500 µL larutan R8 dicampur dengan suspensi liposom di atas dan diinkubasi pada suhu kamar selama 1 jam. Cel+TP/R8-Lip diperoleh setelah penyaringan dengan filter jarum suntik 0,45 µm. Untuk membungkus Cel+TP/R8-Lip ke dalam vesikel RBC, 1 mL vesikel RBC dicampur dengan 1 mL Cel+TP/R8-Lip, campuran tersebut disonikasi selama 3 menit (40 kHz, 100 W) dan dilewatkan melalui filter 0,45 µm untuk menghilangkan vesikel RBC yang berlebih. [ 25 ] Cel+TP/RBCm@R8-Lip yang diperoleh disimpan pada suhu 4 °C untuk eksperimen lebih lanjut.
Karakterisasi Protein
Elektroforesis gel poliakrilamid-natrium dodecyl sulfate (SDS-PAGE) digunakan untuk identifikasi kualitatif protein pada permukaan membran. [ 26 , 27 ] Secara khusus, vesikel RBC, Lip, dan RBCm@Lip diencerkan dengan buffer pemuatan sebagaimana diukur oleh kit uji BCA dan direbus dalam air selama 5 menit. Sampel sebanyak 10 µL dimuat ke dalam alur gel. Selanjutnya, elektroforesis dilakukan pada tegangan konstan 90 V selama 15 menit dan 110 V selama 90 menit. Gel diwarnai dengan biru Coomassie, dicuci dengan air deionisasi, dan kemudian dicitrakan. Selanjutnya, protein CD47 yang berasal dari eritrosit ditentukan dengan analisis western-blotting (WB). Semua protein dalam setiap sampel dipisahkan dengan SDS-PAGE 10% dan ditransfer ke membran polivinilidena difluorida (PVDF). Membran PVDF yang ditransfer diblokir dengan 5% susu, dan kemudian diinkubasi dengan antibodi primer terhadap CD47 selama 12 jam pada suhu 4 °C. Akhirnya, membran diinkubasi dengan antibodi sekunder terkonjugasi HRP dan diamati oleh sistem pencitraan. Untuk memeriksa aktivasi imun in vitro dari pembawa liposom biomimetik, kompleks liposom–protein disiapkan dengan menginkubasi liposom dengan plasma (3:1 v/v) pada suhu 37 °C selama 30 menit, yang menurut penyelidikan sebelumnya dengan sedikit penyesuaian. [ 28 ] Kompleks liposom–protein dikumpulkan dengan sentrifugasi selama 15 menit pada 14.000 rpm dengan pencucian PBS tiga kali untuk menghilangkan protein yang tidak terikat. Selanjutnya, kandungan protein liposom dan kompleks liposom–protein diukur dengan kit BCA, komposisi mahkota protein (PC) diselidiki oleh SDS-PAGE. Selanjutnya, komposisi PC dilakukan oleh sistem Easy-nLC 1200 yang digabungkan dengan Orbitrap Eclipse Mass Spectrometer (Thermo Fisher Scientific, AS) dengan sumber nanospray ESI. Secara khusus, blok gel target dipotong setelah elektroforesis dan ditempatkan dalam tabung EP untuk dihilangkan warnanya hingga transparan, protein direduksi dan dialkilasi menggunakan DTT dan IAA, secara terpisah. Kemudian, tripsin ditambahkan semalaman pada suhu 37 °C, sampel yang diliofilisasi dilarutkan kembali dengan 0,1% FA dan dideteksi oleh LC–MS/MS, dicari oleh Maxquant (1.6.5.0), tingkat positif palsu identifikasi protein dikendalikan hingga kurang dari 1%.
Endositosis oleh Makrofag
Untuk mempelajari endositosis liposom dan pembawa liposom biomimetik oleh makrofag dalam sistem imun, penyerapan seluler pembawa liposom oleh sel makrofag RAW264.7 dievaluasi dengan mikroskopi pemindaian laser confocal (CLSM, TCS SP8 SR; Leica, Weztlar, Jerman) dan flow cytometry (FCM, BD FACSVerseTM, Franklin Lake, NJ, AS). Sel RAW264.7 disemai dengan kepadatan 1 × 105 sel well −1 ke dalam cawan confocal, liposom yang dimuat C6 ( Coumarin 6) ditambahkan ke sel RAW264.7 dengan konsentrasi akhir C6 100 ng mL −1 pada 37 °C selama 4 jam. Kemudian dicuci secara menyeluruh dengan PBS, difiksasi dengan poliformaldehida 4% selama 10 menit dan kemudian diwarnai dengan Hoechst 33 342 untuk inti. Akhirnya, situasi penyerapan dievaluasi dengan pencitraan CLSM. Sel RAW264.7 disemai pada kepadatan 3,5 × 105 sel well −1 dalam cawan 6-well. Setelah diinkubasi semalaman dan diobati dengan obat-obatan di atas selama 4 jam. Akhirnya, sel-sel dikumpulkan dan disuspensikan dalam PBS. Fluoresensi C6 intraseluler dideteksi oleh FCM dan dianalisis dengan perangkat lunak FlowJo.
Penyerapan Seluler
Uji penyerapan sel tumor juga dilakukan dalam FCM dan CLSM. Dua jenis sel tumor dipilih dan diinkubasi dalam pelat 6-sumur dengan kepadatan 3 × 105 sel sumur −1 dan dikultur semalaman. Prosedur selanjutnya sama dengan yang dijelaskan dalam endositosis oleh makrofag.
Sitotoksisitas In Vitro
Sel HepG2 dan sel MCF-7 disemai dalam pelat 96-sumur dengan kepadatan rata-rata 5 × 103 sel per sumur, setelah kultur semalam, sel diinkubasi dengan media kultur segar yang mengandung Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip dan Cel+TP/RBCm@R8-Lip selama 24 jam dan 48 jam. 10 µL CCK8 ditambahkan dan diinkubasi bersama sel selama 4 jam pada suhu 37 °C. Akhirnya, kepadatan optik diukur pada 450 nm dengan pembaca pelat mikroplat. Untuk lebih memvisualisasikan sitotoksisitas setiap kelompok, sel HepG2, dan sel MCF-7 diinkubasi dengan empat kelompok selama 24 jam, termasuk Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip. TP dan Cel diberikan pada konsentrasi setara 0,01 dan 1 µ m secara terpisah. Semua sel kemudian dicuci dalam PBS, diperlakukan dengan Calcein-AM dan PI sesuai petunjuk pabrik, dan diamati dengan mikroskop fluoresensi.
Apoptosis
Sel HepG2 ditanam di dalam plat 12 sumur dan dikultur semalaman. Sel HepG2 diobati dengan lima kelompok selama 24 jam, termasuk kontrol, Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip. TP dan Cel ditambahkan pada konsentrasi setara 0,01 dan 1 µ m dalam kelompok, masing-masing. Sel dikumpulkan dan diobati dengan eBioscience Annexin V-FITC Apoptosis Detection Kit (BMS500FI-300), dan kemudian dideteksi dengan flow cytometry dalam waktu 4 jam.
Hewan
Percobaan pada hewan dilakukan berdasarkan izin dari Komite Etika Hewan Universitas Pengobatan Tradisional Tiongkok Chengdu (Chengdu, Tiongkok) (nomor izin SYXK2020-124), semua percobaan dilakukan sesuai dengan peraturan terkait.
Biodistribusi In Vivo
Akumulasi lokal pembawa liposom dievaluasi lebih lanjut oleh sistem pencitraan fluoresensi IVIS. Tikus nude pembawa tumor H22 dan 4T1 dibuat dengan injeksi subkutan ≈1 × 107 sel H22 dan 4T1 ke sisi kanan tikus ICR jantan dan tikus nude BALB/c betina, secara terpisah. Setiap tikus pembawa tumor secara acak dimasukkan ke dalam empat kelompok dan injeksi DiR bebas, DiR Lip, DiR/R8-Lip, dan DiR/RBCm@R8-Lip melalui vena ekor pada konsentrasi DiR masing-masing sebesar 0,5 mg kg −1 . Pada titik waktu yang telah ditentukan (0, 1, 2, 6, 8, 12, 24, 36, dan 48 jam) setelah pemberian, perubahan intensitas fluoresensi pada tikus diamati oleh sistem pencitraan fluoresensi IVIS (PerkinElmer). Pada titik akhir, tikus dikorbankan untuk mendapatkan usus dan tumor, dan segera dicitrakan.
Studi Terapi In Vivo
Tikus pembawa tumor H22 menerima suntikan iv 200 µL saline, Cel+TP, Cel+TP/Lip, Cel+TP/R8-Lip, dan Cel+TP/RBCm@R8-Lip dengan dosis TP 0,024 mg kg −1 dan dosis Cel 3 mg kg −1 . Ukuran tumor dan berat tubuh dipantau selama pemberian. Pada akhir percobaan, sampel darah dan organ utama (termasuk jantung, hati, limpa, paru-paru, dan ginjal) dikumpulkan untuk pengujian lebih lanjut. Untuk menyelidiki generalisasi sistem co-delivery ini untuk pengobatan kanker. Sel 4T1 digunakan untuk membangun model tikus pembawa tumor lainnya. Metode percobaan konsisten dengan yang digunakan untuk tikus pembawa tumor H22. Lebih jauh, efek perawatan liposom pada metastasis agresif tumor dan efikasi penekanan angiogenesis dievaluasi dengan pewarnaan imunohistokimia CD31, E-cad, MMP-9, Bclin-1 dan P62. Selain itu, western blotting (WB) juga dilakukan untuk menilai ekspresi protein pensinyalan yang terlibat dalam apoptosis dan autofagi, termasuk kaspase 9 terbelah, kaspase 8 terbelah, kaspase 3 terbelah, Bcl-2, BAX, LC3II, dan LC3I.
Keamanan Hayati
Disrupsi membran eritrosit digunakan untuk menilai efek hemolitik pembawa liposom. [ 29 ] eritrosit 2% dicampur dengan berbagai konsentrasi (1, 10, 20, 30, 50, dan 100 µg mL −1 ) larutan pembawa liposom dalam volume yang sama. Demikian pula, eritrosit 2% dicampur dengan air murni digunakan sebagai kontrol positif, dan dicampur dengan garam fisiologis digunakan sebagai kontrol negatif. Campuran diinkubasi pada suhu 37 °C selama 4 jam. Setelah itu, semua sampel disentrifugasi pada 3000 rpm selama 5 menit pada suhu 4 °C sebelum mengukur absorbansi supernatan pada 540 nm. Persentase hemolisis dihitung menurut rumus berikut: Hemolisis (%) = (I sampel – I neg / I pro – I neg ) ×100%. Akhirnya, gambaran histologis organ utama dievaluasi menggunakan pewarnaan H&E dan menentukan beberapa indeks biokimia darah termasuk ALT, AST, CREA, UA, dan UREA.
Analisis Statistik
Evaluasi statistik dilakukan dengan menggunakan perangkat lunak GraphPad Prism versi 8.0.2. Semua data dinyatakan sebagai rata-rata ± simpangan baku (SD). Perbedaan statistik antara hasil eksperimen dinilai dengan ANOVA satu arah. Signifikansi statistik ditetapkan pada p < 0,05.
