Pengaruh Kekakuan Nanopartikel terhadap Interaksi Partikel Membran Stroma dengan Sel Leukemia
Abstrak
Pada leukemia myeloid akut (AML), kekambuhan penyakit sering diamati karena sel punca leukemia yang resistan terhadap terapi yang memulai kembali penyakit tersebut. Sel punca leukemia dapat berasosiasi erat dengan sel stroma mesenkimal di dalam sumsum tulang, yang dianggap lebih lanjut mendorong resistensi obat. Di sini, membran sel dari sel stroma sumsum tulang digunakan untuk menyiapkan nanopartikel membran sel dan mempelajari interaksinya dengan sel AML. Liposom membran sel (CM-Liposom) dengan muatan berbeda disiapkan dan digunakan secara langsung, atau setelah pengendapan pada inti silika untuk memodulasi sifat mekanis nanopartikel. Ukuran nanopartikel, potensi zeta, dan efisiensi pelapisan dianalisis dengan pencitraan hamburan cahaya dinamis (DLS) dan mikroskop elektron kriogenik (Cryo-EM). Mikroskopi gaya atom (AFM) digunakan untuk mengkarakterisasi sifat mekanis CM-Liposom dan mengonfirmasi pengendapan dwilapis pada inti silika. Akhirnya, penyerapan oleh sel leukemia ditentukan. Tidak ditemukan perbedaan dalam penyerapan antara Liposom CM lunak dan liposom dengan komposisi yang sama tanpa komponen membran. Sebaliknya, setelah pengendapan pada inti yang kaku, penyerapan lebih tinggi untuk partikel membran sel. Hasil awal pada sel primer dari pasien leukemia mengonfirmasi pengamatan ini. Hasil ini menunjukkan bahwa kekakuan nanopartikel sangat memengaruhi interaksi antara nanopartikel membran sel dan sel yang ditargetkan.
1 Pendahuluan
Liposom membran sel (CM-Liposom) dan nanopartikel berlapis membran sel telah menarik minat yang meningkat karena potensi penggunaannya sebagai pembawa obat. Dengan menampilkan komponen membran sel pada permukaan nanopartikel, interaksi atau fungsi seluler yang terjadi secara alami dapat dimanfaatkan untuk pengiriman obat, vaksinasi atau pengobatan. [ 1 – 5 ] Misalnya, nanopartikel kamuflase membran sel telah terbukti memungkinkan waktu sirkulasi yang lebih lama. [ 2 , 6 ] Selain itu, nanopartikel membran sel kanker memanfaatkan interaksi antara sel-sel kanker untuk mencapai apa yang disebut “penargetan homotipe”. [ 5 , 7 – 9 ] Mengekspresikan antigen kanker pada nanopartikel membran sel yang terbuat dari sel kanker memberikan peluang tambahan untuk vaksinasi. [ 5 ] Baru-baru ini, cmembran bahkan telah direkayasa dengan reseptor SpyCatcher buatan, yang dapat membentuk ikatan dengan protein apa pun yang diinginkan yang menawarkan fungsionalitas yang belum pernah ada sebelumnya. [ 10 , 11 ] Ide di balik aplikasi ini adalah bahwa protein membran di permukaan nanopartikel berinteraksi secara spesifik dengan sel-sel yang ditargetkan. Namun, prinsip inti tentang bagaimana peniru membran ini mengelola (atau gagal) memfasilitasi interaksi dengan reseptor pada sel yang berinteraksi masih kurang dipahami.
Secara umum diketahui bahwa penyerapan nanopartikel sangat dipengaruhi oleh sifat-sifat nanopartikel, seperti ukuran, bentuk, dan muatannya. [ 12 – 15 ] Baru-baru ini, sifat-sifat mekanik nanopartikel juga telah ditunjukkan untuk mempengaruhi biodistribusi dan penyerapan seluler. [ 16 – 18 ] Namun, hasil yang saling bertentangan telah dilaporkan mengenai apakah penyerapan lebih disukai untuk nanopartikel yang lebih lunak atau lebih kaku, [ 19 , 20 ] juga tergantung pada jenis nanomaterial dan rentang kekakuannya, [ 20 ] serta sel yang digunakan untuk penelitian. [ 20 ] Misalnya, silika berlapis lipid kaku (LCS) menunjukkan penyerapan yang lebih tinggi dibandingkan dengan liposom lunak dengan komposisi yang sama. [ 21 ] Salah satu penjelasan untuk penyerapan yang lebih tinggi yang diamati dalam banyak kasus untuk bahan yang lebih kaku adalah bahwa partikel kaku lebih mudah diselimuti oleh membran dan – sebagai akibatnya – oleh reseptornya, meningkatkan interaksi, sehingga memfasilitasi internalisasi mereka. [ 22 ] Banyak penelitian sejauh ini menggunakan partikel sintetis (lipid) dan partikel lapis demi lapis untuk menyiapkan nanopartikel dengan sifat mekanik yang berbeda, karena kemudahan pembuatannya, dan kontrol kekakuan yang mudah dengan memvariasikan kepadatan ikatan silang. [ 20 ] Sebaliknya, dalam konteks nanopartikel membran sel biologis, kurang diketahui tentang bagaimana sifat mekanik memodulasi interaksi antara protein membran pada nanopartikel dan protein pada sel yang berinteraksi. Di sini, kami akan berargumen bahwa mekanisme serupa mungkin ada, di mana nanopartikel membran yang lebih kaku dapat menekan membran sel dari sel yang ditargetkan ( Gambar 1 a,b ), [ 22 , 23 ] yang mengarah ke area kontak yang lebih besar, dan dengan cara ini memungkinkan lebih banyak protein pada nanopartikel membran sel untuk (secara spesifik) berinteraksi dengan membran target dan sebaliknya. [ 24 ] Selain itu, beberapa penelitian telah menunjukkan bahwa nanopartikel membran sel yang tertutup sebagian dapat secara dinamis membentuk aglomerat kecil, yang memungkinkan nanopartikel berinteraksi dengan beberapa reseptor pada membran (Gambar 1c ). [ 25 ] Menurut hipotesis ini, peningkatan luas kontak setelah penggumpalan parsial pada permukaan sel membantu interaksi dengan banyak reseptor sel dan – dengan cara ini – mendorong internalisasi nanopartikel membran yang efisien. [25 ]

Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Representasi skematis dari hipotesis yang diuji dalam penelitian ini. Tujuan dari pekerjaan ini adalah untuk mempelajari bagaimana kekakuan dan muatan nanopartikel memengaruhi interaksi nanopartikel membran sel dengan sel target: a) CM-Liposom (CML) yang lebih lunak dan dapat dideformasi mungkin tidak dapat membengkokkan membran sel dan memiliki area kontak yang rendah. [ 22 ] b) Nanopartikel berlapis membran kaku dapat menekan membran sel target dan membengkokkannya. [ 22 , 24 ] c) Aglomerat nanopartikel membran kaku yang dilapisi sebagian dapat terbentuk dan dapat menekan membran sel, meningkatkan area kontak. [ 25 ] d) Gambaran skematis nanopartikel model lunak dan kaku yang digunakan dalam penelitian ini yang disusun berdasarkan muatan (potensial zeta, sumbu x) dan sifat mekanis (kekakuan, sumbu y). Dibuat dalam BioRender, de Weerd, S. (2024) https://BioRender.com/k44t679 .
Dalam konteks ini, tujuan dari penelitian ini adalah (I) untuk menentukan apakah CM-Liposom yang dibuat dengan membran sel stroma sumsum tulang dapat digunakan untuk meningkatkan interaksi dengan sel kanker leukemia (sel induk) dan (II) untuk memodulasi kekakuan dan muatan CM-Liposom untuk menilai efeknya pada interaksi yang dihasilkan dengan sel sasaran.
Sel kanker leukemia diketahui berinteraksi kuat dengan sel stroma di sumsum tulang dan ceruk sumsum tulang sangat memengaruhi patofisiologi leukemia. [ 26 – 32 ] Konsisten dengan ini, studi in vitro menunjukkan bahwa sel kanker leukemia berinteraksi kuat dengan sel stroma tikus MS5 dan didukung olehnya dalam kultur. [ 33 – 37 ] Lebih jauh lagi, CM-Liposom leukemia atau partikel berlapis telah digunakan untuk menargetkan dan mengobati ceruk sumsum tulang, [ 9 , 38 , 39 ] dan sel punca hematopoietik atau sel leukemia yang diobati dengan nitrogen telah digunakan untuk memberikan obat ke ceruk tersebut juga. [ 40 , 41 ] Berdasarkan pengamatan ini, daripada pendekatan umum dalam nanoteknologi membran sel, di mana CM-Liposom yang dibuat dengan membran sel target digunakan untuk memanfaatkan “penargetan homotipe”, kami tertarik untuk mempelajari apakah dan bagaimana CM-Liposom yang berasal dari sel stroma yang berinteraksi dapat digunakan untuk meningkatkan penyerapan nanopartikel oleh sel leukemia dan sel induk leukemia. [ 42 , 43 ]
Untuk tujuan ini, liposom zwitterionik dan liposom bermuatan negatif yang terbuat dari campuran lipid yang menyerupai komposisi membran sel disiapkan (Gambar 1 ). [ 44 , 45 ] Lipid zwitterionik sering digunakan karena ikatan tidak spesifiknya yang rendah ke membran. [ 46 ] CM-Liposom dihasilkan dengan menambahkan membran sel stroma sumsum tulang MS5 ke dua jenis liposom dan sifat mekanik serta akumulasinya dalam lini sel leukemia diselidiki. Liposom dan CM-Liposom yang sama juga diendapkan pada nanopartikel silika untuk menguji efek peningkatan kekakuan saat pengendapan pada inti anorganik keras pada interaksi yang dihasilkan dengan sel leukemia (Gambar 1 ). Ukuran, muatan, efisiensi pelapisan, dan sifat mekanik dari berbagai liposom dan CM-Liposom dikarakterisasi menggunakan pencitraan Dynamic Light Scattering (DLS), Atomic Force Microscopy (AFM), dan Cryo-Electron Microscopy (Cryo-EM). Dengan menggunakan flow cytometry untuk mengukur penyerapan, afinitas masing-masing formulasi terhadap lini sel leukemia yang relevan (K562, THP1, MOLM13) diteliti. Akhirnya, untuk komposisi fungsional, percobaan awal pada sel punca dan sel leukemia primer pasien manusia dilakukan, untuk mengonfirmasi pengamatan pada sel yang lebih relevan. Hal ini memungkinkan kami untuk meneliti bagaimana sifat mekanis nanopartikel memengaruhi interaksi nanopartikel membran sel dengan sel.
2 Hasil
2.1 Liposom Lunak dan Liposom CM Menunjukkan Akumulasi dan Mekanisme Penyerapan Nanopartikel yang Sama
Sel stroma sumsum tulang MS5 dipilih untuk mengekstraksi membran sel untuk persiapan CM-Liposome dan menargetkan sel leukemia karena afinitas alami sel leukemia terhadap stroma sumsum tulang. [ 26 , 27 , 29 , 32 , 34 , 35 , 47 ] Garis stroma sumsum tulang MS5 murine telah lama digunakan untuk mempelajari biologi sel induk hematopoietik (HSC) manusia mengingat kapasitasnya untuk mendukung pertumbuhan HSC in vitro jangka panjang, dan juga untuk mengukur jumlah HSC manusia dalam uji sel pemicu kultur jangka panjang (LTC-IC) [ 48 – 55 ] dan berbagai lainnya). Selain itu, sel stroma MS5 telah digunakan secara luas untuk penelitian leukemia myeloid akut (AML) karena mereka juga mendukung kultur in vitro jangka panjang dari ledakan AML yang berasal dari pasien primer [ 35 , 36 , 49 , 50 , 56 ] dan berbagai lainnya). Mengingat banyaknya literatur tentang sel stroma ini sebagai dukungan untuk HSC manusia normal dan ganas, dan juga karena interaksi antara sel induk leukemia AML dan sel stroma MS5 tampaknya sangat penting untuk mempertahankan pembaruan diri in vitro, kami memilih untuk menggunakan sel-sel ini untuk menghasilkan nanopartikel berlapis membran dalam penelitian kami saat ini. Namun demikian, faktor adhesi spesifik manusia yang tidak akan diekspresikan pada sel stroma MS5 murine mungkin terlewatkan. Oleh karena itu, untuk penelitian masa depan, akan menarik untuk juga menyertakan sel mesenkimal manusia untuk mengembangkan konsep ini lebih lanjut untuk aplikasi pengiriman obat.
Pertama, MS5 dilisiskan menggunakan kavitasi nitrogen, dan vesikel membran plasma dengan kemurnian tinggi diperoleh menggunakan sentrifugasi diferensial dan fraksinasi gradien sukrosa, mengikuti protokol yang sebelumnya dikembangkan di lab kami ( Gambar 2 a ). [ 4 , 9 ] Berikutnya, liposom dan CM-Liposom dihasilkan menggunakan berbagai ekstrak membran plasma untuk memverifikasi kekokohan metode ekstraksi membran dan persiapan partikel dan menunjukkan reproduktifitas tinggi (Gambar S1 , Informasi Pendukung). Campuran lipid zwitterionik (Zw) dan campuran yang menyerupai membran plasma (Pm) dipilih untuk menyiapkan partikel (lihat Bagian Eksperimen untuk detailnya). Dalam pekerjaan sebelumnya, campuran zwitterionik digunakan untuk pengendapan dwilapis pada inti silika, menunjukkan cakupan yang sangat baik. [ 21 ] Setelah penyertaan vesikel membran dalam campuran Zw, diameter rata-rata Z sedikit menurun dan potensi zeta menjadi sedikit lebih negatif, konsisten dengan penyertaan lipid membran bermuatan negatif, glikolipid, dan protein dalam lapisan zwitterionik (Gambar S1a–c , Informasi Pendukung). Campuran Pm, sebaliknya, dioptimalkan untuk meniru komposisi membran sel, [ 25 , 44 , 57 ] dan digunakan dalam pekerjaan sebelumnya untuk persiapan Liposom CM yang dibuat dengan membran sel leukemia K562. [ 9 ] Dalam air, liposom Pm yang sedikit lebih kecil diperoleh setelah penambahan vesikel membran MS5, dengan potensi zeta yang kurang negatif (Gambar S1 , Informasi Pendukung dan ikhtisar hasil dalam Tabel 1 ). Pm-CM-Liposom memiliki ukuran yang sedikit lebih kecil dan indeks polidispersitas (PDI) yang lebih rendah, tetapi potensi zeta yang serupa dalam PBS dibandingkan dengan Pm-liposom tanpa komponen membran (Gambar S1d–f , Informasi Pendukung). Semua komposisi stabil dalam medium dengan 10% serum, seperti yang digunakan untuk kultur sel, dan secara aktif diinternalisasi (Gambar S2a–d , Informasi Pendukung). Bertentangan dengan apa yang sebelumnya diamati untuk Pm-CM-Liposom yang dibuat dari membran K562 sendiri, [ 9 ] ketika menggunakan membran MS5 untuk persiapan nanopartikel, tidak ada perbedaan yang kuat dalam penyerapan yang dapat diamati untuk Pm-Liposom dan Pm-CM-Liposom di kedua K562 (Gambar 2c ) dan dalam sel leukemia MOLM13 (Gambar S2e , Informasi Pendukung). Bahkan ketika memvariasikan persentase kolesterol dari 0, hingga 10 dan 33 mol% untuk sebagian menyetel kekakuan dwi lapis, [ 58 ]hanya perbedaan kecil dalam penyerapan yang dapat diamati (Gambar S3 , Informasi Pendukung). Peningkatan kecil dalam penyerapan dapat diamati untuk Zw-CM-Liposom sehubungan dengan Zw-liposom dalam sel K562 (Gambar 2d , ≈2-3 kali lipat) dan THP-1 (Gambar S2f , Informasi Pendukung, ≈1-2 kali lipat). Namun, ini mungkin dijelaskan oleh potensi zeta yang lebih negatif dari Zw-CM-Liposom (Gambar 2e ) dibandingkan dengan Zw-liposom, daripada interaksi spesifik yang dimediasi oleh komponen membran sel yang ditambahkan. Untuk menguji apakah, meskipun efisiensi penyerapan yang sama, Pm-CM-Liposom dan Pm-Liposom diinternalisasi melalui jalur yang berbeda, panel inhibitor transpor digunakan untuk mengkarakterisasi mekanisme yang terlibat. [ 59 ] Tidak ada perbedaan yang jelas dalam mekanisme penyerapan yang dapat ditentukan dan untuk kedua nanopartikel, endositosis yang dimediasi clathrin dan makropinositosis tampaknya terlibat (Gambar S4 , Informasi Pendukung).
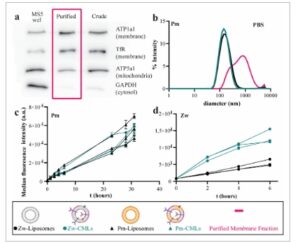
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Karakterisasi dan penyerapan liposom dan MS5-CM-Liposom oleh sel. a) Western blot dari lisat RIPA sel utuh (MS5 wcl), fraksi membran kasar (Kasar), dan fraksi membran murni (Dimurnikan, magenta) yang diperoleh dengan protokol pemurnian membran sel yang dioptimalkan sebelumnya ( n = 4, satu blot representatif ditampilkan). [ 4 , 9 ] Membran diwarnai dengan penanda untuk membran plasma, mitokondria, dan sitosol untuk menentukan komposisi fraksi yang berbeda (lihat Bagian Eksperimen untuk detailnya). b) Distribusi ukuran Pm-Liposom (hitam, n = 10, masing-masing diukur dalam rangkap tiga), Pm-CM-Liposom (Pm-CML, hijau, n = 10, masing-masing diukur dalam rangkap tiga) dan vesikel membran murni (magenta, satu kelompok ditampilkan, diukur dalam rangkap tiga) dalam PBS (25 µg mL −1 lipid untuk liposom dan CM-Liposom dan ≈0,10 mg mL −1 protein untuk vesikel membran). c) Rata-rata intensitas fluoresensi median sel K562 yang diinkubasi dengan 10 µg mL −1 Pm-Liposom (segitiga hitam, rata-rata ± SD, n = 3) dan Pm-CM-Liposom (segitiga hijau, rata-rata ± SD, n = 2) dalam 10% FBS dari waktu ke waktu, dan d) 50 µg mL −1 Zw-Liposom (lingkaran hitam) dan Zw-CM-Liposom (Zw-CML, segitiga hijau). Batang kesalahan selalu disertakan tetapi terlalu kecil untuk dilihat di panel d. Keterangan gambar dibuat dengan Biorender.com.
Tabel 1. Zeta-potensial, ukuran (Z-rata-rata diameter), dan indeks polidispersitas (PDI) yang diperoleh melalui analisis kumulan data DLS dalam air berkekuatan ionik rendah dari liposom dan CM-Liposom yang digunakan dalam penelitian ini (Rata-rata ± SD, n = 4 kelompok partikel, masing-masing diukur dalam rangkap tiga).

2.2 Liposom dan MS5 CM-Liposom Memiliki Kekakuan yang Mirip dan Keduanya Lembut
Setelah mengamati bahwa Pm-CM-Liposom dan Pm-Liposom tidak menunjukkan banyak perbedaan dalam penyerapan pada lini sel model leukemia, sifat mekanik mereka dibandingkan. Pm-Liposom dan Pm-CM-Liposom bermuatan negatif diimobilisasi pada kaca berlapis poli-L-lisin dalam waktu 3 hari setelah persiapan dan dibayangkan dalam PBS oleh AFM. [ 60 ] Gambar kontinu dibuat sementara gaya pencitraan ditingkatkan sebesar 10 pN di antara setiap gambar ( Gambar 3 a ). [ 21 ] Ketinggian setiap partikel pada peningkatan gaya pencitraan dilacak (Gambar S5 , Informasi Pendukung, lihat Bagian Eksperimen untuk detailnya). Konsisten dengan hasil DLS (Gambar S1 , Informasi Pendukung), Pm-CM-Liposom yang dibuat dengan membran plasma MS5 tampak lebih kecil daripada Pm-Liposom (Gambar 3b,c ). Kesamaan dalam deformasi relatif di bawah pengaruh peningkatan gaya menunjukkan sifat mekanik yang sebanding untuk Pm-Liposom dan Pm-CM-Liposom (Gambar 3d ). Secara keseluruhan hasil ini menunjukkan bahwa, bertentangan dengan apa yang diamati sebelumnya ketika menggunakan membran sel leukemia K562 untuk membuat Pm-CM-Liposom (Gambar S6 , Informasi Pendukung), [ 9 ] penyertaan 10% komponen sel stroma sumsum tulang (MS5) ke dalam liposom tidak mengubah sifat mekanik dari bilayer yang dihasilkan (Gambar 3 ), atau mendukung interaksi dengan sel leukemia (Gambar 2 ; Gambar S2–S4 , Informasi Pendukung).
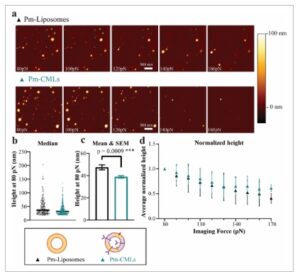
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Sifat mekanis liposom dan MS5-CM-Liposom, seperti yang dicirikan oleh pencitraan AFM. a) Contoh gambar AFM dari Pm-Liposom dan Pm-CM-Liposom (Pm-CML). b,c) Tinggi masing-masing Pm-Liposom ( n = 179, segitiga hitam) dan Pm-CM-Liposom ( n = 315, segitiga hijau) dalam PBS dari kelompok representatif pada 80 pN, bersama dengan median terhitung (b), dan rata-rata terhitung dan SEM (c). Uji-t Welch digunakan untuk membandingkan nilai rata-rata pada panel c ( p = 0,0009). d) Data tinggi yang dinormalisasi untuk kedua nanopartikel pada gaya pencitraan yang meningkat (Rata-rata ± SD). Perubahan tinggi yang sebanding menunjukkan bahwa kedua partikel memiliki sifat mekanis yang serupa dan sama-sama lunak. Keterangan gambar dibuat dengan Biorender.com.
2.3 Persiapan dan Karakterisasi Nanopartikel Berlapis Membran Sel Kaku
Sebagai langkah berikutnya, berdasarkan hasil ini, kami menyiapkan nanopartikel membran sel yang kaku untuk menguji apakah kekakuan nanopartikel yang lebih tinggi mendukung interaksi antara nanopartikel membran sel dan sel yang menjadi target. Untuk tujuan ini, inti silika dipilih sebagai inti model tempat lapisan ganda diendapkan untuk meningkatkan kekakuan semua komposisi.
Rasio antara 1:6 hingga 1:15 antara protein membran dan jumlah lipid sintetis disarankan sebagai yang optimal untuk pelapisan membran CT26 pada inti silika mesopori. [ 25 ] Sejalan dengan indikasi ini serta pekerjaan kami sebelumnya di mana membran sel K562 disertakan dalam liposom, [ 9 ] kami menggunakan rasio 1:10. Partikel silika berlapis lipid (LCS) disiapkan mengikuti prosedur yang dipublikasikan. [ 21 ] Untuk menyiapkan silika berlapis membran (MCS), sebagai gantinya, CML dan inti silika berukuran ≈100 nm disonikasi dan diekstrusi bersama melalui filter 200 nm. Dalam kedua kasus, liposom berlebih dan CM-Liposom dihilangkan dengan sentrifugasi. [ 45 ] DLS, AFM, dan Cryo-EM digunakan untuk mengkarakterisasi sistem yang berbeda yang diperoleh. Tinjauan umum karakteristik terukur dari semua partikel berlapis silika diberikan dalam Tabel 2 . Seperti yang diharapkan, partikel silika polos lebih kecil daripada silika berlapis pada kedua pengukuran AFM dan DLS ( Gambar 4 ; Gambar S7 , Informasi Pendukung dan ringkasan pada Tabel 2 ). Rata-rata Z dan distribusi ukuran sebaliknya serupa untuk semua sampel silika berlapis, dengan PDI yang sebanding, yang sedikit lebih besar untuk Zw-MCS (Gambar S7 , Informasi Pendukung; Tabel 2 ). Setelah pengendapan pada inti silika untuk menyiapkan LCS dan MCS, perubahan potensi zeta yang konsisten dengan pengendapan berbagai jenis lapisan ganda diamati (Gambar S7c , Informasi Pendukung; Tabel 2 ). Pencitraan AFM dan Cryo-EM dilakukan untuk memverifikasi dan memperkirakan efisiensi pelapisan.
Tabel 2. Zeta-potensial, ukuran (Z-rata-rata diameter), dan indeks polidispersitas (PDI) yang diperoleh melalui analisis kumulan data DLS dalam air dengan kekuatan ionik rendah, bersama dengan diameter AFM dan efisiensi pelapisan silika, silika berlapis liposom (LCS) dan silika berlapis liposom membran sel (MCS) (Rata-rata ± SD, Zw = 6 batch silika, Pm = 4 batch, SiO 2 = 5 batch, semua diukur dalam rangkap tiga).
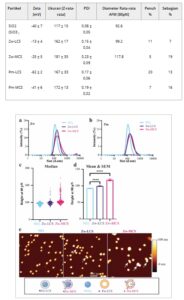
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Karakterisasi silika berlapis Liposom dan CM-Liposome (masing-masing LCS dan MCS). a,b) Distribusi ukuran rata-rata dengan DLS dari (a) semua kelompok Zw berlapis ( n = 6, masing-masing diukur dalam rangkap tiga), dan (b) semua kelompok Pm berlapis ( n = 4, rangkap tiga) dalam air dengan kekuatan ionik rendah (25 µg mL −1 ) dengan SiO 2 sebagai referensi ( n = 5, rangkap tiga). c) Tinggi median dan individu yang direkam oleh AFM pada 80 pN untuk inti silika polos, Zw-LCS, dan Zw-MCS. d) Rata-rata tinggi dan SEM terhitung untuk sampel yang sama (SiO 2 : n = 160; Zw-LCS: n = 157, dan Zw-MCS: n = 190). ANOVA terkoreksi Welch dan Brown-Forsythe digunakan untuk membandingkan sampel ( p yang disesuaikan < 0,0001). e) Gambar representatif SiO 2 , Zw-LCS, Zw-MCS oleh AFM. Anak panah menunjukkan beberapa gugus nanopartikel yang diamati oleh AFM (lihat Gambar S8 , Informasi Pendukung untuk gambar lebih lanjut dan kuantifikasi gugus). Keterangan gambar dibuat dengan Biorender.com.
Sehubungan dengan sifat mekanik nanopartikel, dibandingkan dengan liposom, silika memiliki kekakuan tak terbatas, dan lapisan membran atau lipid tidak memengaruhi kekakuan partikel yang dihasilkan. [ 24 ] Karena itu, gambar pada gaya silika terlapisi yang meningkat tidak diperoleh. [ 21 , 24 ] Sebaliknya, untuk sampel ini AFM digunakan untuk mencitrakan populasi partikel dan mengukur tinggi partikel individual untuk mendapatkan wawasan tentang pengendapan dwilapis. Kekuatan AFM, di sini, adalah mengukur tinggi sebenarnya, dan dalam kasus bola yang tidak dapat dideformasi, seperti inti silika, AFM dapat secara akurat mengukur diameter (atau peningkatan diameter) per partikel, berbeda dengan DLS, yang memberikan rata-rata diameter hidrodinamik dari total populasi dengan resolusi yang jauh lebih rendah. Hasil penelitian menunjukkan bahwa distribusi ukuran Zw-MCS mencakup beberapa ukuran yang lebih besar, yang menunjukkan keberadaan beberapa objek yang lebih besar (Gambar 4c ). Memang, gugusan kecil diamati dalam gambar AFM (lihat tanda panah untuk menunjukkan beberapa contoh pada Gambar 4e , serta gambar dan kuantifikasi untuk Zw-LCS dan Zw-MCS pada Gambar S8 , Informasi Pendukung). Secara keseluruhan, seluruh distribusi LCS dan MCS bergeser ke ukuran yang lebih besar dibandingkan dengan silika, yang menunjukkan pelapisan membran yang berhasil pada sebagian besar partikel (Gambar 4c ). Faktanya, Zw-LCS 3,9 nm lebih besar daripada silika polos (masing-masing tinggi median 97,3 dan 93,4 nm) yang konsisten dengan pengendapan dwi lapis. Sebaliknya, tinggi median Zw-MCS adalah 105,9 nm, yang 12,5 nm lebih besar daripada silika polos (Gambar 4d ). Pergeseran ukuran yang sedikit lebih besar sehubungan dengan apa yang diamati pada pengendapan dwi lapis sederhana konsisten dengan pengendapan dwi lapis yang mencakup protein membran (Gambar 4c,d ). [ 18 ]
2.4 Efisiensi Pelapisan dan Pengaruh Fluiditas Membran
Bahasa Indonesia: Untuk lebih mengkarakterisasi liposom dan silika berlapis membran, cryo-EM digunakan untuk mencitrakan nanopartikel dan mengonfirmasi pengendapan lapisan ganda lipid, sementara uji Laurdan digunakan untuk membandingkan fluiditas lapisan ganda untuk formulasi yang berbeda. [ 19 ] Citra cryo-EM dari partikel LCS dan MCS menunjukkan bahwa sampel tersebut mencakup inti yang dilapisi sebagian dan inti yang dilapisi penuh ( Gambar 5 a–e ). Jumlah liposom kosong relatif kecil (dengan AFM dan Cryo-EM), konsisten dengan pencucian yang dilakukan untuk mengurangi keberadaannya. Formulasi yang berbeda stabil dengan adanya 10% FBS (Gambar S9 , Informasi Pendukung). Partikel yang disertakan dalam beberapa citra diklasifikasikan secara manual sebagai dilapisi sebagian atau penuh untuk memperkirakan fraksinya dengan cara yang disederhanakan (Gambar 5e ). Namun, kami menekankan bahwa jumlah partikel yang dilapisi sebagian kemungkinan diremehkan, karena partikel yang tampaknya tidak dilapisi mungkin memiliki lapisan parsial pada bidang yang berbeda.
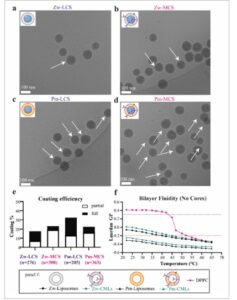
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Efisiensi pelapisan dengan pencitraan cryo-EM dan fluiditas membran LCS dan MCS. Gambar Cryo-EM representatif dari a) Zw-LCS, b) Zw-MCS, c) Pm-LCS dan d) Pm-MCS. Area yang lapisannya terlihat ditandai dengan panah putih. e) Estimasi efisiensi pelapisan untuk partikel LCS dan MCS dari gambar Cryo-EM dari sekumpulan partikel representatif (Zw-LCS: n = 276, Zw-MCS: n = 300, Pm-LCS: n = 205, Pm-MCS: n = 363). f) Rasio Laurdan GP diperoleh pada peningkatan suhu untuk formulasi yang berbeda (Rata-rata, n = 2, dari 1 sekumpulan partikel). DPPC murni disertakan sebagai kontrol (DPPC). GP yang lebih rendah menunjukkan fluiditas dwi lapis yang lebih tinggi. Keterangan dan sisipan gambar dibuat dengan Biorender.com.
Fluiditas dwi lapis telah terbukti membantu dalam melapisi nanopartikel, yang memungkinkan membran lebih mudah membungkus inti dan mengatasi energi yang dibutuhkan untuk menyatukan bercak-bercak satu sama lain. [ 25 ] Laurdan adalah probe fluoresensi yang digunakan untuk membedakan perbedaan dalam urutan fosfolipid karena perubahan fluiditas membran (lihat Bagian Eksperimen untuk detailnya). [ 61 , 62 ] Di sini, pengukuran fluoresensi Laurdan digunakan untuk membandingkan fluiditas dwi lapis dari liposom awal dan CML sebelum pengendapan pada silika (Gambar 5f ). [ 62 ] Hasilnya menunjukkan bahwa dwi lapis zwitterionik (Zw) kurang fluid daripada dwi lapis seperti membran plasma (Pm). Lebih jauh lagi, fluiditas Liposom CM setelah penyertaan komponen membran lebih rendah daripada liposom. Fluiditas yang lebih rendah diharapkan setelah penyertaan lipid jenuh dan protein membran sel ke dalam dwi lapis Liposom CM. Oleh karena itu, hasil Laurdan konsisten dengan penyertaan komponen membran dalam dwi lapis. Menariknya, untuk komposisi mirip Pm yang memiliki fluiditas lebih tinggi (Laurdan GP < 0,2) sehubungan dengan komposisi Zw, jumlah partikel terlapisi yang lebih tinggi (terlapisi sebagian dan penuh) juga diamati oleh cryo-EM (Gambar 5e ). Dengan demikian, pencitraan cryo-EM dan pengukuran Laurdan menunjukkan bahwa fluiditas dwi lapis yang lebih tinggi memfasilitasi pengendapan pada inti yang kaku.
Meskipun sangat sulit untuk diukur, hasil penelitian ini juga menunjukkan bahwa pelapisan penuh CM-Liposom pada inti silika hanya diamati pada sebagian kecil partikel: hal ini konsisten dengan penelitian lain yang mencoba untuk menyimpan membran sel pada inti anorganik, yang juga melaporkan bahwa biasanya hanya pelapisan parsial yang dapat diperoleh ketika kelebihan liposom kosong dan CM-Liposom dihilangkan. [ 45 , 63 , 64 ]
2.5 Penyerapan Nanopartikel Berlapis Membran Sel Kaku pada Sel Leukemia
Sebagai langkah berikutnya, LCS dan MCS diuji pada sel leukemia untuk menentukan apakah pengendapan komponen membran sel pada inti kaku mempengaruhi interaksi dengan sel target. Sel leukemia K562 diinkubasi dengan LCS dan MCS dengan komposisi dwi lapis yang berbeda, serta dengan silika polos sebagai referensi perbandingan ( Gambar 6 ). Dalam kasus dwi lapis zwitterionik (Zw), Zw-MCS diserap lebih banyak daripada silika polos dan Zw-LCS (Gambar 6a ). Ini sangat mengejutkan mengingat potensi zeta negatif yang kuat dari nanopartikel silika polos dibandingkan dengan Zw-MCS (Gambar 4e ). Juga dalam kasus dwi lapis seperti membran plasma (Pm), Pm-MCS menunjukkan akumulasi tertinggi di K562 sehubungan dengan Pm-LCS dan silika polos (Gambar 6b ), meskipun memiliki potensi zeta terendah (absolut) (Gambar 4e ). Bahasa Indonesia: Ketika mengamati distribusi fluoresensi sel yang diperoleh dengan flow cytometry (Gambar 6c ), kami mencatat bahwa hanya untuk sampel dengan komponen membran lebar distribusi meningkat dan ekor di sisi kanan distribusi, dengan demikian subpopulasi sel dengan penyerapan lebih tinggi, diamati. Penyerapan nanopartikel oleh sel diketahui secara intrinsik heterogen, [ 65 , 66 ] seperti yang memang terlihat dalam semua distribusi fluoresensi sel (Gambar 6c ). Namun, distribusi yang lebih luas dibandingkan dengan apa yang diamati untuk silika polos dan LCS dapat diharapkan untuk nanopartikel membran sel, mengingat heterogenitas intrinsik dalam komponen membran yang termasuk dalam nanopartikel individual dalam sampel.
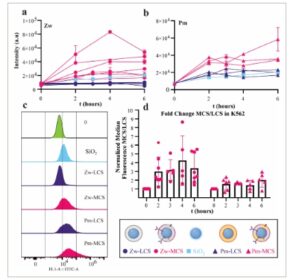
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Penyerapan LCS dan MCS dalam sel K562. a,b) Intensitas fluoresensi median dan SD sel K562 yang diinkubasi dengan 50 µg mL −1 (berdasarkan konsentrasi silika) dari (a) Zw- dan (b) Pm- LCS dan MCS untuk waktu yang semakin lama. Penyerapan silika polos juga disertakan untuk perbandingan. Eksperimen dilakukan dalam rangkap dan rata-rata per eksperimen ditunjukkan (Rata-rata ± SD, untuk total 6 dan 3 eksperimen kinetik independen, masing-masing dalam panel a dan b). c) Distribusi fluoresensi terhuyung-huyung dari sel K562 yang diinkubasi dengan 50 µg mL −1 silika, MCS, dan LCS dalam K562 selama 2 jam. d) Rasio (Perubahan lipatan) penyerapan MCS terhadap LCS dengan komposisi yang sama pada berbagai waktu inkubasi (dari data kinetik yang ditunjukkan dalam panel ab dengan penambahan eksperimen lain dengan titik waktu yang lebih sedikit). Fluoresensi sel median yang dinormalkan yang diperoleh dalam 10 (Zw) dan 7 (Pm) percobaan ditunjukkan bersama dengan nilai rata-rata dan SD (Rata-rata ± SD, n = 10 (Zw), 7 (Pm), masing-masing dengan sampel duplikat). Keterangan gambar dibuat dengan Biorender.com.
Secara keseluruhan, hasil menunjukkan bahwa terlepas dari muatan dwi lapis, baik untuk Zw-MCS dan Pm-MCS penyerapan yang lebih tinggi diamati daripada untuk Zw-LCS dan Pm-LCS (silika dilapisi dengan liposom dengan komposisi yang sama tetapi tanpa komponen membran, Gambar 6d ). Perilaku ini dikonfirmasi untuk beberapa kelompok partikel. Hasil ini menunjukkan bahwa bahkan untuk silika yang dilapisi sebagian, keberadaan protein membran dalam MCS meningkatkan interaksi dengan sel, [ 45 ] dan menyebabkan penyerapan yang lebih tinggi daripada yang diamati untuk silika polos dan LCS (meskipun nanopartikel yang terakhir ini memiliki potensi zeta yang lebih negatif). Ini menunjukkan bahwa kekakuan nanopartikel sangat memengaruhi interaksi antara nanopartikel membran sel dan sel target, dan hanya ketika menggunakan inti yang kaku, penyertaan komponen membran sel stroma mendukung penyerapan dalam sel leukemia.
2.6 Interaksi Membran Sel Stroma Sumsum Tulang yang Dilapisi Silika dengan Sel Leukemia Primer
Sebagai langkah terakhir, studi pendahuluan dengan sel primer dari dua pasien leukemia dilakukan untuk mendapatkan wawasan pertama tentang apakah penyerapan yang lebih tinggi yang diamati untuk silika berlapis membran sel stroma sumsum tulang sehubungan dengan silika berlapis liposom dapat diamati pada sel yang lebih relevan juga. Eksperimen pertama dilakukan untuk nanopartikel yang ditambahkan ke sel dalam 10% FBS (Gambar S10a–d , Informasi Pendukung, Pasien 1). Sel-sel digerbangkan ke dalam sel leukemia hidup (blast) menggunakan hamburan, DAPI, dan ekspresi CD45 (Gambar S10b , Informasi Pendukung). Partikel diuji secara simultan pada sel K562 dan sel primer, untuk mengonfirmasi aktivitasnya dalam lini sel model (Gambar S11 , Informasi Pendukung). Untuk sel primer, sel leukemia menunjukkan peningkatan penyerapan MCS daripada LCS untuk kedua komposisi lipid (Gambar S10c , Informasi Pendukung), dengan efek yang lebih kuat pada konsentrasi yang lebih tinggi (Gambar S10d , Informasi Pendukung). Hasil ini mengonfirmasi apa yang diamati sebelumnya dalam model garis sel K562, dan menunjukkan bahwa pelapisan sel stroma MS5 dapat membantu dalam mencapai ledakan leukemia, selama protein stroma dalam nanopartikel membran didukung secara mekanis oleh inti padat.
Akhirnya, untuk mengevaluasi apakah penyerapan MCS yang lebih tinggi juga dapat dicapai dalam sel punca leukemia, sel-sel yang memainkan peran besar dalam patofisiologi leukemia, [ 26 – 37 ] sel-sel primer dari pasien kedua diekspos ke MCS dan LCS sel stroma sumsum tulang dalam medium 25% FBS (seperti biasa untuk membudidayakannya) (Gambar S10e–i , Informasi Pendukung, Pasien 2). Sel-sel dibagi menjadi limfosit dan sel kanker leukemia (blast) berdasarkan hamburan dan ekspresi CD45 mereka. Pewarnaan CD34 dan CD38 digunakan untuk kemudian membagi sel-sel leukemia dalam sel punca leukemia (Sel Punca Leukemia Q1, CD34+, CD38 rendah) dan progenitor leukemia (Progenitor Leukemia Q2, CD34+, CD38 tinggi) (Gambar S10f , Informasi Pendukung). [ 67 ] Konsentrasi FBS yang meningkat diketahui biasanya menurunkan interaksi antara nanopartikel dan sel. [ 68 ] Oleh karena itu, seperti yang diharapkan, total penyerapan lebih rendah pada 25% FBS (Gambar S10g , Informasi Pendukung) daripada yang diamati pada 10% FBS (Gambar S10a–d , Informasi Pendukung, Pasien 1). Perlu dicatat, sel leukemia menunjukkan penyerapan yang lebih tinggi daripada limfosit sehat, yang mungkin dijelaskan karena kapasitas limfosit yang buruk untuk penyerapan nanopartikel (Gambar S10g , Informasi Pendukung). [ 69 ] Setelah 4 jam, Zw-MCS menunjukkan akumulasi yang sedikit lebih tinggi pada sel punca leukemia dan progenitor, yang menjadi lebih besar seiring waktu (Gambar S10h,i , Informasi Pendukung). Secara keseluruhan, penyerapan kedua partikel dalam sel progenitor lebih tinggi daripada dalam sel punca leukemia (Gambar S10h,i , Informasi Pendukung). Hasil-hasil ini, meskipun masih awal, mengonfirmasi bahwa juga pada sel-sel primer dari pasien, penyertaan membran sumsum tulang ke dalam MCS meningkatkan akumulasi pada sel-sel leukemia.
Meskipun kami menyadari bahwa penelitian lebih lanjut dalam kelompok sampel pasien AML primer yang lebih besar diperlukan untuk dapat menggeneralisasi temuan dan memperoleh wawasan tentang sifat adhesi nanopartikel dalam kaitannya dengan subtipe genetik tertentu, tujuan pertama kami di sini adalah untuk menyelidiki apakah peningkatan penyerapan partikel MCS yang diamati dalam lini sel leukemia juga dapat direkapitulasi dalam sampel AML primer, yang merupakan kasusnya. Demikian pula, penyerapan yang lebih rendah yang diamati dalam limfosit sehat dibandingkan dengan sel leukemia konsisten dengan hipotesis bahwa MCS sumsum tulang mungkin dapat mencapai sel leukemia secara istimewa. Namun, penelitian lebih lanjut diperlukan untuk menunjukkan penargetan secara in vivo serta untuk memastikan keamanan terhadap sel-sel sehat.
3 Diskusi
Dalam studi sebelumnya, kami menemukan bahwa penggabungan membran plasma dari sel K562 ke dalam dwilapis menyebabkan pembentukan CML dengan kekakuan yang meningkat dibandingkan dengan liposom tanpa komponen membran. CML membran K562 yang dihasilkan menunjukkan penyerapan yang lebih tinggi baik pada sel K562 maupun sel MS5. [ 9 ] Sebaliknya, dalam penelitian ini penyertaan membran sel stroma menyebabkan pembentukan CML lunak dengan kekakuan yang sebanding dengan liposom dengan komposisi yang sama tetapi tanpa komponen membran (Gambar 3 ). Dalam kasus ini, penyertaan komponen membran tidak meningkatkan interaksi dengan sel leukemia (Gambar 2 ), mungkin karena partikel lunak memiliki kapasitas yang lebih rendah untuk membengkokkan membran sel ( Gambar 7 a ). [ 22 ] Perbedaan tambahan antara CML leukemia dan stroma, misalnya dalam komposisi protein dan lipid, serta karakteristik murine versus manusia mungkin juga berperan.

Gambar 7
Buka di penampil gambar
Kekuatan Gambar
Representasi skematis dari mekanisme yang diusulkan untuk interaksi antara nanopartikel membran sel yang lunak dan kaku serta sel target. a) Partikel membran lunak memiliki kapasitas yang lebih rendah untuk membengkokkan membran sel untuk penyerapan. b) Partikel membran sel yang kaku dan terlapisi penuh dapat mendukung interaksi dengan reseptor sel dan pembengkokan membran untuk penyerapan. c) Gumpalan nanopartikel membran sel yang terlapisi sebagian pada inti kaku dapat terbentuk dan dapat mendorong pembengkokan membran serta interaksi dengan beberapa reseptor pada sel target. d) Ringkasan hasil yang dilaporkan dalam penelitian ini. Fluoresensi sel median pada sel K562 dan potensi zeta dari berbagai partikel yang dipelajari (skematis). Garis biru menunjukkan tren yang diharapkan dalam hasil karena muatan. Hasil kami menunjukkan bahwa untuk liposom yang dapat dideformasi dan CM-Liposom (CML, sisi kiri), penyerapan lebih tinggi untuk nanopartikel yang lebih bermuatan, tetapi tidak ada perbedaan yang diamati setelah penyertaan komponen membran sel. Alih-alih LCS dan MCS yang lebih kaku yang terbentuk setelah pengendapan lapisan ganda ke inti silika, terlepas dari muatan partikel, penyerapan yang lebih tinggi diamati setelah penyertaan komponen membran sel dalam lapisan ganda. Hasil ini menunjukkan bahwa kekakuan yang lebih tinggi mendukung interaksi spesifik antara nanopartikel membran sel dan sel yang menjadi target. Dibuat dalam BioRender, de Weerd, S. (2024) https://BioRender.com/d93v796 .
Sebaliknya, ketika mendepositkan dwilapis ke inti silika kaku, nanopartikel membran sel menunjukkan penyerapan lebih tinggi daripada silika berlapis liposom yang sesuai tanpa komponen membran. Nanopartikel kaku mungkin dapat membengkokkan membran dan lebih mudah membungkusnya di sekitarnya, meningkatkan penyerapan dalam sel yang ditargetkan (Gambar 7b ). Interpretasi lain yang mungkin adalah bahwa nanopartikel yang dilapisi sebagian membentuk aglomerat kecil, seperti yang memang kami amati oleh AFM (Gambar 4h ; Gambar S8 , Informasi Pendukung). Aglomerat kecil memiliki luas permukaan yang lebih besar, sehingga meningkatkan interaksi dengan sel yang ditargetkan (Gambar 7c ). Kedua mekanisme ini, peningkatan pembungkusan membran dan pembentukan aglomerat, mungkin keduanya berperan, dan bersama-sama dapat menjelaskan mengapa hanya dengan nanopartikel yang lebih kaku, penyertaan komponen membran sel meningkatkan penyerapan dalam sel leukemia sehubungan dengan liposom dan silika berlapis liposom. Pekerjaan lebih lanjut diperlukan untuk menentukan apakah hal yang sama juga berlaku untuk jenis nanopartikel membran sel lainnya, dan – secara lebih umum – untuk sepenuhnya menunjukkan apakah penyajian komponen membran sel ke nanopartikel kaku diperlukan untuk meningkatkan interaksi spesifik dengan sel sasaran, sebagaimana yang memang disarankan oleh hasil kami.
Pada catatan lain, saat ini ada perdebatan tentang cara terbaik untuk mendepositkan komponen membran sel ke nanopartikel. Deposisi membran sel ke inti kaku adalah proses yang dinamis, [ 70 – 72 ] dan sentrifugasi untuk menghilangkan kelebihan CM-Liposom menghasilkan gaya geser yang dapat melucuti lapisan membran dari inti. Beberapa penelitian menunjukkan bahwa jika kelebihan CM-Liposom dihilangkan dengan pencucian, lapisan dapat hilang. Oleh karena itu, cara lain untuk menyiapkan nanopartikel berlapis membran sel adalah dengan meninggalkan kelebihan CM-Liposom dalam suspensi, yang akan mendukung deposisi dwi lapis lebih lanjut ke nanopartikel.
Demikian pula, ukuran liposom dan ukuran inti sangat penting dalam menentukan efisiensi pelapisan dan dapat dioptimalkan lebih lanjut, seperti juga pilihan lipid sintetis, dan fluiditas lapisan ganda yang dihasilkan. [ 25 , 42 ] Penelitian lain menunjukkan bahwa ukuran vesikel dan inti harus cocok untuk meningkatkan pengendapan lapisan ganda, [ 21 ] dan kondisi penyangga dapat dioptimalkan untuk meningkatkan pelapisan. [ 21 ] Lebih jauh, telah ditemukan bahwa co-ekstrusi Liposom CM dan inti nanopartikel meningkatkan pengendapan dengan menghasilkan gaya geser di sekitar nanopartikel. [ 45 ]
Aspek lain yang diperdebatkan di lapangan adalah apakah aglomerat kecil nanopartikel mungkin ada, seperti yang diamati dalam gambar Zw-MCS (Gambar 4e ; Gambar S8a,b , Informasi Pendukung): menggunakan EM, peneliti lain menemukan bahwa nanopartikel yang dilapisi sebagian dapat membentuk gugus kecil yang diserap dalam sel, terlepas dari konsentrasinya. [ 25 ] Pembentukan dan disosiasi gugus kecil kemungkinan besar merupakan proses dinamis, dan AFM akan menangkap gugus tersebut setelah partikel diimobilisasi pada permukaan poli-L-lisin. Memang, menggunakan AFM, kami mengamati lebih banyak dimer dan trimer untuk Zw-LCS dan khususnya untuk partikel Zw-MCS (yang juga diamati heksamernya) dibandingkan dengan partikel silika polos (Gambar S8b , Informasi Pendukung). Mengingat kepadatan partikel tunggal dan gugus pada gambar AFM yang rendah, terutama untuk partikel Zw-MCS (Gambar S8b , Informasi Pendukung), kemungkinan gugus tersebut sudah ada dalam larutan sebelum menempel pada permukaan. Namun, bagaimana interaksi gugus dengan sel berbeda dengan interaksi nanopartikel tunggal perlu dipelajari. Demikian pula, pekerjaan tambahan diperlukan untuk mendapatkan wawasan mekanistik yang lebih banyak tentang bagaimana nanopartikel membran sel berinteraksi dengan sel yang ditargetkan dan, misalnya, untuk menentukan kontribusi reseptor tertentu.
Selain itu, untuk lebih mengembangkan nanopartikel membran sel stroma untuk aplikasi penghantaran obat, beberapa aspek lain perlu dioptimalkan. Pertama, sementara di sini inti silika digunakan sebagai model untuk meningkatkan kekakuan nanopartikel, inti yang berbeda yang lebih cocok untuk aplikasi penghantaran obat dapat dipilih. Misalnya, silika mesopori sangat banyak digunakan dalam penghantaran obat karena pori-porinya dapat digunakan untuk memuat obat dalam jumlah besar. [ 73 , 74 ] Atau, dengan mengubah komposisi lipid, liposom membran sel yang lebih kaku dapat diperoleh tanpa memerlukan inti nanopartikel. [ 75 ] Kedua, garis sel stroma manusia dapat digunakan untuk mengekstraksi membran sel untuk persiapan nanopartikel, dan kemungkinan akan lebih meningkatkan interaksi dengan sel leukemia manusia.
Di samping ini, nasib intraseluler nanopartikel dan sifat pelepasan di dalam sel yang ditargetkan perlu ditentukan, seperti juga distribusi in vivo, akumulasi hati, kapasitas penargetan, dan keamanan terhadap sel-sel sehat. Faktanya, sementara kita menyadari bahwa sel punca hematopoietik (HSC) normal juga dapat berinteraksi dengan nanopartikel yang dilapisi dengan membran sel stroma, berbagai lab telah menjelaskan bahwa sel-sel AML telah berubah, dan seringkali interaksi yang lebih kuat dengan sel-sel stroma, dan sementara area batu bulat (CAFC, sel pembentuk area batu bulat) yang diinduksi oleh HSC normal biasanya hanya terbentuk setelah 5 minggu pada MS5, CAFC leukemia biasanya terbentuk jauh lebih awal, dalam beberapa minggu, dan memiliki kapasitas pelapisan ulang, yang menunjukkan pembaruan diri. [ 35 , 36 , 49 , 50 , 56 ] Oleh karena itu, kami berharap nanopartikel membran sel stroma sumsum tulang lebih disukai menargetkan sel-sel leukemia. Konsisten dengan ini, uji pendahuluan pada sampel pasien menunjukkan bahwa penyerapan MCS stroma sumsum tulang pada limfosit sehat lebih rendah daripada pada sel leukemia (Gambar S10g , Informasi Pendukung). Meskipun demikian, untuk pengembangan lebih lanjut nanopartikel membran sel stroma untuk penghantaran obat, interaksi dengan sel sehat perlu dipantau secara cermat untuk memastikan keamanannya. Demikian pula, penelitian lebih lanjut diperlukan untuk menguji kapasitas penargetannya secara in vivo, serta untuk menentukan secara keseluruhan apakah membran sel stroma atau pendekatan yang lebih klasik menggunakan membran sel leukemia untuk penargetan homotipe mungkin lebih cocok. [ 5 , 7 – 9 ]
4 Kesimpulan
Dalam penelitian ini, kami mempelajari efek kekakuan nanopartikel pada interaksi antara nanopartikel membran sel stroma dan sel leukemia. [ 9 ] Penyertaan membran sel stroma ke dalam liposom menyebabkan terbentuknya CM-Liposom lunak dengan kekakuan yang sebanding dengan liposom dengan komposisi yang sama tetapi tanpa komponen membran dan tidak meningkatkan interaksi dengan sel leukemia. [ 22 ] Namun, setelah pengendapan liposom membran sel stroma ke inti silika yang lebih kaku, penyerapan yang lebih tinggi diamati sehubungan dengan silika berlapis liposom yang sesuai tanpa komponen membran (Gambar 7b,e ). Temuan ini dengan jelas menunjukkan bahwa kekakuan nanopartikel sangat memengaruhi interaksi antara nanopartikel membran sel dan sel yang ditargetkan. Oleh karena itu, sifat mekanik nanopartikel perlu dioptimalkan dengan hati-hati untuk mencapai formulasi membran sel dengan karakteristik yang diperlukan untuk pengiriman yang ditargetkan.
5 Bagian Eksperimen
Kultur Sel
Sel K562, MOLM13 dan THP-1 diperoleh dari DSMZ (Braunschweig, Jerman) dan dipelihara dalam medium RPMI 1640 yang mengandung 2 mm GlutaMAX (Gibco, ThermoFisher Scientific, Inggris), yang dilengkapi dengan 10% serum fetal bovin (FBS, Gibco, ThermoFisher, Brasil), 2 mm L -glutamin, dan 20 mm HEPES , pada suhu 37 °C dalam atmosfer 5% CO2 . Sel stroma murine (MS5), yang juga diperoleh dari DSMZ, dikultur dalam alpha MEM (Gibco, ThermoFisher Scientific, Inggris) dengan 10% FBS dalam kondisi yang sama. Semua lini sel dipelihara selama kurang dari 20 kali pasase dan tidak digunakan hingga setelah 4 kali pasase. Pengujian mikoplasma dilakukan secara berkala untuk memastikan tidak adanya kontaminasi.
Pemurnian Membran Plasma
(Catatan: Semua sentrifugasi dan buffer yang digunakan dilakukan pada suhu 4 °C untuk mencegah degradasi protein.) Setidaknya 250 juta sel MS5 dicuci dengan PBS lalu dipisahkan dengan 2 m m EDTA dalam PBS selama 30 menit sebelum dikikis atau dipisahkan dengan cara dikikis dalam PBS. Kemudian, sel dikumpulkan dalam tabung Falcon 50 mL dengan sentrifugasi pada 300 xg dan dicuci sekali lagi dengan PBS. Setelah itu, sel dicuci sekali dalam buffer awal isotonik (SB, 30 m m Tris-Base, 225 m m manitol, 75 m m sukrosa dalam air suling, disesuaikan dengan pH 7,4 dengan HCl, 4 °C). Sel yang telah dicuci ditempatkan dalam 35 mL buffer isolasi isotonik (IB, 30 mm Tris -Base, 225 mm manitol , 75 mm sukrosa , 2,5 mm MgCl 2 , 0,5 mm EGTA , 1 koktail penghambat protease bebas Roche EDTA lengkap dalam air suling, disesuaikan dengan pH 7,4 dengan HCl, 4 °C) dan disimpan dalam bejana kavitasi nitrogen (Parr Instruments, AS). Bejana tersebut diberi tekanan dengan N 2 hingga 200 Psi (atau 280 Psi jika EDTA dihilangkan untuk pemanenan). Setelah 30 menit penyeimbangan, bejana diturunkan tekanannya sekali atau dua kali hingga persentase lisis ≈80% diperoleh dan homogenat dikumpulkan dalam tabung Falcon 50 ml yang telah didinginkan sebelumnya (persentase lisis dihitung dengan menghitung sel utuh dengan hemocytometer menggunakan mikroskopi fase-kontras setelah kavitasi; satu T175 diperkirakan memiliki ≈8-10 juta sel MS5). Kemudian, sel dan inti yang tidak rusak dikeluarkan dengan sentrifugasi pada 800 × g selama 5 menit dari homogenat dua kali dan supernatan disimpan. Supernatan kemudian disentrifugasi dua kali pada 10000 × g selama 10 menit dalam SW31-Ti (Beckman & Coulter) menggunakan tabung sentrifugasi Ultra Clear Ultra 38,5 mL yang telah didinginkan terlebih dahulu (Beckman Coulter, Tabung Ultra-Clear Thinwall Terbuka 38,5 mL, 25 × 89 mm) untuk membuang sebagian besar mitokondria. Untuk mengumpulkan membran plasma dan fragmen membran lainnya, supernatan disentrifugasi pada 41000 xg selama 30 menit dalam tabung ultracentrifuge 38,5 mL yang baru. Sentrifugasi lain pada 41000 xg selama 30 menit diikuti oleh resuspensi dalam buffer isotonik dalam tabung 38,5 mL baru lainnya digunakan untuk membuang pengotor sitosolik. Pelet sekarang dilarutkan dalam buffer resuspensi membran plasma (PMRB, 5 mm Bis -Tris, dan 0,2 mmEDTA dalam air suling, disesuaikan dengan pH 6,0 dengan HCl, 4 °C) dengan beberapa gerakan homogenizer Potter-Elvehjem dengan alu yang pas, dan dilapisi di atas 4 mL 38%, 3 mL 43% dan 2,5 mL 53% wt/wt sukrosa dalam gradien sukrosa terputus-putus PMRB yang dibuat dalam 13,2 mL, Tabung Tipis Ultra-Bening Terbuka Beckman & Coulter, 14 × 89 mm dan disentrifugasi pada 95000 × g selama 2,5 jam dalam SW41-Ti (Beckman & Coulter). Pita di bagian atas fraksi 38% sesuai dengan pita dengan membran plasma yang dimurnikan (seperti yang diuji dengan analisis western blot dari penanda membran plasma). Fraksi ini dikumpulkan dengan menembus bagian bawah tabung dengan jarum panas dan dikumpulkan dalam tabung Eppendorf. Fraksi yang diinginkan kemudian ditempatkan dalam tabung 13,2 mL baru dan diencerkan dengan buffer isotonik SB dan disentrifugasi pada 95000 × g selama 50 menit untuk menghilangkan sukrosa yang berasal dari gradien. Pelet disimpan dalam buffer penyimpanan (30 mm Tris -Base, 225 mm manitol, 75 mm sukrosa , dan 1 koktail penghambat protease bebas EDTA Roche cOmplete dalam air suling, disesuaikan dengan pH 7,4 dengan HCl, 4 °C), dialiquot dalam aliquot sekali pakai atau ganda dan dibekukan dengan cepat dengan menurunkan tabung Eppendorf yang tertutup dalam nitrogen cair. Vesikel membran plasma yang dimurnikan disimpan pada suhu -80 °C selama maksimum 6 bulan dan konsentrasi protein ditentukan menggunakan Uji Protein DC yang dimodifikasi (Bio-Rad). Vesikel dicairkan sebelum digunakan.
Kuantifikasi Protein
Versi modifikasi dari Bio-Rad DC Protein Assay digunakan, menggabungkan SDS untuk melarutkan protein membran karena kandungan lipid yang tinggi dalam sampel, yang dapat mengganggu deteksi protein. Standar disiapkan dalam buffer yang sama yang digunakan untuk sampel, dengan bovine serum albumin (BSA, kemurnian 98%, ThermoFisher Scientific, Inggris) pada konsentrasi antara 0,0625 dan 2 mg mL −1 . Pengujian dilakukan dengan mengikuti protokol pabrik dengan penambahan 2% SDS ke reagen B. Reagen S juga disertakan untuk memperhitungkan keberadaan deterjen. Setelah 15 menit pada suhu kamar, absorbansi diukur pada 650 nm menggunakan pembaca mikroplat ThermoMAX. Konsentrasi protein dalam sampel yang tidak diketahui kemudian ditentukan menggunakan kurva kalibrasi yang sesuai.
SDS-Page, Western Blot dan Pewarnaan Perak
Gel SDS-PAGE 7,5 atau 10% dibuat dan dimuat dengan jumlah protein yang sama di setiap jalur menurut Uji Protein Bio-Rad DC. Fraksi kasar adalah pelet yang diperoleh dari lisat sel setelah penghilangan nuklei dan mitokondria dan sentrifugasi diferensial pada 41000 × g, sedangkan membran yang dimurnikan adalah fraksi yang diperoleh setelah fraksinasi densitas sukrosa dari pelet kasar. [ 4 , 9 ] Protein didenaturasi dengan mencampur dengan buffer pemuatan yang diencerkan 4x dan memanaskan pada 95 °C selama 10 menit. Sebanyak 35 µL sampel yang diencerkan dimuat ke dalam gel dan elektroforesis dijalankan pada 120 V. 10 µg protein dimuat per jalur. Membran PVDF diwarnai dengan ATP1a1 (subunit alfa 1 pengangkut ATPase Na+/K+, sebagai penanda membran plasma), TfR (Reseptor Transferin, membran plasma), ATP5a1 (subunit alfa ATP sintase F1, membran mitokondria), dan GAPDH (gliseraldehida-3-fosfat dehidrogenase, sitosol) untuk menentukan komposisi fraksi yang berbeda dan mengonfirmasi isolasi fraksi membran murni. Untuk deteksi antibodi, protein dipindahkan ke membran PVDF yang diaktifkan metanol sesuai dengan petunjuk pabrik, selama 1,5 jam pada 120 V dalam tangki transfer yang didinginkan. Membran kemudian diinkubasi dalam buffer pemblokiran (20 m m Tris-base, pH 7,6, 1,5 M NaCl, 0,1% Tween-20, dan 5% susu bubuk tanpa lemak). Antibodi primer ditambahkan ke buffer pemblokiran sebagai berikut: poliklonal kelinci anti-ATP5a1 (1:2000, Novus Biologicals, Nomor katalog: NBP2-92928-0,1 mL, AS), monoklonal tikus anti-reseptor transferin (1:2000, ThermoFisher Scientific, Nomor katalog: 13–6800), monoklonal kelinci anti-GAPDH (1:2000, Cell Signaling Technology, Nomor katalog: 51745, Leiden, Belanda), dan poliklonal kelinci anti-ATP1A1 (1:2000, Proteintech, Nomor katalog: 55187-1-AP, AS). Antibodi sekunder yang digunakan meliputi antibodi sekunder HRP-conjugated anti-kelinci (1:2000, Southern Biotech, Nomor katalog: 4049-05, AS) dan antibodi sekunder HRP-conjugated anti-tikus (1:2000, Southern Biotech, Nomor katalog: 6175-05, AS). Sinyal dideteksi dengan kit deteksi ECL (GE Lifesciences) sesuai dengan petunjuk pabrik, dan bercak-bercak dicitrakan dengan ChemiDoc XRS (Biorad, AS). File .tiff 16-bit asli diekspor dan kemudian diproses dengan ImageJ dengan mengonversi ke 8-bit dengan penskalaan linier dan menginversikan gambar, yang kemudian disusun menjadi gambar menggunakan Adobe Illustrator 2022.
Persiapan Liposom dan CML
Persiapan liposom dan CML dilakukan menggunakan metode penguapan dan ekstrusi lapisan tipis. Lipid diperoleh dari Avanti Polar Lipids (Alabaster, Alabama, AS). Lipid yang digunakan dalam penelitian ini meliputi 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC 18:1 PC (cis)), 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 PE), 1,2-dioleoyl-sn-glycero-3-phospho-(1′-rac-glycerol) sodium salt (DOPG, 18:1 (Δ9-Cis) PG), kolesterol, dan lipid fluoresen 1,1′-Dioctadecyl-3,3,3′,3′-Tetramethylindocarbocyanine Perchlorate (DiI, Sigma–Aldrich, Belanda). Lipid dilarutkan dalam kloroform (Sigma–Aldrich, Belanda), dialiquot pada konsentrasi 10 mg mL −1 , dan disimpan pada suhu −20 °C. Jumlah lipid yang sesuai ditambahkan ke dalam vial kaca, digabungkan, dikeringkan di bawah nitrogen, dan dibiarkan dalam vakum semalaman. Film lipid yang dihasilkan kemudian dihidrasi ulang dalam PBS yang disaring (Whatman FP30/0.2, filter 0,2 µm) yang mengandung 0,05% Sodium Azide (Sigma–Aldrich, Belanda), dengan atau tanpa penambahan membran plasma murni MS5 pada rasio protein-ke-lipid sintetis 1:10 (wt/wt). Film lipid dikocok perlahan selama 2–3 jam pada suhu kamar hingga terdispersi sepenuhnya. Sampel kemudian dibekukan dan dicairkan 8 kali menggunakan nitrogen cair dan air bersuhu ruangan, diikuti dengan penyaringan melalui filter polikarbonat 0,2 µm (Avanti Polar Lipids) 21 kali menggunakan Avanti Mini-Extruder (Avanti Polar Lipids). Sampel disimpan pada suhu 4 °C dan digunakan dalam waktu 4 minggu.
Air dengan Kekuatan Ionik Rendah
ROug1,3 m m H 2 PO 4 disiapkan dalam air suling yang disaring (filter Whatman FP30/0,2, 0,2 µm) dan dinaikkan ke pH 7,4 dengan 1 m NaOH.
Pembuatan LCS
Liposom untuk persiapan LCS dibuat seperti yang dijelaskan di atas, dengan pengecualian bahwa vesikel disonikasi dalam sonikator bak selama 10 menit pada suhu kamar, bukan dibekukan dan dicairkan, dan bahwa DiI dihilangkan. Setelah ekstrusi liposom, inti silika polos 100 nm (polos, hijau fluor, 485/510 nm, 100 nm, 50 mg mL −1 , 10 mL, suspensi dalam air, dari Micromod Partikeltechnologie GmbH, Jerman, Nomor katalog:42-00-102) ditambahkan ke 1 mg liposom dalam rasio lipid:silika 1:1 wt/wt. Dispersi partikel diinkubasi dalam tabung Eppendorf pada suhu kamar hingga 3 sementara sesekali disuspensikan kembali dengan pipet ke atas dan ke bawah untuk menjaga partikel dalam larutan. Sekarang, LCS dicuci dua kali dengan air berkekuatan ion rendah melalui sentrifugasi pada 15000 xg, 15 menit, 15 °C. Supernatan yang mengandung liposom yang tidak terikat dibuang (diusahakan agar sedikit lapisan air di atas pelet) dan pelet disuspensikan kembali dengan pipet perlahan ke atas dan ke bawah dalam volume kecil ≈100 µL menggunakan ujung 100 µL. LCS disimpan dalam air berkekuatan ion rendah pada suhu 4 °C dan digunakan dalam waktu 5 hari.
Pembuatan MCS
Liposom CM disiapkan seperti yang dijelaskan di atas. Siklus beku-cair diganti dengan sonikasi dalam sonikator bak selama 10 menit dan DiI tidak disertakan. Inti silika polos berukuran 100 nm ditambahkan ke dispersi CML dalam rasio lipid:silika buatan 1:1 berat/berat dan diinkubasi selama 10 menit. Setelah resuspensi pelet, sistem diekstrusi bersama sebanyak 21 kali melalui filter polikarbonat 0,2 µm menggunakan Avanti Mini Extruder. Setelah persiapan, MCS dicuci, disentrifugasi, dan disimpan dengan cara yang sama seperti LCS dan digunakan dalam waktu 5 hari setelah persiapan.
Kuantifikasi Inti Lipid dan Silika Setelah Ekstrusi dan Pencucian
Uji fluoresensi dilakukan untuk menentukan konsentrasi lipid yang tersisa setelah ekstrusi, menggunakan lipid fluoresen DiI untuk mengukur kehilangan lipid selama proses. Kurva kalibrasi dibuat untuk setiap komposisi lipid setelah pembekuan-pencairan tetapi sebelum ekstrusi, menggunakan DiI sebagai penanda fluoresen. Sampel yang diekstrusi diencerkan 1:4 dengan PBS sebelum ditambahkan ke pelat hitam 96-well (Greiner). Standar kalibrasi berkisar dari 0,5 hingga 0,0625 mg mL −1 (konsentrasi yang lebih tinggi menunjukkan fluoresensi yang berkurang. Pengukuran fluoresensi dilakukan pada suhu ruangan, dengan eksitasi pada 485 nm, emisi pada 555 nm, dan titik potong pada 550 nm, menggunakan spektrofluorometer mikroplat SpectraMax Gemini XPS. Konsentrasi lipid kemudian dihitung menggunakan kurva kalibrasi. Pendekatan serupa digunakan untuk menilai hilangnya inti silika selama ekstrusi dan pencucian. Inti silika 100 nm biasa dicuci dengan sentrifugasi pada 15000 xg dan resuspensi dalam air dengan kekuatan ionik rendah dua kali untuk menghilangkan pewarna bebas akhirnya. Tidak ada kehilangan silika yang relevan yang diamati dan konsentrasi ditetapkan menjadi 1 mg mL −1 dan diencerkan secara serial untuk kurva kalibrasi. Konsentrasi LCS dan MCS yang disiapkan dihitung menggunakan kurva kalibrasi ini.
Distribusi Ukuran dan Pengukuran Potensi Zeta
Dengan menggunakan Malvern Zetasizer Nano ZS, diameter hidrodinamik dan potensi zeta dari CM-Liposom dan liposom ditentukan. Penghamburan cahaya dinamis (DLS) digunakan untuk menilai distribusi ukuran. Sampel diencerkan dalam PBS, air dengan kekuatan ionik rendah, atau media lengkap (mengandung 10% FBS) hingga konsentrasi ≈25 µg mL −1 lipid, atau 50 µg mL −1 saat menggunakan media lengkap atau 25 dan 100 µg mL −1 saat menggunakan silika. Pengukuran dilakukan pada suhu 25 °C menggunakan sel kapiler DTS1070 lipat sekali pakai (Malvern Instruments Ltd., Worcestershire, Inggris). Setiap pengukuran diulang tiga kali, dan rata-ratanya disajikan dalam gambar. Dalam kasus liposom, indeks bias untuk fosfolipid digunakan dan dalam kasus silika berlapis dan tidak berlapis, indeks bias silika digunakan.
Mikroskopi Gaya Atom (AFM)
Percobaan AFM dilakukan dalam cairan menggunakan mode Quantitative Imaging (QI) pada AFM berkecepatan sangat tinggi JPK Nanowizard. Untuk melumpuhkan nanopartikel, kaca berlapis poli-L-lisin disiapkan baru menurut protokol yang dipublikasikan. [ 60 ] Secara singkat, penutup kaca dibersihkan dengan etanol dan asam klorida (97%/3% v/v), kemudian diinkubasi dalam larutan poli-L-lisin 0,01 mg mL −1 selama satu jam. Kaca berlapis dibilas dengan air deionisasi dan dikeringkan pada suhu 37 °C semalaman. Liposom dan CM-Liposom dicitrakan dalam waktu 4 hari setelah persiapan, di sini larutan stok nanopartikel diencerkan dengan PBS, dan 50 µL sampel (≈0,015 mg mL −1 ) diaplikasikan ke kaca berlapis poli-L-lisin. Ruang tersebut kemudian diisi dengan 450 µL PBS. Untuk partikel Zw-LCS, Zw-MCS, dan SiO 2 , ≈0,06 mg mL −1 silika dilarutkan dalam 100 µL PBS dan dimuat pada kaca setelah itu ruang tersebut diisi dengan 400 µL PBS. Pengukuran dilakukan menggunakan probe qp-BioAC CB3 (Nanosensor) dengan konstanta pegas yang biasanya berkisar antara 0,03 dan 0,09 N m −1 . Sebelum pencitraan, kantilever dikalibrasi menggunakan metode berbasis kontak dan derau termal yang disediakan dalam perangkat lunak kontrol JPK Nanowizard (versi 6). Citra QI diambil dengan gaya yang meningkat (dalam langkah 10 pN, dimulai pada 80 pN dan naik hingga 170 pN) sambil menjaga parameter pencitraan lainnya tetap konstan (128 × 128 piksel, 3 µm x 3 µm, waktu piksel 15 ms, tinggi angkat 300 nm). Citra diproses menggunakan perangkat lunak JPK Data Processing (versi 6.1).
Pemrosesan Gambar AFM dan Ekstraksi Plot Ketinggian Otomatis
Gambar yang sudah dibersihkan dimuat ke Gwyddion (32-bit, versi 2.58, dirilis 2021-02-09). Dalam beberapa kesempatan, garis-garis muncul di tepi gambar (menunjukkan hilangnya kontak ujung) dan dalam kasus ini, garis-garis tersebut dihapus dengan alat potong. Analisis butiran dilakukan dengan menandai butiran menggunakan ambang batas ≈19 nm. Butiran yang menyentuh tepi dihilangkan. Kemudian, koordinat x, y, dan z untuk setiap butiran diekstraksi dan file keluaran yang dibatasi tab dibuat. File tersebut dikurasi secara manual dan jika data tinggi dari satu partikel memberikan beberapa titik data, tinggi tertinggi dipertahankan. Dalam kasus partikel LCS, MCS, dan SiO 2 , jumlah partikel yang ditampilkan sebagai dobel, tripel, dan sebagainya dihitung dan dikeluarkan dari data tinggi. Titik data yang, setelah pemeriksaan gambar, jelas bukan partikel juga dikeluarkan (misalnya artefak di sisi partikel). Untuk analisis gambar pada gaya yang meningkat, pertama, skrip dikembangkan dalam Python 3.12 untuk mengoreksi pergeseran kantilever pada gambar AFM yang diulang. 30 nm ditetapkan sebagai radius pergeseran yang dibolehkan. Kemudian, untuk mengoreksi potensi pergeseran gambar di seluruh gambar berurutan, nanopartikel referensi yang (i) ada di semua gambar, dan (ii) terisolasi secara spasial, tanpa partikel tetangga, dipilih. Koordinat nanopartikel referensi yang dipilih ditentukan dalam setiap gambar berikutnya untuk mengukur pergeseran posisi relatif dari lokasi awalnya pada gambar pertama. Vektor pergeseran yang dihitung kemudian diterapkan sebagai offset korektif ke semua koordinat partikel lainnya di setiap gambar, menyelaraskannya kembali ke referensi spasial yang konsisten berdasarkan gambar pertama dan secara efektif menghilangkan artefak yang disebabkan oleh pergeseran. Untuk mengekstrak plot ketinggian, skrip dikembangkan yang memeriksa berkas tab-delimited yang dikoreksi drift dari setiap set gaya pencitraan, dan mencocokkan koordinat x dan y partikel, dan menempatkan nilai x, y, dan z dari titik data yang sesuai ini dalam berkas tab-delimited baru, dengan cara ini melacak ketinggian partikel pada gaya pencitraan yang meningkat. Jika koordinat x, y terlalu jauh (terputus 100 nm) dari koordinat x dan y sebelumnya pada gaya pencitraan sebelumnya, lintasan baru dibuat. Lintasan yang dihasilkan mengikuti skrip ini juga diperiksa secara manual, untuk memastikan bahwa lintasan baru itu benar. Titik data yang jelas berasal dari partikel yang menempel lagi di tempat partikel sebelumnya berada (yang dapat disalahartikan sebagai nanopartikel yang sama) dihapus dari analisis. Setelah itu, ketinggian yang diperoleh diplot menggunakan Graphpad Prism (versi 8.4.3 (686)). Ketinggian yang dinormalisasi dihitung pada semua partikel dengan membagi ketinggian setiap partikel saat ini dengan ketinggian pada 80 pN.
Penghitungan Klaster AFM
Gambar yang dibersihkan dibuka dalam perangkat lunak Pemrosesan Data JPK (versi 6.1) dan jumlah partikel tunggal dan gugus dihitung secara manual (hanya gugus dan partikel yang terlihat secara keseluruhan yang disertakan) dan dilaporkan menggunakan GraphPad Prism.
Kinetika Penyerapan pada Lini Sel Model Leukemia
CML dan penyerapan liposom oleh sel diukur menggunakan flow cytometry. Sel K562 disemai pada 50.000 sel well -1 , THP-1 pada 150.000 sel well -1 di pelat 24 well (Sarstedt) dalam medium pertumbuhan 250 µL. Sel MOLM13 disemai pada 50.000 sel well -1 di medium pertumbuhan 150 µL di pelat 48 well (Greiner). Setelah 24 jam, nanopartikel ditambahkan dalam konsentrasi tersebut dalam 100 µL untuk mendapatkan konsentrasi yang diperlukan yang dicatat dalam keterangan gambar. Pelat dicampur dengan menggoyang pelat dengan lembut ke depan dan ke belakang. Penyerapan nanopartikel dinilai dalam berbagai lini sel pada berbagai waktu inkubasi. Pada waktu yang dipilih, sel dipanen, dipindahkan ke tabung FACS, dan dicuci dengan 500 µL PBS (2 kali 300 xg, 5 menit, RT), dan akhirnya disuspensikan kembali dalam 100 µL PBS. Data flow cytometry diperoleh menggunakan flow cytometer Cytoflex S (Beckman Coulter). Fluoresensi sel MOLM13 diperoleh menggunakan Quanteon 2 (Quanteon). Untuk percobaan penipisan energi, sel diinkubasi dengan nanopartikel dalam kondisi standar atau (setelah pra-inkubasi dengan 5 mg mL −1 NaN 3 dalam medium lengkap selama 30 menit) dengan adanya 5 mg mL −1 NaN 3 dalam medium lengkap. Data flow cytometry diproses dan dianalisis menggunakan perangkat lunak FlowJo (versi 10.8.1). Untuk membedakan populasi sel, hamburan maju (FSC) diplotkan terhadap hamburan samping (SSC), dan serpihan sel dikeluarkan dengan menerapkan gerbang. Selain itu, sel ganda dikecualikan dengan melakukan gating pada plot FSC-H versus FSC-A. Fluoresensi diukur untuk 20.000 sel per sampel, dengan tiga replikasi atau duplikat yang disiapkan untuk setiap kondisi eksperimen. Intensitas fluoresensi median untuk setiap kondisi dirata-ratakan di seluruh replikasi pada setiap titik waktu. Data ini kemudian dibuat grafiknya menggunakan GraphPad Prism (versi 8.4.3), setiap titik merupakan rata-rata dari triplikat atau duplikat.
Karakterisasi Mekanisme Penyerapan Nanopartikel dengan Inhibitor Transportasi
Sel K562 terpapar inhibitor endositosis sebelum dan selama inkubasi dengan nanopartikel. Sebelum percobaan, 50.000 sel disemai per sumur dalam pelat 24 sumur (Sarstedt). 24 jam setelah penyemaian, sel-sel tersebut terpapar berbagai inhibitor pada konsentrasi yang berbeda selama 30 menit dalam medium bebas serum (untuk dynasore) atau medium lengkap (untuk nocodazole, Cytochalasin D, EIPA, dan chlorpromazine).
Kondisi berikut ditemukan optimal dan digunakan dalam K562: natrium azida (Sigma Aldrich) 5 mg mL −1 ; 5-(N-etil-N-isopropil) amilorida (EIPA) (Tocris) 100 µ m ; Klorpromazin hidroklorida (Sigma Aldrich) 10 µg mL −1 ; Dynasore (Biovision) 50 µg mL −1 dan Nocodazole (Biovision) 5 µ m ; Cytochalasin D (Focus biomolecules) 2,5 µg mL −1 . Setelah preinkubasi, 20 µg mL −1 Pm-CM-Liposom dan Pm-Liposom dalam RPMI dengan 10% FBS ditambahkan ke sel dalam kondisi standar atau dengan adanya inhibitor yang berbeda.
Penentuan Fluiditas Dua Lapis dengan Laurdan GP
Untuk percobaan Laurdan, liposom dan CM-Liposom disiapkan seperti yang dijelaskan di atas tetapi tanpa DiI. Stok laurdan 100 m m (Tocris Bioscience) disiapkan dalam DMF. Setelah itu, liposom, CM-Liposom, dan liposom dipalmitoylphosphatidylcholine murni (DPPC dalam kloroform, Avanti Polar Lipids) sebagai kontrol diencerkan menjadi 0,2 mg mL −1 lipid dan 5 µ m laurdan ditambahkan ke setiap sumur dalam pelat hitam 96 sumur dengan dasar transparan (Greiner). Spektrum emisi ditangkap antara λ = 400 dan 600 nm, eksitasi λ = 340 nm dengan ukuran langkah λ = 10 nm, dan lebar pita λ = 9 nm dalam pembaca pelat Synergy H1 (BioTek). Spektrum fluoresensi dibaca pada suhu yang berbeda berkisar antara 22 hingga 65 °C, dengan waktu keseimbangan 3 menit di antara setiap suhu. Untuk menghitung polarisasi umum sebagai ukuran fluiditas dwi lapis, GP 320 dihitung menggunakan Persamaan berikut ( 1 ): [ 61 ]

Krio-EM
Sampel (3 µL) dengan nanopartikel silika berlapis (≈1 mg mL −1 ) dimuat pada kisi tembaga berlapis karbon (Quantifoil 3.5/1, Quantifoil Micro Tools) dan dibekukan dengan cepat dengan etana cair menggunakan Vitrobot (FEI). Gambar diperoleh dengan kamera CCD pemindaian lambat dalam kondisi dosis rendah pada mikroskop kriogenik Tecnai T20 (FEI) yang beroperasi pada 200 keV, dilengkapi dengan tahap kriogenik Gatan model 626. Setelah itu, gambar dibuka, dan partikel selanjutnya dikelompokkan dalam tiga situasi: Pelapisan penuh, pelapisan parsial, dan tanpa pelapisan asalkan partikel terlihat jelas, terlihat jelas, dan tidak tumpang tindih. Jumlah gambar yang dianalisis adalah sebagai berikut: Zw-LCS (38), Zw-MCS (34), Pm-LCS (33), dan Pm-MCS (33).
Percobaan Sel Primer
Sampel sumsum tulang atau darah tepi pasien AML dipelajari setelah persetujuan dan persetujuan protokol oleh Komite Etik UMCG sesuai dengan Deklarasi Helsinki (Nomor persetujuan NL43844.042.13). Sampel pasien dicairkan sebelum percobaan dan dibiarkan pulih dalam sel T75 dalam MEM alfa (Gibco, ThermoFisher Scientific, Inggris) dengan 25% FBS dengan adanya sitokin (G-CSF, IL3, Romiplostin, SR1, dan UM171) pada suhu 37 °C dalam atmosfer 5% CO 2 . Setelah ≈48 jam pemulihan, sel dikumpulkan dan disuspensikan kembali dalam berbagai konsentrasi LCS yang telah terdispersi sebelumnya, MCS, dan partikel SiO2 polos , dan sel ditanam dalam pelat 96 sumur (Greiner) pada 125.000 sumur sel −1 dalam 250 µL alpha MEM yang dilengkapi dengan 10% atau 25% FBS (dan sitokin) dengan hanya satu atau dua sampel replikasi, tergantung pada percobaan dan jumlah sel yang dipulihkan setelah pencairan. LCS dan MCS disiapkan sehari sebelum pemaparan sel. Partikel juga dipaparkan ke sel K562 untuk mengendalikan kemanjuran partikel yang digunakan dengan sel primer. Pada berbagai titik waktu, sel primer dipanen, ditempatkan dalam tabung FACS dan dipeletkan dengan sentrifugasi pada 450 xg selama 5 menit. Sel dicuci dengan 2 mL PBS dengan EDTA 0,5 mM, disentrifugasi, dan diwarnai dalam campuran pewarnaan antibodi dingin yang terdiri dari PE-Cyanine7 anti-human CD45 (nomor katalog Biolegend: 304016), PE anti-human CD34 (nomor katalog Biolegend: 343510), APC anti-human CD38 (nomor katalog Biolegend: 303510), DAPI dan Fc-block dalam PBS pada suhu 4 °C selama 30 menit. Untuk Pasien 1, populasi sel kecil diidentifikasi yang tidak termasuk dalam populasi blast berdasarkan hamburan. Penyerapan yang lebih tinggi dari MCS atas LCS diamati baik untuk populasi sel utama dan populasi yang tidak terdefinisi yang terdeteksi dalam plot hamburan sisi depan (Gambar S8c , Informasi Pendukung). Populasi sel yang tidak terdefinisi ini dikecualikan dari populasi blast seperti yang ditunjukkan pada gambar utama. Sel dicuci lagi dengan 2 mL PBS dengan 0,5 m m EDTA, disentrifugasi pada 450 xg selama 5 menit, disuspensikan kembali dalam 100 µL PBS, dan diukur pada MACSQuant X flow cytometer (Miltenyi Biotec, Jerman).
Analisis Statistik
Pada Gambar 2a , western blot diulang untuk mengonfirmasikan hasil dan menunjukkan hasil yang serupa. [ 9 ] Gambar 2c menunjukkan rata-rata dan SD dari median fluoresensi sel pada tiga sampel replikasi (mean ± SD, n = 3) dalam 3 eksperimen kinetika penyerapan independen. Gambar 2d menunjukkan hal yang sama untuk tiga eksperimen kinetika penyerapan independen, masing-masing dengan sampel duplikat (mean ± SD, n = 2). Pada Gambar 3 , satu contoh eksperimen ditunjukkan tetapi diulang beberapa kali dengan hasil yang serupa. Pada Gambar 3b , nilai tinggi individu yang diekstraksi pada 80 pN ditunjukkan bersama dengan mediannya (Pm-liposom: median, n = 179 – Pm-CML: median: n = 315), dan pada Gambar 3c mean dan SEM dari data yang sama dihitung dan ditunjukkan (Pm-liposom: mean ± SEM, n = 179 – Pm-CML: mean ± SEM, n = 315). Pada Gambar 3d , tinggi yang diekstraksi dari setiap partikel yang disertakan pada setiap gaya pencitraan dibagi dengan tinggi pada 80 pN untuk memberikan tinggi rata-rata yang dinormalkan per partikel. Tinggi yang dinormalkan ini kemudian dirata-ratakan atas semua partikel yang bertahan hidup per gaya pencitraan, dan SD dihitung (mean ± SD). Pada Gambar 4a, distribusi ukuran rata-rata oleh DLS dari 4 kelompok partikel Zw ditunjukkan (mean, n = 4), dan pada Gambar 4b dari 10 kelompok (mean, n = 4). Distribusi ukuran SiO2 ( rata-rata, n = 5) juga ditunjukkan sebagai referensi dalam a dan b. Pada Gambar 4c , tinggi setiap partikel individu dalam gambar AFM dilaporkan bersama dengan mediannya (SiO2 : median, n = 160), (Zw-LCS: median, n = 157), (Zw-MCS: median, n = 190) sementara rata-rata dan SEM dari hasil yang sama ditunjukkan pada Gambar 4d (SiO2 : rata-rata ± SEM, n = 160), (Zw-LCS: rata-rata ± SEM, n = 157), (Zw-MCS: rata-rata ± SEM, n = 190). Karena SD yang bervariasi dari tiga sampel, ANOVA yang dikoreksi Welch dan Brown-Forsythe digunakan untuk perbandingan ( p yang disesuaikan < 0,0001). Pada Gambar 5a–d ditunjukkan gambar cryo-EM representatif dari total: gambar Zw-LCS (38), Zw-MCS (34), Pm-LCS (33), Pm-MCS (33). Dalam gambar-gambar ini n partikel individual dianalisis (Zw-LCS: n = 276, Zw-MCS: n = 300, Pm-LCS: n = 205, Pm-MCS:n = 363), dan dibagi lagi menjadi pelapisan parsial dan penuh. Fraksi mereka (%) sehubungan dengan total populasi dihitung dan ditunjukkan pada Gambar 5e . Pada Gambar 5f eksitasi Laurdan diukur dalam sampel duplikat dan nilai GP 320 dihitung dan ditunjukkan (rata-rata, n = 2). Gambar 6a,b menunjukkan rata-rata dan SD lebih dari 2 sampel replikasi dari intensitas fluoresensi sel median (rata-rata ± SD, n = 2) dalam 6 (Gambar 6a ) atau 3 (Gambar 6b ) percobaan kinetika penyerapan. Hasil yang sama ditunjukkan pada Gambar 6d di mana intensitas fluoresensi rata-rata yang diperoleh untuk Zw- dan Pm-MCS telah dinormalisasi untuk intensitas fluoresensi rata-rata dari formulasi yang sama tanpa komponen membran (masing-masing Zw- dan Pm-LCS), bersama dengan rata-rata dan SD dari data yang dinormalisasi yang diperoleh dalam semua percobaan. (rata-rata ± SD, n bergantung pada titik waktu).
