Penerapan BMP-7 Chemically Modified RNA untuk Regenerasi Tulang dengan Gel Granular Kolagen-Asam Hialuronat yang Dapat Dicetak 3D
Abstrak
RNA yang dimodifikasi secara kimia (cmRNA) muncul sebagai alternatif yang lebih efektif untuk pengiriman protein dan terapi gen berbasis DNA. Untuk menerapkan teknologi ini untuk regenerasi tulang, diperlukan biomaterial yang sesuai yang berfungsi sebagai perancah dan sistem pengiriman. Studi ini memperkenalkan hidrogel granular yang dapat dicetak 3D yang terdiri dari asam hialuronat dan kolagen (THA-Col) untuk pengiriman protein morfogenetik tulang (BMP)-7 cmRNA sebagai matriks aktif untuk meningkatkan penyembuhan tulang. Hidrogel granular diproduksi dengan memecah gel THA-Col massal secara mekanis. Mikrogel yang dihasilkan dapat dicetak 3D dan diselidiki lebih lanjut dibandingkan dengan gel THA-Col massal untuk efisiensi transfeksi cmRNA BMP-7, sitotoksisitas, dan diferensiasi osteogenik sel stroma mesenkimal manusia (hMSC). Mikrogel menunjukkan viabilitas sel yang lebih tinggi daripada gel massal, sementara gel massal dan mikrogel dapat mendukung transfeksi dengan BMP-7. Selama diferensiasi osteogenik in vitro, hMSC pada mikrogel menunjukkan produksi alkali fosfatase (ALP) yang lebih tinggi dibandingkan dengan gel massal. Kombinasi mikrogel yang dimuat dengan cmRNA BMP-7 yang diperkenalkan dalam penelitian ini memiliki potensi signifikan terhadap pengembangan pengganti cangkok tulang khusus pasien untuk menggantikan cangkok tulang autolog dan pengiriman protein.
1 Pendahuluan
Dengan pergeseran demografi dan gaya hidup yang semakin aktif, insiden patah tulang terus meningkat. Meskipun tulang memiliki kapasitas penyembuhan intrinsik, kemampuan ini seringkali tidak cukup dalam kasus defek yang besar. Pencangkokan tulang autologus masih merupakan perawatan klinis standar saat ini, membuat transplantasi tulang sangat lazim. [ 1 ] Namun, prosedur ini memiliki kelemahan utama, termasuk morbiditas tempat donor, jumlah tulang yang terbatas yang dapat dipanen untuk transplantasi, dan risiko infeksi atau kerusakan iatrogenik karena sifat invasif dari prosedur tersebut. [ 2 ] Hal ini menyoroti perlunya mengembangkan alternatif untuk menggantikan pencangkokan otomatis sebagai perawatan untuk defek tulang.
Meskipun biomaterial dapat mendukung diferensiasi osteogenik sel stroma mesenkimal manusia (hMSC), [ 3 ] penambahan stimulus, seperti faktor pertumbuhan, dapat secara signifikan meningkatkan regenerasi tulang. Protein morfogenetik tulang (BMP), seperti BMP-2 dan BMP-7, telah disetujui oleh otoritas Eropa dan Amerika Utara untuk berbagai aplikasi ortopedi. [ 4 – 6 ] Protein ini memiliki waktu paruh yang cukup pendek, dan produk komersial mengimbanginya dengan pemberian konsentrasi suprafisiologis, yang pada gilirannya telah dikaitkan dengan efek samping yang serius. [ 7 , 8 ]
Pengiriman terapi gen yang mengkode faktor pertumbuhan yang diinginkan telah mendapatkan popularitas. Misalnya, terapi gen berbasis DNA dapat diimplementasikan menggunakan vektor untuk pengiriman, yang memungkinkan mesin sel itu sendiri untuk menghasilkan protein yang diinginkan. Ini memiliki keuntungan bahwa protein dapat diekspresikan untuk jangka waktu yang lebih lama menggunakan dosis yang diberikan lebih rendah. Messenger RNA (mRNA) menawarkan banyak manfaat dibandingkan dengan terapi berbasis DNA. [ 9 ] Keuntungan ini termasuk proses produksi mRNA yang lebih hemat biaya dan lebih sederhana, peningkatan efisiensi dalam internalisasi dan transfeksi sel, tidak adanya persyaratan untuk memasuki nukleus, dan berkurangnya risiko mutasi atau efek genotoksis. Keberhasilan klinis vaksin SARS-CoV-2 dengan cepat berkontribusi untuk membuat teknologi ini dapat diakses secara luas.
RNA yang dimodifikasi secara kimia (cmRNA) menarik minat yang meningkat karena peningkatan stabilitas dan penurunan imunogenisitas dibandingkan dengan mRNA yang tidak dimodifikasi. [ 10 – 13 ] CmRNA BMP-2 telah digunakan untuk rekayasa jaringan tulang, [ 12 , 14 – 18 ] termasuk pengujian pada defek femur tikus, yang menghasilkan pembentukan tulang baru setelah 2 minggu. [ 16 ] CmRNA BMP-2 juga dimuat dalam gel fibrin dengan partikel kalsium fosfat (CaP), untuk mentransfeksi hMSC dan menginduksi osteogenesis. [ 12 ] Pekerjaan kami sebelumnya yang memberikan cmRNA BMP-7 ke lapisan sel monolapis 2D menunjukkan potensi osteogenik dari molekul ini. [ 19 ] Namun, sejauh pengetahuan kami, belum ada penelitian yang dilaporkan tentang pembuatan matriks yang diaktifkan transkrip spesifik untuk pengiriman cmRNA dalam regenerasi tulang.
Hidrogel telah banyak digunakan untuk rekayasa jaringan tulang dan merupakan kandidat yang sangat baik untuk pengiriman terapeutik. [ 20 – 22 ] Hidrogel meniru lingkungan matriks ekstraseluler (ECM) alami dan dapat meningkatkan aktivitas biologis. Banyak biomaterial telah digunakan sebagai hidrogel untuk rekayasa jaringan tulang, termasuk polimer alami dan sintetis. [ 23 ] Biopolimer alami seperti asam hialuronat (HA) dan kolagen (Col) populer karena biokompatibilitas dan kelimpahannya dalam ECM alami. [ 24 , 25 ] HA adalah polimer karbohidrat yang dapat dimodifikasi dengan gugus tiramin (THA) sehingga dapat diikat silang secara independen menggunakan enzim dan cahaya, untuk menghasilkan hidrogel viskoelastis dan pengencer geser untuk pencetakan 3D. [ 26 – 28 ] HA secara inheren memiliki perlekatan sel yang terbatas karena kurangnya bagian pengikat sel, serta dicirikan dengan rasio pembengkakan yang tinggi. [ 3 ] Sebaliknya, Col kaya akan urutan asam amino seperti RGD yang meningkatkan perlekatan sel dan dikenal karena penyusutan yang dimediasi sel. [ 25 , 29 ] Oleh karena itu, kombinasi THA dan Col (THA-Col) dapat mengoptimalkan penyusutan dan perlekatan sel, seperti yang ditunjukkan dalam gel massal untuk mendukung kondrogenesis dan osteogenesis hMSC secara in vitro. [ 3 , 29 ]
Hidrogel curah tidak memiliki porositas, sehingga mengakibatkan infiltrasi dan migrasi sel terbatas. Penggunaan mikrogel telah muncul sebagai platform untuk menghasilkan perancah mikropori [ 30-33 ] dan hidrogel granular telah terbukti mendukung peningkatan migrasi dan proliferasi sel dibandingkan dengan hidrogel curah. [ 33-35 ] Selain itu, mikrogel telah dilaporkan menjadi kandidat yang sangat baik untuk pencetakan 3D karena kemampuannya untuk mengalir di bawah gaya geser. [ 36 , 37 ] Mikrogel dapat dibuat melalui emulsi batch, emulsi mikrofluida, atau fragmentasi mekanis. Emulsi batch mudah dan sederhana untuk diterapkan, tetapi menghasilkan polidispersitas tinggi. Emulsi mikrofluida menawarkan kontrol tinggi atas bentuk dan ukuran partikel, tetapi ini disertai dengan kompleksitas tambahan, hasil rendah, dan skalabilitas yang menantang. [ 38 , 39 ] Dalam fragmentasi mekanis, mikrogel diproduksi dengan memecah hidrogel curah secara mekanis, misalnya dengan memaksanya melalui jaring. Metode ini sederhana dan dapat diskalakan, tidak memerlukan penggunaan bahan-bahan beracun, dan ukuran partikel serta porositas mikrogel dapat dikontrol dengan memvariasikan ukuran mata jaring. [ 40 , 41 ] Selain itu, hidrogel granular yang diproduksi dengan fragmentasi telah terbukti mendukung kultur sel jangka panjang, yang dikaitkan dengan stabilitas mekanis yang lebih tinggi dibandingkan dengan teknik pembuatan mikrogel lainnya. [ 38 ] Penggunaan mikrogel yang terfragmentasi secara mekanis telah mendapatkan popularitas dalam beberapa tahun terakhir dan banyak penelitian melaporkan potensi yang signifikan untuk berbagai aplikasi biologis, seperti hidrogel granular zwitterionik untuk perbaikan tulang rawan [ 41 ] dan mikrogel berbasis HA untuk perbaikan diskus intervertebralis. [ 42 ] Sejauh pengetahuan kami, hidrogel granular untuk pengiriman terapeutik cmRNA untuk meningkatkan perbaikan tulang belum diperkenalkan.
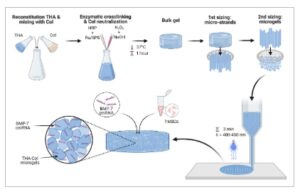
Oleh karena itu, tujuan dari penelitian ini adalah untuk mengembangkan hidrogel granular THA-Col yang dapat dicetak 3D untuk pengiriman cmRNA BMP-7 untuk meningkatkan regenerasi tulang ( Gambar 1 ). Untuk tujuan ini, mikrogel dibuat menggunakan fragmentasi mekanis gel massal dan dibandingkan dengan komposisi yang sama persis dari gel massal yang tidak terfragmentasi. Massal dan mikrogel dikarakterisasi dalam hal reologi, pembengkakan, degradabilitas, sifat mekanis massal, dan mikrogel juga dievaluasi untuk dapat dicetak. Sitotoksisitas THA-Col massal dan mikrogel dinilai secara in vitro melalui toksisitas tidak langsung menggunakan sel L929 menurut pedoman ISO-10993-5. Selanjutnya, efisiensi transfeksi dan sitotoksisitas cmRNA BMP-7 dalam hMSC pada THA-Col massal dan mikrogel diselidiki oleh ekspresi metridia luciferase (MetLuc), sekresi protein BMP-7, pelepasan LDH, aktivitas metabolik, dan analisis viabilitas sel. Selanjutnya, diferensiasi osteogenik in vitro dari hMSC yang ditransfeksi dengan cmRNA BMP-7 pada massal atau mikrogel dianalisis berdasarkan aktivitas alkali fosfatase (ALP), sekresi osteoprotegerin (OPG) dan ekspresi gen penanda osteogenik.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Skema pembuatan matriks mikrogel THA-Col.
2 Hasil
2.1 Mikrogel THA-Col Cetak 3D
Mikrogel THA-Col dibuat dengan mencampurkan THA yang telah direkonstitusi dengan Col terlebih dahulu, diikuti dengan penambahan pengikat silang HRP, Ru, dan SPS (Gambar 1 ). Hidrogen peroksida kemudian ditambahkan ke dalam campuran untuk memulai pengikatan silang enzimatik, sementara pada saat yang sama Col dinetralkan menggunakan natrium hidroksida. Setelah pengikatan silang enzimatik, hidrogel yang terikat silang sebagian terbentuk yang dapat digunakan baik sebagai bahan curah atau diproses lebih lanjut untuk membuat mikrogel. Untuk menghasilkan mikrogel, gel THA-Col curah dilewatkan tiga kali melalui kisi berukuran mata jaring 100 µm, yang dioptimalkan berdasarkan pekerjaan sebelumnya dan pengujian awal. [ 43 ] Mikrogel THA-Col kemudian siap digunakan untuk pencetakan 3D, diikuti dengan pengikatan silang menggunakan cahaya biru tampak untuk mempertahankan bentuk.
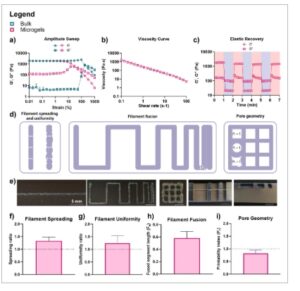
Karakterisasi reologi dilakukan untuk menilai kesesuaian tinta mikrogel THA-Col untuk pencetakan 3D. [ 44 ] Di sini, sapuan amplitudo mengungkapkan nilai G’ yang sama untuk sampel massal dan mikrogel, sementara G” lebih tinggi untuk mikrogel dibandingkan dengan THA-Col massal ( Gambar 2 a ). Kurva viskositas menunjukkan bahwa mikrogel THA-Col menunjukkan perilaku viskoelastis dan penipisan geser (Gambar 2b ). Pemulihan elastis mikrogel yang mengalami regangan rendah (1%) dan tinggi (500%) bergantian menunjukkan penurunan G’ di bawah regangan tinggi, menghasilkan G'<G”. Setelah kembali ke regangan rendah, G’ dan G” dikembalikan ke nilai yang sebanding dengan pengukuran awal mereka (Gambar 2c ).
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Matriks mikrogel THA-Col cetak 3D. a) Sapuan amplitudo setelah ikatan silang enzimatik, n = 3. b) Kurva viskositas mikrogel, n = 3. c) Pemulihan elastis mikrogel dengan regangan rendah (1%) dan tinggi (500%) bergantian, n = 3. d) Evaluasi skematis penilaian kemampuan cetak (penyebaran dan keseragaman filamen, fusi filamen, dan geometri pori). e) Untaian mikrogel THA-Col cetak 3D, fusi filamen, kisi, dan pilar yang menjorok, skala batang = 5 mm. Kuantifikasi f) penyebaran filamen, n = 3, g) keseragaman filamen, n = 3, h) fusi filamen, n = 3, dan i) geometri pori, n = 3. THA = Asam hialuronat yang dimodifikasi dengan tyramin, Col = kolagen.
Kemampuan cetak mikrogel THA-Col dianalisis berdasarkan penyebaran dan keseragaman filamen, fusi filamen, geometri pori, dan uji pilar yang menjorok (Gambar 2d,e ). Kuantifikasi penyebaran filamen menghasilkan rasio 1,3, yang menunjukkan bahwa diameter penyangga yang dicetak lebih besar daripada nosel pencetakan 3D (Gambar 2f ). Keseragaman filamen yang diukur sedikit di atas 1, yang menunjukkan filamen yang umumnya seragam dengan aberasi minor (Gambar 2g ). Panjang segmen yang menyatu (Fs ) dari pola berkelok-kelok ditentukan menjadi ≈0,6 (Gambar 2h ). Geometri pori kisi menunjukkan nilai P r di bawah 1, dengan beberapa variasi di antara replika seperti yang diilustrasikan oleh deviasi standar, dan beberapa pori lebih dekat ke kuadrat sempurna P r = 1 (Gambar 2i ). Filamen yang menjorok pada struktur pilar menunjukkan kapasitas untuk menjembatani semua celah hingga 6 mm (Gambar 2e ).
2.2 Karakterisasi Matriks Massal dan Mikrogel THA-Col
Matriks THA-Col massal dan mikrogel dibandingkan berdasarkan pembengkakan, degradasi, dan sifat mekanis. Selama 48 jam, tidak ada pembengkakan yang diamati untuk massal dan mikrogel ( Gambar 3 a ). Degradasi THA-Col massal dan mikrogel dalam larutan yang mengandung 100 U mL −1 hialuronidase dinilai selama periode 48 jam. Hasilnya menunjukkan bahwa mikrogel menunjukkan laju degradasi yang jauh lebih tinggi daripada THA-Col massal (Gambar 3b ). Setelah 48 jam, 50% mikrogel telah terdegradasi, sedangkan material massal hanya menunjukkan laju degradasi 28%. Uji kompresi tak terbatas mengungkapkan modulus kompresi sebesar 34 kPa untuk THA-Col massal, sedangkan mikrogel menunjukkan nilai yang jauh lebih rendah sebesar 27 kPa (Gambar 3c ).

Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Karakterisasi matriks mikrogel dan massal THA-Col. a) Rasio pembengkakan dalam PBS, n = 6. b) Degradasi dalam 100 U mL −1 hialuronidase setelah 24 jam pembengkakan, n = 6. c) Modulus kompresif setelah 24 jam pembengkakan, dihitung antara regangan 0 dan 10%, n = 6. ANOVA satu arah dengan koreksi Šidák digunakan untuk analisis statistik, ∗ p < 0,05, ∗∗ p < 0,01, ∗∗∗ p < 0,001, ∗∗∗∗ p < 0,0001, dan ns = tidak signifikan. THA = Asam hialuronat yang dimodifikasi dengan tyramine, Col = kolagen.
2.3 Sitotoksisitas THA-Col Bulk dan Mikrogel pada Sel L929
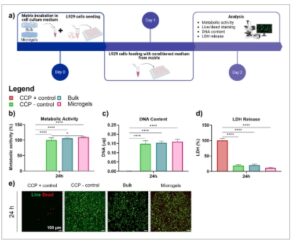
Sitotoksisitas THA-Col curah dan mikrogel diselidiki menurut pedoman ISO-10993-5 ( Gambar 4 a ). Sel yang diobati dengan media terkondisi dari curah dan mikrogel tidak menunjukkan penurunan signifikan dalam aktivitas metabolik, kandungan DNA, atau pelepasan LDH jika dibandingkan dengan sel yang tidak diobati dalam kontrol negatif (Gambar 4b–d , berturut-turut). Demikian pula, viabilitas sel menurut pewarnaan Hidup/Mati menunjukkan hasil yang sebanding antara kontrol negatif dan sel yang diinkubasi dengan media terkondisi dari THA-Col curah atau mikrogel Gambar 4e
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Sitotoksisitas tak langsung dari matriks massal dan mikrogel THA-Col diuji dengan sel L929. a) Skema tatanan eksperimen toksisitas tak langsung in vitro. b) Aktivitas metabolik setelah 24 jam dinormalisasi ke CCP – kontrol, n = 4. c) Kuantifikasi kandungan DNA setelah 24 jam, n = 4. d) Kuantifikasi pelepasan LDH setelah 24 jam, n = 4. e) Gambaran representatif pewarnaan hidup (hijau) dan mati (merah) setelah 24 jam, skala batang = 100 µm, n = 4. ANOVA satu arah dengan koreksi Šidák digunakan untuk analisis statistik, ∗ p < 0,05, ∗∗ p < 0,01, ∗∗∗ p < 0,001, ∗∗∗∗ p < 0,0001, dan ns = tidak signifikansi. CCP = Plastik kultur sel, CCP + kontrol = Plastik kultur sel yang diberi perlakuan Triton 0,1%, CCP – kontrol = Plastik kultur sel dengan medium tak terkondisikan, THA = Asam hialuronat yang dimodifikasi dengan tiramin, Kol = kolagen, LDH = Laktat dehidrogenase.
2.4 Transfeksi hMSC secara in Vitro pada THA-Col Bulk dan Microgels dengan MetLuc dan cmRNA BMP-7
Sekresi hMSC dari metridia luciferase dan BMP-7 setelah transfeksi cmRNA dinilai setelah 1, 3, dan 7 hari ( Gambar 5a ) . hMSC yang ditransfeksi terlebih dahulu dalam suspensi sebelum disemai pada gel THA-Col digunakan sebagai kontrol positif. Metridia luciferase menunjukkan aktivitas tertinggi pada hari ke-1, diikuti oleh hari ke-3 dan terendah pada hari ke-7 untuk semua kelompok (Gambar 5b ). Pada hari ke-1, aktivitas tertinggi terdapat pada kelompok yang ditransfeksi, sementara tidak ada aktivitas yang diukur pada hMSC yang tidak ditransfeksi pada THA-Col bulk dan microgel. Tidak ada perbedaan signifikan yang terdeteksi antara kelompok yang ditransfeksi pada gel dan kontrol positif yang ditransfeksi terlebih dahulu. Transfeksi dengan cmRNA BMP-7 menghasilkan tren yang sama (Gambar 5c ), dengan jumlah tertinggi BMP-7 terdeteksi pada hari ke-1 dan penurunan konsentrasi pada hari ke-3 dan ke-7. Pada semua titik waktu, tidak ada BMP-7 yang disekresikan oleh sel yang tidak ditransfeksi. Tren yang tidak signifikan diamati, yang menunjukkan bahwa sel kontrol positif yang ditransfeksi sebelumnya menghasilkan kadar BMP-7 yang lebih tinggi jika dibandingkan dengan sel yang ditransfeksi pada matriks. Tidak ada perbedaan signifikan yang dapat diamati antara hMSC yang ditransfeksi pada THA-Col bulk dan mikrog
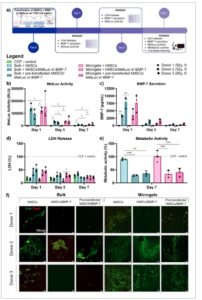
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Efisiensi transfeksi dan sitotoksisitas cmRNA BMP-7 dengan hMSC pada THA-Col massal dan mikrogel. a) Skema efisiensi transfeksi in vitro dan pengaturan sitotoksisitas. b) Ekspresi metridia luciferase setelah 1, 3, dan 7 hari, n = 3. c) Sekresi BMP-7 dalam medium kultur setelah 1, 3, dan 7 hari, n = 3. d) Kuantifikasi pelepasan LDH setelah 1, 3, dan 7 hari, n = 3. e) Aktivitas metabolik setelah 7 hari dinormalisasi ke CCP – kontrol, n = 3. f) Gambaran representatif pewarnaan hidup (hijau) dan mati (merah) setelah 7 hari, skala batang = 100 µm, n = 3. ANOVA satu arah dengan koreksi Šidák digunakan untuk analisis statistik pada gambar c dan ANOVA dua arah dengan uji perbandingan berganda Tukey digunakan untuk gambar b,e,f, ∗ p < 0,05, ∗∗ p < 0,01, ∗∗∗ p < 0,001, ∗∗∗∗ p < 0,0001, dan ns = tidak ada signifikansi. THA = Asam hialuronat yang dimodifikasi oleh tyramine, Col = kolagen, MetLuc = Metridia luciferase.
Tren yang tidak signifikan dalam pelepasan LDH juga diamati, dengan kadar tertinggi diukur pada hari ke-1 dan ke-3 untuk kelompok yang ditransfeksi dengan BMP-7, khususnya memuncak pada hari ke-1 pada kelompok yang ditransfeksi sebelumnya (Gambar 5d ). Pada hari ke-7, kadar LDH di semua kelompok sebanding. Aktivitas metabolik hMSC yang ditransfeksi baik dalam bentuk massal maupun mikrogel serupa dengan kontrol negatif CCP, meskipun sedikit peningkatan diamati pada kelompok mikrogel (Gambar 5e ). Semua kelompok yang ditransfeksi menunjukkan aktivitas metabolik yang berkurang secara signifikan. Selain itu, viabilitas sel yang dinilai melalui pewarnaan Hidup/Mati menguatkan temuan ini, menunjukkan jumlah sel yang hidup lebih rendah pada kelompok yang ditransfeksi (Gambar 5f ).
Morfologi sel, yang dievaluasi secara kualitatif berdasarkan fluoresensi Calcein, menunjukkan adhesi yang baik untuk MSC yang tumbuh pada gel massal dan mikrogel (Gambar S2a,b , Informasi Pendukung, masing-masing).
2.5 Diferensiasi Osteogenik hMSC yang Ditransfeksi dengan cmRNA BMP-7 pada THA-Col Bulk dan Mikrogel
Kemampuan hMSC yang ditransfeksi cmRNA BMP-7 untuk menjalani diferensiasi osteogenik pada THA-Col massal dan mikrogel dinilai selama 28 hari melalui produksi ALP, sekresi OPG dalam medium, dan ekspresi gen ( Gambar 6 a ).
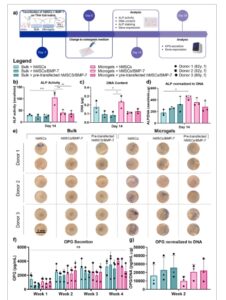
Gambar 6
Buka di penampil gambar
Presentasi PowerPoint
Diferensiasi osteogenik hMSC pada matriks massal THA-Col dan mikrogel yang dikombinasikan dengan cmRNA BMP-7. a) Skema tatanan percobaan diferensiasi osteogenik in vitro. b) Aktivitas ALP setelah 14 hari, n = 3. c) Kuantifikasi kandungan DNA setelah 14 hari, n = 3. d) Aktivitas ALP dinormalisasi terhadap kandungan DNA setelah 14 hari, n = 3. e) Gambar pewarnaan ALP (biru) setelah 14 hari, skala batang = 5 mm, n = 3. f) Sekresi OPG dalam medium kultur digabungkan per minggu, n = 3. g) Sekresi OPG pada minggu ke-2 dinormalisasi terhadap kandungan DNA setelah 14 hari, n = 3. ANOVA satu arah dengan koreksi Šidák digunakan untuk analisis statistik pada gambar b,c,d dan ANOVA dua arah dengan uji perbandingan berganda Tukey digunakan untuk gambar f, ∗ p < 0,05, ∗∗ p < 0,01, ∗∗∗ p < 0,001, ∗∗∗∗ p < 0,0001, dan ns = tidak signifikan. THA = Asam hialuronat yang dimodifikasi oleh tyramine, Col = kolagen, ALP = Alkaline phosphatase, AR = Alizarin Red, OPG = Osteoprotegerin.
Baik aktivitas ALP maupun kandungan DNA paling tinggi pada mikrogel THA-Col dengan sel yang tidak ditransfeksi (Gambar 6b ). Pada kelompok ini, aktivitas ALP secara signifikan lebih tinggi dibandingkan dengan kelompok yang sama pada gel THA-Col massal. Menariknya, aktivitas ALP hMSC yang ditransfeksi pada biomaterial atau yang telah ditransfeksi sebelumnya sebanding. Di antara kelompok cmRNA BMP-7 yang ditransfeksi, nilai serupa diamati, dengan tren aktivitas ALP yang sedikit lebih tinggi untuk sel pada mikrogel THA-Col dibandingkan dengan massal. Kandungan DNA paling tinggi pada kelompok yang tidak ditransfeksi seperti yang diharapkan, dengan tren yang tidak signifikan lebih tinggi pada mikrogel (Gambar 6c ). Pada kelompok cmRNA BMP-7 yang ditransfeksi, kandungan DNA yang serupa diukur, meskipun sedikit peningkatan diamati untuk hMSC yang dikultur pada mikrogel. Aktivitas ALP yang dinormalisasi ke DNA secara signifikan lebih tinggi pada hMSC yang tidak ditransfeksi pada mikrogel dibandingkan dengan kelompok yang sama pada THA-Col massal (Gambar 6d ). Untuk kelompok lain, sementara tidak ada signifikansi statistik yang terdeteksi, tren menunjukkan bahwa sel-sel pada gel massal memiliki ALP/DNA yang sedikit lebih tinggi pada kelompok pra-transfeksi dibandingkan dengan sel-sel yang ditransfeksi pada gel. Sebaliknya, kecenderungan ini terbalik untuk hMSC pada mikrogel. Hasil aktivitas ALP diperkuat oleh pewarnaan ALP (Gambar 6e ), dengan pewarnaan ALP paling intens pada hMSC yang tidak ditransfeksi pada mikrogel, diikuti oleh sel-sel yang ditransfeksi cmRNA BMP-7 pada mikrogel. Pada gel massal THA-Col, sangat sedikit atau tidak ada pewarnaan yang dapat diamati.
Tingkat OPG dalam medium dilaporkan dalam Gambar 6f,g . Mirip dengan aktivitas ALP, tidak ada perbedaan dalam OPG/DNA antara hMSC yang ditransfeksi sebelumnya atau ditransfeksi pada bahan. Secara umum, untuk semua kelompok tren peningkatan dari waktu ke waktu terungkap, meskipun pada setiap titik waktu tidak ada perbedaan signifikan secara statistik yang diamati antara kelompok, karena variabilitas yang tinggi. Untuk OPG/DNA pada minggu ke-2 (Gambar 6g ), kelompok cmRNA BMP-7 yang ditransfeksi pada bulk atau microgel menunjukkan peningkatan nilai dibandingkan dengan kontrol yang tidak ditransfeksi. Selain itu, tingkat ekspresi gen dari beberapa penanda osteogenik diukur (Gambar S3 , Informasi Pendukung). Sementara sebagian besar hasil ekspresi gen tidak menunjukkan perbedaan statistik antara kelompok karena deviasi standar yang tinggi, rasio RUNX2 / SOX9 menunjukkan tren yang sejalan dengan aktivitas ALP yang diamati. Variabilitas eksperimental yang signifikan sering dicatat ketika menggunakan sel yang berasal dari pasien. Namun demikian, sel primer memiliki relevansi klinis yang lebih besar, dan variasi serupa dalam hasil juga terbukti di antara pasien manusia. Secara keseluruhan, temuan kami menyoroti area yang menjanjikan untuk penyelidikan lebih lanjut.
3 Diskusi
Pandemi COVID-19 baru-baru ini telah mengkatalisasi evolusi cepat teknologi berbasis RNA, sehingga menciptakan banyak peluang untuk penerapannya di sektor lain. cmRNA sangat menarik, karena memiliki potensi besar untuk mengatasi kekurangan pengiriman protein dan terapi gen (DNA). [ 13 ] Untuk mengeksploitasi potensi ini dalam rekayasa jaringan tulang, kombinasi cmRNA dengan biomaterial yang sesuai yang memungkinkan transfeksi yang berhasil diperlukan. [ 22 ] Penelitian ini bertujuan untuk mengisi kesenjangan ini dengan mengembangkan dan mengevaluasi matriks aktif cetak 3D berdasarkan matriks mikrogel THA-Col untuk secara khusus mengirimkan cmRNA BMP-7 dan meningkatkan penyembuhan tulang.
HA dan Col adalah biopolimer alami yang ada dalam ECM tubuh, dengan Col berfungsi sebagai konstituen utama tulang alami. Integrasi THA dan Col memanfaatkan manfaat dari masing-masing komponen secara individual sekaligus mengurangi kekurangannya. Misalnya, pencetakan Col sendiri menghadirkan tantangan yang signifikan karena sifat viskoelastisnya; namun, ketika dikombinasikan dengan THA, ia menjadi cocok untuk pencetakan. [ 3 , 29 ] Meskipun pencetakan 3D THA-Col massal dimungkinkan, mikrogel lebih jauh meningkatkan sifat pencetakan 3D sekaligus menciptakan porositas untuk meningkatkan proliferasi dan migrasi sel. [ 30 – 32 ] Dalam penelitian ini, THA-Col massal difragmentasi secara mekanis dengan proses yang sederhana, dapat direproduksi, dan dapat diskalakan. Mikrogel yang dihasilkan menunjukkan profil viskoelastis yang sangat baik dengan sifat pemulihan geser elastis yang ideal untuk tujuan pencetakan 3D, dengan peningkatan dibandingkan dengan formulasi massal [ 3 ] dan mengonfirmasi laporan sebelumnya. [ 41 ]
Sinergi antara THA dan Col meluas ke sifat pembengkakan. THA bersifat hidrofilik dan dapat menunjukkan pembengkakan yang berlebihan, sementara Col dikenal karena penyusutan yang dimediasi sel. Kombinasi mereka sebelumnya terbukti menghasilkan gel massal komposit dengan pembengkakan sedang selama 28 hari dalam kultur sel. [ 3 ] Mikrogel dalam penelitian saat ini mengonfirmasi hasil ini, dan tidak ada pembengkakan atau penyusutan yang terdeteksi untuk massal THA-Col dan mikrogel. Namun, mikrogel terdegradasi lebih cepat dibandingkan dengan massal yang sesuai. Ini mungkin disebabkan oleh porositas dan luas permukaan yang lebih tinggi yang terpapar pada hialuronidase. Porositas yang lebih tinggi dan gerakan relatif partikel mikrogel ini mungkin juga bertanggung jawab atas modulus kompresif yang lebih rendah dibandingkan dengan gel massal, yang juga telah diamati dalam penelitian lain menggunakan hidrogel granular berbasis HA. [ 45 ] Meskipun konstruksi tetap kohesif selama kultur in vitro dan uji degradasi, kehati-hatian diperlukan saat mengekstrapolasi hasil ini ke kondisi in vivo. Memang, beberapa mekanisme lain yang memengaruhi degradasi terjadi secara in vivo, termasuk sirkulasi darah dan limfatik, stres oksidatif, dan degradasi aktif oleh populasi sel lain (misalnya, sel imun) yang tidak dapat direproduksi secara in vitro.
Meskipun ada bukti substansial yang mendukung efektivitas produk klinis berbasis BMP-2 dan BMP-7, kekhawatiran tetap ada mengenai efek samping yang terkait dengan penggunaan konsentrasi suprafisiologis. [ 4 , 7 , 8 ] BMP-7 adalah salah satu orthobiologics pertama yang digunakan di klinik, namun produk yang sesuai (OP-1) dihentikan karena alasan pasar dan karena kekhawatiran tentang efek samping, [ 46 ] yang disebabkan oleh pemberian dosis besar tanpa mekanisme pelepasan yang terkendali. Teknologi RNA membuka peluang baru untuk penggunaan BMP-7, dengan minat yang meningkat karena meningkatnya jumlah laporan efek samping untuk BMP-2. [ 8 ] Penelitian yang ditujukan untuk mengatasi keterbatasan ini dengan menggunakan mRNA yang mengkode faktor pertumbuhan yang diinginkan, mirip dengan vaksin SARS-CoV-2 sangat menjanjikan. Secara khusus, modifikasi kimia meningkatkan stabilitas mRNA dan mengurangi imunogenisitasnya. [ 11 – 13 ]
Langkah-langkah kunci dalam mengembangkan matriks aktif berbasis cmRNA untuk regenerasi tulang meliputi pelestarian efisiensi transfeksi, aktivitas biologis faktor pertumbuhan, dan viabilitas sel yang ditransfeksi. Dalam studi ini, efisiensi transfeksi diuji dengan metridia luciferase sebagai pelapor, dengan sekresi BMP-7, dan dengan diferensiasi osteogenik hMSC. Di sini, hasil kuncinya adalah bahwa hMSC yang ditransfeksi pada biomaterial menunjukkan kadar yang sebanding dengan hMSC yang ditransfeksi sebelumnya, berdasarkan aktivitas ALP/DNA, dan sekresi OPG. Ini menunjukkan bahwa gel THA/Col granular dan massal dapat digunakan sebagai matriks aktif untuk menghasilkan cmRNA BMP-7 dengan pelestarian aktivitas biologis. Mempertimbangkan hasil kemampuan cetak, sitokompatibilitas, dan aktivitas metabolik setelah transfeksi, versi granular gel muncul sebagai komposisi utama.
hMSC berhasil ditransfeksi pada bulk dan microgel, dengan kadar tertinggi pada hari ke-1, seperti yang diharapkan. Kadar ekspresi protein yang berbeda untuk sekresi metridia luciferase dan BMP-7 dapat dikaitkan dengan metode deteksi yang berbeda, serta sifat intrinsik seperti perbedaan ukuran, titik isoelektrik, dan fungsi biologis dari 2 protein tersebut. Transfeksi dengan cmRNA BMP-7 menyebabkan peningkatan yang tidak signifikan dalam pelepasan LDH pada hari ke-1 dan ke-3, sementara kadarnya kembali ke nilai yang mirip dengan hMSC yang tidak ditransfeksi pada hari ke-7.
Pada hari ke-7, hMSC yang ditransfeksi menunjukkan penurunan aktivitas metabolik dan berkurangnya jumlah sel yang hidup. Secara keseluruhan, pengamatan ini menunjukkan bahwa transfeksi awalnya menyebabkan tingkat sitotoksisitas. Meskipun ada pemulihan bertahap selama seminggu, jumlah sel total tetap lebih rendah, yang menyebabkan aktivitas metabolik berkurang dan lebih sedikit sel hidup pada titik waktu ini. Penelitian telah menunjukkan bahwa transfeksi cmRNA dapat mengakibatkan penurunan viabilitas sel, [ 12 ] yang dapat menjadi konsekuensi langsung dari proses transfeksi atau pelepasan burst awal yang mengikuti transfeksi yang berhasil. Salah satu strategi yang mungkin untuk menyempurnakan kontrol atas profil pelepasan adalah mengoptimalkan dosis cmRNA BMP-7, atau menanamkannya ke dalam mikropartikel yang terbuat dari THA-Col atau mikrogel lain, yang memungkinkan pelepasannya secara bertahap saat hidrogel terdegradasi. Penelitian di masa mendatang dapat difokuskan pada penentuan matriks yang tepat untuk penanaman tulang cmRNA guna meningkatkan regulasi kinetika pelepasan. Satu keterbatasan studi kami adalah kurangnya kelompok kontrol di mana hMSC diobati dengan urutan cmRNA non-coding acak atau dengan vektor lipid. Untuk pekerjaan kami, kami telah memilih kendaraan pengiriman nano berbasis lipid generasi pertama, yang sangat terkenal di bidang ini, dan karena itu lebih cocok untuk menilai biomaterial yang dikembangkan sebagai substrat untuk transfeksi langsung. Lipid kationik memiliki rekam jejak penggunaan yang panjang sebagai sistem pengiriman RNA, dan toksisitasnya terdokumentasi dengan baik. [ 47 ] Pengembangan mendatang untuk penerapan klinis dari pekerjaan saat ini akan mempertimbangkan penggunaan kendaraan pengiriman lain dengan toksisitas yang berkurang. Mengenai optimalisasi protokol transfeksi cmRNA, kami mengandalkan pekerjaan sebelumnya. [ 16 , 19 , 48 , 49 ]
Penelitian sebelumnya menyelidiki stabilitas cmRNA dibandingkan dengan urutan mRNA induk. mRNA yang tidak dimodifikasi diketahui menimbulkan aktivasi kuat sistem imun bawaan yang mempercepat pembusukan mRNA yang tidak dimodifikasi versus yang dimodifikasi secara in vivo. [ 50 , 51 ] Mekanisme degradasi yang dimediasi oleh imunitas bawaan ini sulit ditangkap dalam studi stabilitas siap pakai atau dengan sel dalam kultur. Kormann et al. menemukan bahwa mRNA yang dimodifikasi secara kimia jauh lebih stabil di paru-paru tikus, menunjukkan tingkat 3 hingga 6 kali lipat lebih tinggi daripada mRNA yang tidak dimodifikasi antara 8 jam dan 7 hari pasca-pemberian. [ 11 ] De La Vega et al. mendokumentasikan kinetika pembusukan yang bervariasi dari sinyal bioluminesensi setelah pemberian mRNA pengkode luciferase kunang-kunang yang dimodifikasi secara kimia melalui nanopartikel lipid dalam model tikus dengan cacat tulang femur. Sinyal bioluminesensi yang penting masih terdeteksi 27 jam pasca-pemberian. [ 17 ] Kemanjuran sistem pengiriman sangat penting bagi stabilitas in vivo mRNA yang dimodifikasi ini, dan bidang ini telah mengalami kemajuan yang signifikan. [ 50 ]
In vitro, diferensiasi osteogenik hMSC yang tidak ditransfeksi pada THA-Col menunjukkan aktivitas ALP yang secara signifikan lebih tinggi pada mikrogel dibandingkan dengan massal, yang juga dikonfirmasi dengan pewarnaan ALP yang lebih intens pada mikrogel dibandingkan dengan gel massal. hMSC yang ditransfeksi pada mikrogel menunjukkan aktivitas dan pewarnaan ALP yang berkurang dibandingkan dengan sel yang tidak ditransfeksi. Tren yang tidak signifikan dengan kandungan DNA yang lebih rendah juga diamati pada sel yang ditransfeksi, sesuai dengan pelepasan LDH sebelumnya, aktivitas metabolik, dan hasil pewarnaan Hidup/Mati. Terlepas dari transfeksi, hMSC pada THA-Col massal menunjukkan aktivitas ALP, kandungan DNA, dan pewarnaan ALP yang serupa. ALP memainkan peran penting dalam proses mineralisasi tulang baru, [ 52 ] oleh karena itu secara luas digunakan sebagai penanda khas diferensiasi osteogenik. Mengingat bahwa ALP mengalami fluktuasi inheren dari waktu ke waktu selama diferensiasi osteogenik, dan mempertimbangkan variabilitas intrinsik dalam respons biologis sel dari donor yang berbeda, percobaan kami tidak dapat membedakan antara peredaman umum atau pergeseran temporal dalam profil aktivitas ALP. Diferensiasi sel juga dianalisis dengan memeriksa tingkat ekspresi gen penanda osteogenik. Rasio RUNX2 / SOX9 pada hari ke-14 berkorelasi dengan aktivitas ALP, dengan tingkat yang lebih tinggi pada sel yang tidak ditransfeksi pada mikrogel. Namun, gen lain tidak menunjukkan tren yang jelas. Keterbatasan ini dikurangi dengan mengevaluasi penanda lain, seperti OPG. Protein terlarut ini berfungsi sebagai reseptor umpan yang mengikat ligan aktivator reseptor faktor nuklir κB (RANKL), yang menghambat diferensiasi osteoklas dan memainkan peran penting dalam regulasi kepadatan tulang. [ 53 , 54 ] Dalam studi osteogenesis in vitro sebelumnya, perbedaan yang jelas antara hMSC dalam medium basal atau medium diferensiasi osteogenik diamati, yang menunjukkan OPG sebagai penanda prediktif. [ 3 , 53 ] Faktanya, kelompok yang ditransfeksi dengan cmRNA BMP-7 menunjukkan OPG/DNA yang lebih tinggi dibandingkan dengan kelompok kontrol. Selain itu, OPG/DNA mengonfirmasi hasil ALP/DNA yang menunjukkan keberhasilan transfeksi pada biomaterial.
Keterbatasan dari penelitian ini adalah kurangnya kuantifikasi mineralisasi langsung untuk menilai osteogenesis. Pewarnaan Alizarin Red setelah 28 hari diferensiasi osteogenik dilakukan, namun tidak mungkin untuk membedakan secara andal deposisi mineral oleh hMSC yang terdiferensiasi dari pewarnaan latar belakang yang tidak spesifik dari matriks THA-Col (data tidak ditampilkan). Pewarnaan positif palsu dari matriks yang tidak diinkubasi sebelumnya diamati dalam penelitian lain menggunakan, misalnya, membran Col yang tersedia secara komersial. [ 55 ]
Tulang dapat sembuh melalui dua jalur berbeda, osifikasi intramembran atau endokondral. Meskipun BMP dilaporkan dapat menginduksi osifikasi endokondral secara in vivo, model in vitro yang digunakan dalam penelitian ini mengikuti proses mineralisasi langsung. [ 56 , 57 ] Oleh karena itu, kehati-hatian harus digunakan saat menerapkan hasil kami untuk penyembuhan tulang panjang atau tulang pipih secara in vivo.
Untuk percobaan kami, digunakan hMSC yang berasal dari donor sumsum tulang manusia primer. Variabilitas yang cukup besar yang diamati di antara para donor sudah diantisipasi dan umum terjadi saat menggunakan sel primer. Meskipun analisis statistik standar mungkin tidak menunjukkan tren yang signifikan, temuannya tetap relevan secara biologis. Di sisi lain, penggunaan sel primer yang berasal dari pasien secara signifikan menambah relevansi klinis dari hasil kami.
Berdasarkan kemajuan sebelumnya dalam teknologi cmRNA, pekerjaan kami memperkenalkan biomaterial cetak 3D yang memungkinkan transfeksi cmRNA BMP-7 mempertahankan tingkat aktivitas biologis yang sama dengan pra-transfeksi pada cawan, dengan perbedaan bahwa pendekatan kami dapat langsung diterapkan dengan cara invasif minimal, menghindari 2 pembedahan (pengambilan jaringan dan re-implantasi) dan transfeksi sel autologus dalam kondisi GMP. Upaya di masa depan akan fokus pada meminimalkan efek sitotoksisitas yang disebabkan oleh pelepasan mRNA yang cepat atau pemilihan pembawa transfeksi. Selain itu, kami bertujuan untuk lebih meningkatkan diferensiasi osteogenik, yang dalam penelitian ini mungkin telah terhambat oleh hilangnya sel akibat toksisitas ini. Dengan demikian, menggabungkan pendekatan alternatif untuk enkapsulasi mRNA dan penggunaan partikel kalsium fosfat osteoinduktif, [ 3 , 12 , 58 ] misalnya, dapat bekerja secara sinergis untuk meningkatkan sifat penyembuhan tulang dari mikrogel THA-Col yang memberikan cmRNA BMP7.
4 Kesimpulan
Studi ini memperkenalkan mikrogel THA-Col yang dapat dicetak 3D sebagai matriks aktif untuk mentransfeksi hMSC dengan cmRNA BMP-7 guna mendorong diferensiasi osteogenik. Mikrogel THA-Col menunjukkan viabilitas sel yang lebih tinggi dibandingkan dengan gel massal, mendukung transfeksi dengan cmRNA BMP-7, dan mendukung diferensiasi osteogenik hMSC secara in vitro. Karya ini mengonfirmasi potensi dan kegunaan teknologi cmRNA dalam regenerasi tulang, dan berkontribusi dalam pengembangan pengganti cangkok tulang khusus pasien, menuju alternatif untuk pencangkokan tulang otomatis.
5 Bagian Eksperimen
Sintesis THA
Sintesis THA dilakukan dengan menggunakan metode yang telah dijelaskan sebelumnya. [ 27 ] Singkatnya, asam hialuronat (HA, 280–290 kDa, gugus karboksilat 5 mM; Contipro Nutrihyl) difungsionalkan menggunakan amidasi 4-(4,6-dimetoksi-1,3,55-triazin-2-il)-4-mehtylmorpholinium klorida (DMTMM, TCI Eropa) bersama dengan tiramin HCl (Roth) dengan pencampuran pada rasio stoikiometri 1:1:1 selama 24 jam pada suhu 37 °C. Setelah itu, THA diendapkan dengan penambahan etanol (96% v/v) tetes demi tetes ke dalam larutan. THA disaring menggunakan penyaring Gooch no. 2, dan akhirnya bubuk dikeringkan dalam vakum. Tingkat substitusi THA adalah ≈6%, diukur dengan pembacaan absorbansi pada 275 nm (pembaca mikroplat Infinite® 200 PRO, TECAN) terhadap kurva kalibrasi tyramine HCl. Spektrum resonansi magnetik nuklir (NMR) proton diperoleh pada Bruker Avance III 300 MHz menggunakan deuterium oksida sebagai pelarut; tata letak grafis spektrum diproduksi dengan NMRium (Gambar S1 , Informasi Pendukung).
Persiapan THA-Col Massal dan Mikrogel
Hidrogel THA-Col disiapkan dengan merekonstitusi THA hingga mencapai konsentrasi akhir 17,5 mg mL −1 dalam larutan penyangga fosfat (PBS) pada suhu 4 °C dengan rotasi. THA terlarut kemudian disterilkan dengan panas selama 20 menit pada suhu 121 °C. THA yang telah disterilkan dicampur dengan 0,1 U mL −1 horseradish peroxidase (HRP), 0,37 mm Ruthenium tris(2,2-bipyridyl)dichlororuthenium(II) hexahydrate (Ru), 5 mm Sodium Persulfate (SPS), dan Col pada konsentrasi akhir 2,5 mg mL −1 (kolagen ekor tikus tipe I dalam asam asetat 0,2 N, Corning). Campuran cairan THA-Col kemudian dinetralkan dengan penambahan 6 m m natrium hidroksida (NaOH, Roth) dan diikat silang secara enzimatis dengan penambahan 0,17 m m hidrogen peroksida (H 2 O 2 , Sigma–Adrich). Selanjutnya, untuk gel massal, 100 µL larutan hidrogel dituang ke dalam pelat 96 sumur, sedangkan untuk mikrogel, larutan disimpan dalam spuit. Dalam kedua kasus, sampel dibiarkan terikat silang dengan menginkubasi selama 60 menit pada suhu 37 °C. Untuk menyiapkan mikrogel, THA-Col yang diikat silang secara enzimatis dilewatkan tiga kali melalui saringan sel dengan ukuran pori membran 100 µm (Falcon) menurut metode yang dijelaskan sebelumnya. [ 41 ] Mikrogel kemudian ditambahkan ke pelat 96 sumur, dengan volume 100 µL per sumur. Massal dan mikrogel sepenuhnya diikat silang dengan paparan cahaya (456 nm) selama 3 menit (LED IP FL-30 SMD biru, 30W, 100–240 V AC, 50/60 Hz, Eurolit).
Pencetakan 3D Mikrogel THA-Col
Untuk pencetakan 3D, mikrogel yang tidak terikat silang cahaya dipindahkan ke dalam 3 kartrid CC (Nordson). Tinta kemudian dicetak 3D dengan printer 3D berbasis ekstrusi (3D Discovery™, RegenHU) menggunakan jarum silinder 22 G dengan diameter dalam 0,41 mm (Nordson EFD), dengan tekanan yang ditetapkan pada 1,6 bar, dan kecepatan tulis 4 mm s −1 dengan ikatan silang cahaya berikutnya (456 nm) selama 3 menit (LED IP FL-30 SMD biru, 30 W, 100–240 V AC, 50/60 Hz, Eurolit). Kemampuan cetak dinilai berdasarkan penyebaran dan keseragaman filamen, fusi filamen, geometri pori, dan filamen yang menjorok ke pilar. [ 59 ]
Penyebaran dan keseragaman filamen dievaluasi dengan mencetak 3D satu filamen dengan panjang 60 mm. Rasio penyebaran filamen kemudian dinilai menggunakan ImageJ dengan mengukur diameter filamen di tiga lokasi berbeda (¼, ½, dan ¾ dari panjang filamen) dari untaian yang diekstrusi dan menormalkannya ke diameter jarum bagian dalam. Rasio keseragaman filamen diukur menggunakan ImageJ dengan menguraikan untaian yang diekstrusi secara manual di bagian atas dan bawah dan mengukur panjangnya. Nilai ini dinormalisasi dengan panjang garis lurus sempurna. Nilai 1,0 menunjukkan keseragaman maksimum, sedangkan nilai yang lebih tinggi menunjukkan keseragaman yang lebih rendah. [ 60 ]
Penggabungan filamen dievaluasi dengan mencetak filamen paralel secara 3D dalam pola berkelok-kelok dengan jarak filamen yang semakin mengecil (7, 5, 4, 3, 2, 1, dan 0 mm). Panjang segmen yang menyatu (fs ) kemudian diukur menggunakan ImageJ untuk jarak filamen sekecil mungkin yang tidak menyebabkan penggabungan filamen.
Geometri pori dianalisis dengan mengekstruksi struktur grid 1 lapis berukuran 9 × 9 × 0,41 mm (panjang × lebar × tinggi), di mana pori-pori cetak 3D dievaluasi bentuknya dengan mengukur indeks kemampuan cetak (P r ). Nilai P r dihitung menggunakan rumus: P r = (L 2 ) / (16 x A). Di sini, L merepresentasikan perimeter internal dan A mengindikasikan area internal setiap pori. [ 61 ] Nilai P r sebesar 1 akan menunjukkan bentuk persegi sempurna, sedangkan nilai P r < 1 akan menunjukkan pori-pori yang terlalu melingkar, dan nilai P r > 1 akan menunjukkan bentuk pori yang tidak beraturan.
Untuk filamen yang menjorok, filamen tunggal dicetak 3D di atas struktur pilar dengan peningkatan ukuran celah (1, 2, dan 6 mm).
Karakterisasi Matriks Massal dan Mikrogel THA-Col—Karakterisasi Reologi
Karakterisasi reologi dilakukan menggunakan rheometer Anton Paar MCR-302 (Anton Paar GmbH) yang dilengkapi dengan perangkat kontrol suhu Peltier. Semua pengujian pada sampel THA massal atau mikrogel ( n = 3) dilakukan menggunakan geometri pelat-ke-pelat (PP-25 Probe, diameter 25 mm), dengan ukuran celah 0,1 mm untuk massal dan 1,1 mm untuk mikrogel, dan gaya normal 0,1 N. Semua pengukuran dilakukan pada suhu 20 °C, dan minyak silikon (Sigma-Aldrich) dioleskan ke tepi luar untuk mencegah pengeringan gel selama pengukuran.
Sapuan regangan osilasi dilakukan menggunakan regangan antara 0,01% hingga 1000%, dengan frekuensi sudut 1 Hz.
Viskositas dinilai menggunakan laju geser antara 0,01 hingga 100 1/s untuk mengevaluasi sifat viskoelastis dan pengenceran geser dari mikrogel THA-Col.
Pemulihan elastis mikrogel THA-Col dianalisis dengan memaparkannya pada siklus bergantian rendah (regangan 1%) dan tinggi (regangan 500%), dengan frekuensi sudut 1 Hz.
Karakterisasi Matriks Massal dan Mikrogel THA-Col—Pembengkakan
THA-Col curah dan mikrogel yang tidak dikeringkan beku dinilai untuk pembengkakan. Baik curah maupun mikrogel dicetak dalam cetakan polidimetilsiloksan (PDMS) dengan diameter 6 mm dan ketebalan 3 mm ( n = 6). Curah dan mikrogel dipindahkan ke dalam larutan PBS untuk memungkinkan pembengkakan pada suhu 37 °C. Menggunakan neraca elektronik, curah atau mikrogel ditimbang pada waktu yang ditentukan (0, 2, 4, 6, 24, dan 48 jam). Rasio pembengkakan curah dan mikrogel pada titik waktu tertentu ditentukan menggunakan rumus berikut: Rasio pembengkakan (%) = (Berat t x / berat t 0 ) x 100.
Karakterisasi Matriks Massal dan Mikrogel THA-Col—Degradasi
Massal dan mikrogel disiapkan dalam cetakan PDMS dengan diameter 6 mm dan ketebalan 3 mm ( n = 6 masing-masing) dan dibiarkan membengkak dalam PBS selama 24 jam pada suhu 37 °C. Baik bulk maupun mikrogel kemudian dipindahkan ke 100 U mL −1 hialuronidase dalam larutan PBS dan diinkubasi pada suhu 37 °C untuk degradasi. Sampel ditimbang pada waktu yang ditentukan (0, 2, 4, 6, 24, dan 48 jam) menggunakan neraca elektronik. Degradasi bulk dan mikrogel pada titik waktu yang berbeda dihitung menggunakan rumus berikut: degradasi (%) = 1 – (Berat t x / berat t 0 ) × 100.
Karakterisasi Matriks Massal dan Mikrogel THA-Col—Kompresi
Massal dan mikrogel dicetak dalam cetakan PDMS dengan diameter 6 mm dan ketebalan 3 mm ( n = 6 masing-masing) dan diinkubasi dalam PBS selama 24 jam pada suhu 37 °C untuk memungkinkan terjadinya pembengkakan sebelum pengujian mekanis menggunakan LTM 1 (ZwickRoell). Massal dan mikrogel diuji di bawah kompresi uniaxial tanpa batas menggunakan beban awal 0,25 N dan kecepatan 1%/detik. Modulus kompresi dihitung dari kurva tegangan-regangan sebagai kemiringan daerah linier antara 0 dan 10% regangan.
Kultur Sel—Sel L929
Sel fibroblas tikus L929 (Sigma–Aldrich) dikultur dalam medium basal yang terdiri dari Medium Dulbecco’s Modified Eagle (LG-DMEM, Gibco) glukosa rendah (1 g L −1 ) yang disuplemen dengan 10% v/v serum fetal bovin (FBS, Corning), dan 1% v/v Pen-Strep (konsentrasi akhir 100 U mL −1 penisilin, 100 µg mL −1 streptomisin, Gibco) pada suhu 37 °C dalam atmosfer 5% CO 2 dan kelembapan 90%. Medium kultur sel diganti setiap dua hari. Untuk semua percobaan kultur sel yang melibatkan sel L929, sel pada passage 19 digunakan.
Kultur Sel—Isolasi dan Ekspansi Sel Stroma Mesenkimal Manusia
Aspirasi sumsum tulang dari tiga donor perempuan berusia antara 52 dan 82 tahun digunakan untuk mengisolasi hMSC, seperti yang dijelaskan dalam penelitian sebelumnya. [ 62 ] Aspirasi diperoleh dari pasien yang menjalani operasi ortopedi di Inselspital Bern (Klarifikasi Tanggung Jawab Req-2023-00198). Undang-Undang Penelitian Manusia Swiss tidak berlaku untuk penelitian yang melibatkan materi biologis anonim dan/atau data terkait kesehatan yang dikumpulkan secara anonim atau anonim. Persetujuan Umum, yang juga mencakup anonimisasi data terkait kesehatan dan materi biologis, diperoleh dari semua donor.
Setelah diisolasi, hMSC dibekukan pada tahap 1 dan setelah dicairkan, mengembang dalam modifikasi alfa Media Esensial Minimal (α-MEM, Gibco) yang dilengkapi dengan 10% v/v FBS (Corning), 1% v/v Pen-Strep (100 U mL −1 penisilin, 100 µg mL −1 streptomisin, Gibco) dan 5 ng mL −1 faktor pertumbuhan fibroblast dasar (bFGF, Fitzgerald Industries International) pada suhu 37 °C dalam atmosfer dengan 5% CO 2 dan kelembapan 90%. Media diganti setiap dua hari. hMSC pada tahap 3 digunakan untuk semua percobaan.
Kultur Sel—Toksisitas Tidak Langsung In Vitro
Studi toksisitas tidak langsung dilakukan dengan mengikuti panduan ISO-10993-5. [ 63 ] 100 µL THA-Col curah dan mikrogel dalam pelat 96-sumur diinkubasi dengan 200 µL medium basal selama 24 jam pada suhu 37 °C. Medium saja, tanpa THA-Col, diinkubasi dalam kondisi yang identik untuk berfungsi sebagai kontrol negatif dan medium yang disuplemen dengan 0,1% Triton X-100 (Sigma–Aldrich) sebagai kontrol positif kematian sel. Sel-sel L929 disemai dalam pelat 96-sumur pada kepadatan penyemaian sel 10.000 sel cm −2 dan dibiarkan selama 24 jam untuk menempel ( n = 4). Setelah 24 jam inkubasi THA-Col curah dan mikrogel dengan medium, medium terkondisi ini diekstraksi dari gel dan digunakan untuk mengganti medium sel-sel L929 yang menempel. Sel L929 dikulturkan dengan medium terkondisi selama 24 jam lebih lanjut dan kemudian dinilai berdasarkan proliferasi dan viabilitas sel.
Kuantifikasi Aktivitas Metabolisme: Aktivitas metabolisme sel L929 (CellTiter-Blue®, Promega) dinilai menurut petunjuk pabrik pembuatnya. Singkatnya, sel diinkubasi selama 2 jam pada suhu 37 °C dan 5% CO2 dengan pengenceran CellTiter-Blue® 1:5 dalam medium basal. Fluoresensi reagen CellTiter-Blue® dalam medium dinilai menggunakan pembaca mikroplat (pembaca mikroplat Infinite® 200 PRO, TECAN), dengan panjang gelombang eksitasi 560 nm dan panjang gelombang emisi 590 nm.
Kuantifikasi Kandungan DNA: Sel L929 dilisiskan menggunakan 0,1% v/v Triton X-100 (Sigma–Aldrich) dalam 10 m m TrisHCl. Kandungan DNA kemudian dinilai dalam duplikat menggunakan uji kuantifikasi DNA (CyQUANT™ Assay, ThermoFisher) mengikuti petunjuk pabrik. Fluoresensi diukur menggunakan pembaca mikroplat (pembaca mikroplat Infinite® 200 PRO, TECAN) dengan panjang gelombang eksitasi 480 nm dan panjang gelombang emisi 520 nm.
Pewarnaan Hidup/Mati: Viabilitas sel L929 dievaluasi dengan pewarnaan Hidup/Mati. Setelah dicuci satu kali dengan PBS, sel diinkubasi dalam LG-DMEM yang mengandung 1 µ m calcein-AM (Sigma–Aldrich) dan 1 µ m ethidium homodimer-1 (Sigma–Aldrich) selama 30 menit pada suhu 37 °C. Setelah dicuci lebih lanjut, sel dipertahankan dalam LG-DMEM untuk pencitraan confocal (LSM800, Carl Zeiss). Sel mati, terlihat dalam warna merah, diwarnai dengan ethidium homodimer-1 (λex = 561 nm), sedangkan sitoplasma sel hidup, terlihat dalam warna hijau, diwarnai dengan calcein AM (λex = 488 nm).
Kuantifikasi Pelepasan LDH: Media terkondisi dari sel L929 dikumpulkan dan digunakan untuk pengukuran laktat dehidrogenase (LDH) (Cytotoxicity Detection Kit PLUS , Roche) mengikuti petunjuk pabrik pembuatnya. Nilai absorbansi sampel dalam duplikat diukur pada 490 nm menggunakan pembaca pelat (pembaca pelat mikro Infinite® 200 PRO, TECAN). Persentase pelepasan LDH dihitung dengan menormalkan nilai absorbansi dari sampel massal atau mikrogel THA-Col ke kontrol positif.
Kultur Sel—Transfeksi In Vitro hMSC dengan Kombinasi THA-Col Bulk atau Microgel dan BMP-7 cmRNA
THA-Col bulk dan microgel disiapkan seperti yang dijelaskan sebelumnya dengan 100 µL gel per sumur dalam pelat 96 sumur. Lipoplex cmRNA BMP-7 dibentuk dengan mencampurkan 1 µg µL −1 larutan cmRNA (Ethris GmbH) dan Lipofectamine MessengerMAX (Invitrogen) dalam rasio 1:1 dan diinkubasi selama 20 menit pada suhu ruangan. Bulk atau microgel kemudian disemai dengan 50.000 hMSC/gel ( n = 3 donor, dengan masing-masing dua replikasi) dan dibiarkan selama 30 menit dalam inkubator. Selanjutnya, untuk transfeksi, 1,56 pg BMP-7 atau MetLuc cmRNA/sel ditambahkan. Setelah 30 menit dalam inkubator, media transfeksi yang terdiri dari Opti-MEM (Gibco), 2% v/v FBS (Corning), dan 1% v/v Pen-Strep (100 U mL −1 penisilin, 100 µg mL −1 streptomisin, Gibco) ditambahkan untuk mencapai volume akhir 200 µL. Sebagai kontrol positif, hMSC ditransfeksi terlebih dahulu (50.000 sel per gel dengan 1,56 pg cmRNA/sel) dalam suspensi selama 20 menit pada suhu ruangan dan selanjutnya ditambahkan ke gel. Setelah 1 jam dalam inkubator, media transfeksi ditambahkan untuk mencapai volume 200 µL. Sebagai kontrol negatif (tidak ditransfeksi), hanya hMSC (50.000 sel per gel) yang ditambahkan tanpa cmRNA. Dalam penelitian ini, kelompok berikut dinilai untuk setiap THA-Col massal dan mikrogel: kontrol negatif, kontrol positif, dan hMSC yang ditransfeksi pada gel dengan aktivitas MetLuc (untuk cmRNA MetLuc), sitotoksisitas, produksi BMP-7 (untuk cmRNA BMP-7), dan diferensiasi osteogenik.
Aktivitas MetLuc: Supernatan dari sel yang ditransfeksi dengan cmRNA MetLuc, yang mengandung MetLuc yang disekresikan, dikumpulkan pada hari ke-1, ke-3, dan ke-7 setelah transfeksi, dan disimpan pada suhu -80 °C untuk analisis selanjutnya. Untuk menilai aktivitas metridia luciferase, 50 µL supernatan ditambahkan ke 50 µL coelenterazine asli (50 µm dalam buffer natrium fosfat yang telah didegaskan, pH 7,0; Synchem), sebagai substrat dan mengikuti protokol standar. [ 64 ] Luminesensi segera diukur pada 480 nm pada suhu ruangan menggunakan pembaca plat CLARIOSTAR (BMG Labtech).
Sitotoksisitas Transfeksi cmRNA: Untuk menilai sitokompatibilitas matriks cmRNA-teraktivasi BMP-7 pada hMSC, aktivitas metabolisme pada hari ke-7, pelepasan LDH pada hari ke-1, ke-3, dan ke-7, dan viabilitas sel dinilai menurut protokol yang dijelaskan dalam paragraf 2.5.3.1, 2.5.3.3, dan 2.5.3.4.
Kuantifikasi Produksi BMP-7: Sekresi BMP-7 oleh hMSC yang ditransfeksi dengan cmRNA BMP7 pada THA-Col massal dan mikrogel pada hari ke-1, ke-3, dan ke-7 ditentukan melalui ELISA (Sistem R&D) sesuai dengan protokol pabrikan.
Kultur Sel—Diferensiasi Osteogenik In Vitro
Diferensiasi osteogenik in vitro dilakukan pada THA-Col bulk dan microgel seperti yang dijelaskan dalam paragraf 2.5.4 ( n = 3 donor, dengan masing-masing dua replikasi). Setelah 24 jam inkubasi, medium transfeksi diubah menjadi medium osteogenik yang terdiri dari Opti-MEM (Gibco), 2% v/v FBS (Corning), 1% v/v Pen-Strep (100 U mL −1 penisilin, 100 µg mL −1 streptomisin, Gibco), 50 µg mL −1 L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate (AA2P, Sigma), dan 10 m m beta-gliserol fosfat (BGP, Sigma). Medium osteogenik dalam penelitian ini tidak mengandung deksametason. Medium diganti dua kali seminggu.
Pewarnaan ALP, Kuantifikasi Aktivitas ALP, dan Kandungan DNA: Aktivitas alkali fosfatase (ALP) dianalisis pada 14 hari setelah transfeksi cmRNA dan kultur dalam kondisi osteogenik. hMSC pada gel THA-Col difiksasi menggunakan 70% metanol dingin selama 15 menit pada suhu 4 °C dan diwarnai untuk aktivitas ALP (Leukocyte Alkaline Phosphatase Kit, Sigma–Aldrich) menggunakan naftol AS-MX fosfat dan garam RR biru cepat (Sigma–Aldrich) mengikuti petunjuk pabrik.
Aktivitas ALP juga dinilai dalam lisat sel. Pertama, sel dilisiskan dengan 0,1% v/v Triton X-100 (Sigma–Aldrich) dalam 10 m m TrisHCl. Aktivitas ALP kemudian diukur dengan menambahkan larutan penyangga alkali, larutan substrat (25 mg mL −1 substrat fosfat dalam 1 m m penyangga dietanolamina yang mengandung 0,5 m m MgCl2, pH 9,8, Sigma–Aldrich) dan air deionisasi ke dalam lisat sel, diikuti dengan inkubasi pada suhu 37 °C selama 15 menit. Setelah 15 menit, reaksi dihentikan dengan penambahan larutan NaOH 0,1 m dan nilai absorbansi sampel dan kurva standar ALP dibaca pada 405 nm menggunakan pembaca pelat (pembaca mikropelat Infinite® 200 PRO, TECAN). Aktivitas ALP dinormalisasi terhadap kandungan DNA, yang diukur menurut metode yang dijelaskan dalam paragraf “Kuantifikasi Produksi OPG.”
Kuantifikasi Produksi OPG: Sekresi osteoprotegerin (OPG) dianalisis dengan ELISA (R&D Systems) mengikuti protokol pabrik pembuatnya. OPG diukur dalam media terkondisi yang dikumpulkan pada setiap perubahan media selama 28 hari diferensiasi osteogenik, dan sampel dikumpulkan bersama per minggu.
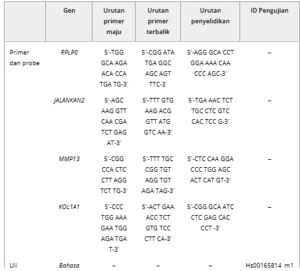
Isolasi RNA dan Reaksi Rantai Polimerase Kuantitatif-Transkripsi Balik (RT-qPCR): Isolasi RNA dilakukan pada sampel yang dikumpulkan pada hari ke-0, ke-14, dan ke-28 menggunakan TriReagent® (Molecular Research Center Inc.) mengikuti protokol pabrik pembuatnya. Kuantitas dan kualitas RNA yang diisolasi diukur menggunakan spektrofotometer UV-Vis (NanoDrop One, Thermo Fisher). Sebanyak 0,25 µg RNA total digunakan untuk mensintesis cDNA dengan SuperScript™ VILO™ cDNA Synthesis Kit (Invitrogen) sesuai dengan petunjuk pabrik pembuat pada termosikler Mastercycler Gradient (Eppendorf). Untuk melakukan RT-qPCR, 10 µl campuran reaksi yang mengandung 5 µl TaqMan Gene Expression Master Mix (Thermo Fisher), primer dan probe (konsentrasi akhir forward dan reverse primer: 900 nm ; konsentrasi akhir TaqMan probe: 250 nm ) , air dietilpirokarbonat (DEPC), dan cDNA (5 ng) dimuat per sumur dalam pelat 384 sumur. Program PCR standar digunakan yang terdiri dari pemanasan awal 2 menit hingga 50 °C, 10 menit pada 95 °C untuk aktivasi polimerase dan 40 siklus bergantian 95 °C selama 15 detik dan 60 °C selama 1 menit untuk denaturasi dan annealing. Ekspresi gen relatif dihitung dalam duplikat setiap donor dengan menerapkan metode 2 −ΔCq dengan RPLP0 sebagai gen referensi dan normalisasi ke hMSC hari ke-0 sebelum penyemaian. Ekspresi gen berikut dievaluasi: RUNX2 , SOX9 , ALPL , IBSP , SPP1 , MMP13 , COL1A1 . ID uji TaqMan Gene Expression Assays (Thermo Fisher) dan urutan gen primer dan probe tercantum dalam Tabel 1 .
Tabel 1. Urutan primer dan probe (urutan maju, mundur, dan probe) dan ID uji TaqMan Gene Expression Assays (ID Uji Applied Biosystem) untuk analisis ekspresi gen. Probe untuk RPLP0 , RUNX2 , MMP13 , dan COL1A1 dimodifikasi dengan FAM pada 5′ dan TAMRA pada 3′. Probe dalam TaqMan Gene Expression Assays dikonjugasikan dengan FAM pada 5′ dan NFQ-MGB pada 3′.
Analisis Statistik
Hasil dinyatakan sebagai rata-rata ± simpangan baku. Analisis perbedaan antar kelompok dilakukan menggunakan ANOVA satu arah dengan koreksi Šidák (untuk satu titik waktu) atau ANOVA dua arah dengan uji perbandingan berganda Tukey (untuk dua titik waktu atau lebih). Hasil yang disajikan diperoleh dari percobaan yang diulang setidaknya tiga kali, menggunakan donor yang berbeda setiap kali. Semua analisis statistik dilakukan menggunakan GraphPad Prism 8 (GraphPad Software Inc.). Tanda bintang menunjukkan signifikansi statistik sebagai berikut: ∗ p < 0,05, ∗∗ p < 0,01, ∗∗∗ p < 0,001, ∗∗∗∗ p < 0,0001, dan ns = tidak signifikansi.