PEG Hidrogel yang Ditentukan Secara Mekanis dan Kimiawi Meningkatkan Reproduktifitas dalam Perkembangan Kardioid Manusia
Abstrak
Kardioid adalah organoid jantung 3D yang terorganisasi sendiri yang berasal langsung dari agregat sel punca pluripoten terinduksi (hiPSC). Pertumbuhan dan kultur kardioid dilakukan dalam kultur suspensi atau sangat bergantung pada enkapsulasi Matrigel. Meskipun ada kemajuan signifikan dalam teknologi kardioid, reproduktifitas tetap menjadi tantangan utama, yang membatasi penggunaannya secara luas baik dalam penelitian dasar maupun aplikasi translasi. Di sini, untuk pertama kalinya, kami menggunakan hidrogel sintetis berbasis polietilen glikol (PEG) yang dapat didegradasi oleh metaloproteinase matriks (MMP) untuk menentukan efek isyarat mekanis dan biokimia pada perkembangan kardioid. Diferensiasi jantung yang berhasil ditunjukkan dalam semua kondisi hidrogel, sementara kardioid yang dikultur dalam hidrogel PEG yang dioptimalkan (3 wt.% PEG-2mM RGD) mengalami perkembangan morfologi yang sama dan fungsi jaringan yang sebanding dengan yang dikultur dalam Matrigel. Kekakuan matriks dan motif adhesi sel memainkan peran penting dalam perkembangan kardioid, pembentukan ruang baru, fisiologi kontraktil, dan pengayaan gen sel endotel. Yang lebih penting, hidrogel sintetis meningkatkan reproduktifitas dalam sifat kardioid dibandingkan dengan kultur suspensi tradisional dan enkapsulasi Matrigel. Oleh karena itu, hidrogel berbasis PEG berpotensi digunakan sebagai alternatif Matrigel untuk kultur kardioid manusia dalam berbagai aplikasi klinis termasuk terapi sel dan rekayasa jaringan.
1 Pendahuluan
Penyakit kardiovaskular (PKV) tetap menjadi penyebab kematian utama secara global. [ 1 ] Memajukan model jantung manusia 3D in vitro sangat penting untuk memahami PKV dan mengembangkan strategi terapi baru. Kardioid, yang berasal langsung dari agregat sel punca pluripoten manusia (hPSC), biasanya dihasilkan dan dikultur dalam pelat perlekatan ultralow dengan dasar bulat. [ 2 , 3 ] Struktur yang terorganisasi sendiri ini merangkum aspek-aspek penting dari perkembangan dan fungsi jantung awal, termasuk pembentukan ruang yang baru lahir—keuntungan dibandingkan model jantung rekayasa lainnya. [ 2 – 6 ] Namun, sebagian besar metode pembuatan kardioid tidak memiliki perancah biomaterial atau isyarat mekanis eksternal untuk mengarahkan diferensiasi dan perkembangan jaringan, sehingga membatasi reproduktifitas pembentukan organoid. Hingga saat ini, hanya satu penelitian yang melaporkan keberhasilan pembuatan kardioid dengan menanamkan agregat hPSC dalam Matrigel, matriks yang diekstraksi dari sarkoma tikus Engelbreth–Holm–Swarm. [ 3 ] Namun, Matrigel telah dilaporkan memiliki variabilitas antar-batch yang tinggi dan adanya kontaminan xenogenik, yang menyebabkan hasil eksperimen tidak konsisten dan reproduktifitas yang buruk di seluruh penelitian. [ 7 – 10 ] Oleh karena itu, ada kebutuhan yang semakin meningkat untuk mengembangkan biomaterial sintetis alternatif untuk mendukung pengembangan kardioid yang kuat dan dapat direproduksi baik untuk penelitian dasar maupun aplikasi terapeutik.
Polietilen glikol (PEG) adalah biomaterial sintetis yang banyak digunakan untuk kultur organoid, mendukung perkembangan organoid usus, tabung saraf, hati, dan serebelum. [ 11 – 18 ] Hidrogel PEG fungsionalisasi RGD dengan modulus elastisitas di bawah 100 Pa telah menunjukkan viabilitas organoid yang sebanding dengan Matrigel. [ 13 ] Selain berfungsi sebagai alternatif Matrigel, hidrogel sintetis menawarkan ceruk biokimia dan biofisika yang lebih tepat untuk memodulasi pertumbuhan dan fungsi organoid. [ 19 – 25 ] Misalnya, matriks berbasis PEG yang kaku mempertahankan kelangsungan hidup dan proliferasi sel induk usus yang tidak berdiferensiasi, sedangkan matriks lunak mendorong diferensiasinya menjadi organoid usus fungsional. [ 20 ] Selain itu, fungsionalisasi hidrogel PEG 8-lengan dengan ligan pengikat integrin seperti peptida peniru kolagen GFOGER telah terbukti mendukung pertumbuhan dan pembentukan organoid usus dan endometrium manusia. [ 26 ] Temuan ini menyoroti sifat-sifat hidrogel sintetis yang dapat disesuaikan, yang dapat dimanfaatkan untuk meningkatkan reproduktifitas dan fungsionalitas sistem organoid. Namun, hanya sedikit penelitian yang menggunakan hidrogel PEG dan kardiomiosit turunan iPSC yang telah didiferensiasi sebelumnya (iPSC-CM) untuk menghasilkan jaringan jantung yang direkayasa, [ 27 – 29 ] dan belum ada penelitian yang melaporkan pengembangan dan kultur kardioid dalam hidrogel sintetis.
Dalam penelitian ini, kami mengembangkan sistem hidrogel berbasis PEG yang dapat didegradasi oleh metaloproteinase matriks (MMP) dan dapat disetel untuk kultur kardioid. Kami menyelidiki secara sistematis bagaimana isyarat matriks, termasuk fungsionalisasi RGD dan sifat mekanis, memengaruhi pembentukan dan fungsi kardioid. Temuan kami mengungkapkan perbedaan signifikan dalam morfologi, fungsi kontraktil, dan profil transkriptomik di antara kardioid yang dikultur dalam hidrogel dengan berbagai sifat. Khususnya, penggabungan RGD dalam hidrogel PEG secara signifikan memperkaya ekspresi gen yang terkait dengan perkembangan jantung dan pembuluh darah dibandingkan dengan kardioid yang tumbuh dalam sistem bebas perancah atau hidrogel PEG tanpa RGD. Yang lebih penting, kami menunjukkan keunggulan hidrogel sintetis yang berbeda dibandingkan metode bebas perancah dan berbasis Matrigel, khususnya dalam hal reproduktifitas. Sistem hidrogel sintetis yang terdefinisi dengan baik meningkatkan konsistensi organoid, menjadikannya sebagai alternatif yang andal untuk matriks yang berasal dari hewan seperti Matrigel. Reproduktifitas yang ditingkatkan ini tidak hanya memperkuat keandalan eksperimental tetapi juga memperluas potensi aplikasi kardioid dalam penelitian dasar dan studi translasi.
2 Hasil
2.1 Karakterisasi Hidrogel PEG
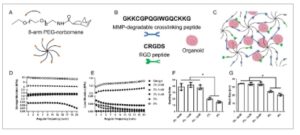
Hidrogel PEG dibentuk menggunakan makromer PEG yang difungsikan dengan norbornena dan pengikat silang peptida yang dapat didegradasi oleh MMP bis-sistein yang mengandung urutan GPQGIWGQ, yang dapat dibelah oleh kardiomiosit dan sel endotel yang mensekresi MMP ( Gambar 1A–C ). [ 30 – 33 ] Hidrogel dibuat pada tiga konsentrasi berbeda (3, 5, dan 8 wt.%) dengan modulus elastisitas yang dapat disetel serta peptida pengikat sel RGD pada konsentrasi 1 dan 2 mM. Analisis reologi dari formulasi ini menunjukkan bahwa konsentrasi polimer awal memiliki efek signifikan pada kekakuan hidrogel. Modulus penyimpanan (G′) dari hidrogel 3 wt.% tetap konsisten ≈1,3 kPa dengan atau tanpa RGD. Modulus meningkat menjadi 4,7 dan 11,9 kPa masing-masing pada hidrogel 5 dan 8 wt.%. Sebagai perbandingan, Matrigel memiliki modulus penyimpanan ≈25 Pa, yang secara signifikan lebih rendah daripada semua kelompok hidrogel PEG (Gambar 1D ). Kami mencoba untuk lebih mengurangi kekakuan hidrogel dengan mengurangi konsentrasi PEG menjadi 2 wt.%, tetapi hidrogel yang dihasilkan terlalu lunak untuk ditangani. Modulus kehilangan (G″) tidak berubah secara jelas selama sapuan frekuensi, yang menunjukkan bahwa hidrogel ini terutama elastis (Gambar 1E ). Selain itu, rasio pembengkakan hidrogel meningkat dengan penurunan konsentrasi PEG (Gambar 1F ). Ukuran mata jaring, yang merupakan perkiraan jarak antara rantai polimer, juga menunjukkan tren yang sama dengan rasio pembengkakan. Hidrogel lunak menunjukkan rasio pembengkakan yang lebih tinggi dan ukuran mata jaring yang lebih besar (Gambar 1G ), yang menunjukkan sifat difusif yang lebih baik daripada hidrogel yang lebih kaku. [ 34 ]
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Hidrogel PEG dengan peptida sintetis mereplikasi isyarat ECM utama. A) Representasi skematis komposisi hidrogel menggunakan makromer PEG-norbornena 8-lengan. B) Jaringan hidrogel yang menggabungkan peptida yang dapat terdegradasi MMP (biru) sebagai pengikat silang dan peptida RGD (hijau) untuk adhesi sel. C) Proses polimerisasi hidrogel menggunakan foto-inisiator LAP dan sinar ultraviolet (UV) gelombang panjang (≈5 mW cm − 2 , 365 nm, 3 menit) untuk enkapsulasi kardioid. D) Modulus penyimpanan dan E) modulus kehilangan hidrogel berbasis PEG. F) Rasio pembengkakan dan G) perhitungan ukuran mata jaring hidrogel. Analisis statistik dilakukan menggunakan ANOVA satu arah dengan koreksi post-hoc Tukey (* p < 0,05, n = 3).
Untuk memvalidasi reproduktifitas hidrogel PEG, kami membuat hidrogel baru dan mengukur modulus penyimpanannya menggunakan rheometer. Dengan membandingkan hasil reologi dari hidrogel yang baru dibuat dengan yang telah dibuat sebelumnya, kami tidak menemukan perbedaan signifikan dalam modulus antara hidrogel yang dibuat pada batch yang berbeda, yang menunjukkan pengulangan dan reproduktifitas yang konsisten (Gambar S2A,B , Informasi Pendukung). Selain itu, kami menilai efisiensi reaksi norbornena PEG 8-lengan dan peptida dithiol menggunakan analisis kolorimetri dari thiol yang tidak bereaksi dengan reagen Ellman. Hasil penelitian menunjukkan bahwa 97,07% gugus thiol (-SH) dikonsumsi selama pembentukan gel, yang menunjukkan efisiensi reaksi yang tinggi (Gambar S2B , Informasi Pendukung). Laju konversi yang tinggi ini memastikan pembuatan hidrogel yang konsisten dan dapat direproduksi.
2.2 Kekakuan Hidrogel Mempengaruhi Viabilitas dan Morfologi Kardioid
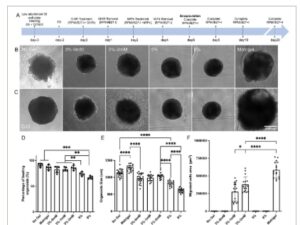
Untuk menghasilkan kardioid, agregat hiPSC pertama kali dibentuk melalui perakitan sendiri hiPSC dalam pelat 96-sumur dengan dasar bulat dan perlekatan sangat rendah (Gambar S3A–C , Informasi Pendukung). Agregat hiPSC mempertahankan pluripotensinya, seperti yang dikonfirmasi oleh imunofluoresensi positif OCT4, NANOG, dan SOX2 (Gambar S4A , Informasi Pendukung). Kami menemukan bahwa kepadatan penyemaian sel secara signifikan memengaruhi ukuran agregat (Gambar S3D , Informasi Pendukung). Agregat dikultur dalam medium E8 selama 2 hari sebelum diferensiasi menjadi kardioid mengikuti protokol yang kami tetapkan ( Gambar 2A ). [ 35 , 36 ] Selama diferensiasi, penanda mesoderm BRA diekspresikan secara positif setelah pengobatan CHIR99021 (Hari 1), sementara NANOG dan OCT4 diturunkan regulasinya (Gambar S4B , Informasi Pendukung). Pada Hari ke-8, kardioid menunjukkan pewarnaan positif untuk penanda progenitor jantung ISL1, diikuti oleh ekspresi NKX2.5 dan GATA4 pada Hari ke-10, yang mengonfirmasi diferensiasi jantung yang efisien (Gambar S4C , Informasi Pendukung). Pada hari ke-16, perilaku pemukulan direkam dan dianalisis, tidak mengungkapkan perbedaan signifikan dalam laju pemukulan (Gambar S3E , Informasi Pendukung). Namun, persentase organoid pemukulan yang lebih tinggi diamati dalam agregat yang lebih besar (10.000 sel per sumur) dibandingkan dengan yang terbentuk dengan 3.000 atau 5.000 sel per sumur (Gambar S3F , Informasi Pendukung). Berdasarkan temuan ini, kepadatan penyemaian 10.000 sel per sumur dipilih untuk penelitian selanjutnya.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Dampak sifat hidrogel pada viabilitas dan perilaku pertumbuhan kardioid. A) Garis waktu enkapsulasi dan diferensiasi kardioid. Gambar kontras fase kardioid yang dienkapsulasi dalam hidrogel berbeda pada B) hari ke-10 dan C) hari ke-20. D) Persentase organoid yang berdetak dalam kondisi kultur berbeda, yang menunjukkan kemanjuran diferensiasi jantung. Perbandingan E) ukuran organoid dan F) migrasi sel keluar di berbagai kondisi kultur. Matrigel menghasilkan organoid terbesar dan migrasi sel tertinggi, sementara peningkatan kekakuan hidrogel mengurangi ukuran organoid dan efisiensi diferensiasi. Signifikansi statistik ditentukan menggunakan ANOVA satu arah dengan koreksi post-hoc Tukey (** p < 0,01, n ≥ 15).
Untuk mengevaluasi efek enkapsulasi hidrogel pada viabilitas kardioid, uji HIDUP/MATI dilakukan 3 hari pasca-enkapsulasi. Kardioid yang tertanam dalam hidrogel PEG 3 wt.% mempertahankan viabilitas tinggi, sebanding dengan yang dienkapsulasi dalam Matrigel. Sebaliknya, organoid yang dienkapsulasi dalam hidrogel 5 atau 8 wt.% menunjukkan viabilitas yang berkurang saat kekakuan gel meningkat (Gambar S5 , Informasi Pendukung). Kekakuan hidrogel juga memengaruhi morfologi kardioid dan perilaku pertumbuhan (Gambar S6A , Informasi Pendukung). Ukuran organoid dibatasi oleh jaringan hidrogel PEG di sekitarnya, yang memengaruhi pertumbuhan keseluruhan (Gambar 2B,C ; Gambar S6B , Informasi Pendukung) dan persentase organoid yang berdetak pada Hari ke-20 (Gambar 2D ). Organoid dalam hidrogel yang lebih kaku (8 wt.%) lebih bulat dan lebih kecil (≈610 µm) dibandingkan dengan yang ada dalam hidrogel yang lebih lunak (3 wt.%, ≈970 µm) (Gambar 2E ). Sebaliknya, enkapsulasi Matrigel memiliki dampak minimal pada pertumbuhan organoid (≈1290 µm), kemungkinan karena kekakuan mekanisnya yang sangat rendah dan banyaknya faktor pertumbuhan. Sel bermigrasi keluar dari organoid dalam hidrogel yang digabungkan RGD (Gambar 2B,C ; Gambar S6A , Informasi Pendukung), dengan area migrasi meningkat dari ≈0,3 mm 2 pada RGD 1 mM menjadi ≈0,4 mm 2 pada RGD 2 mM pada Hari ke-20. Sebaliknya, tidak ada migrasi sel yang diamati dari kardioid yang dihasilkan dalam hidrogel tanpa RGD atau kultur suspensi. Kardioid yang dikapsulasi Matrigel menunjukkan tingkat migrasi tercepat, dengan migrasi dimulai pada Hari ke-8 dan mencapai area sel migrasi terbesar (≈0,6 mm 2 ) pada Hari ke-20 (Gambar 2F ).
2.3 Hidrogel Mengatur Perkembangan Ruang Baru dan Fisiologi Kontraktil Kardioid
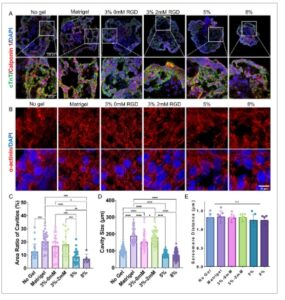
Untuk mengonfirmasi keberhasilan diferensiasi jantung, imunopewarnaan dilakukan untuk penanda spesifik kardiomiosit, troponin T jantung (cTnT) dan sarkomer α-aktinin (ACTN2), serta penanda otot polos kalponin 1 ( Gambar 3A,B ). Ekspresi positif penanda ini di seluruh kelompok mengonfirmasi bahwa setiap kondisi hidrogel, bersama dengan kultur suspensi, secara efektif mendukung diferensiasi jantung. Selain itu, rongga diamati terbentuk di dalam kardioid, yang menunjukkan perkembangan ruang jantung yang baru lahir (Gambar 3A ). Rasio luas rongga terhadap organoid menurun seiring dengan meningkatnya kekakuan hidrogel (Gambar 3C ). Kardioid yang dikultur dalam hidrogel PEG 3 wt.% (≈17%), dengan atau tanpa RGD, menunjukkan rasio luas rongga yang sebanding dengan Matrigel (20%), yang keduanya lebih tinggi daripada yang ada dalam kultur suspensi (13%). Tren serupa diamati dalam ukuran rongga rata-rata, dengan kardioid dalam hidrogel yang lebih kaku (≈74 µm dalam 8 wt.% PEG) membentuk rongga yang jauh lebih kecil daripada yang ada di Matrigel (≈190 µm) dan hidrogel 3 wt.% yang mengandung RGD (≈180 µm) (Gambar 3D ). Lebih jauh lagi, jarak sarkomer diukur di berbagai kondisi kultur, tetapi tidak ada perbedaan signifikan yang diamati antara kelompok (Gambar 3E ). Hasil-hasil ini menunjukkan bahwa baik sifat mekanis matriks maupun motif perekat sel memengaruhi pembentukan ruang baru dalam kardioid, yang menyoroti peran penting enkapsulasi hidrogel dalam meningkatkan perkembangan struktural dibandingkan kultur suspensi tradisional.
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Dampak sifat hidrogel pada pembentukan ruang dalam kardioid. A) Imunostaining protein spesifik kardiomiosit troponin T jantung (cTnT) dan penanda otot polos calponin 1. B) Imunostaining sarkomer α-aktinin untuk menunjukkan struktur sarkomer kardioid. C) Kuantifikasi rasio luas rongga dan D) ukuran rongga di berbagai kondisi kultur. E) Pengukuran jarak sarkomer dalam kardioid. Kardioid yang dikultur dalam hidrogel RGD PEG-2 mM 3 wt.% menunjukkan pembentukan rongga yang sebanding dengan yang ada di Matrigel, keduanya lebih tinggi daripada dalam kondisi lain. Signifikansi statistik ditentukan menggunakan ANOVA satu arah dengan koreksi post-hoc Tukey (* p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001, ns = tidak signifikan, n ≥ 15).
Untuk mengkarakterisasi fisiologi kontraksi, kami melakukan penilaian terpadu terhadap fluks kalsium GCaMP6f dan gerakan kontraksi jantung ( Gambar 4A–C dan Film S1 – S6 , Informasi Pendukung). Kardioid yang dikultur dalam hidrogel kaku (8 wt.%) menunjukkan pengurangan yang signifikan dalam laju detak, kecepatan relaksasi maksimum, dan kecepatan kontraksi maksimum dibandingkan dengan yang dikultur dalam hidrogel lunak atau suspensi (Gambar 4D ). Temuan ini sejalan dengan penelitian sebelumnya yang menunjukkan bahwa kardiomiosit yang dikultur pada substrat kaku menunjukkan laju detak yang berkurang dan kecepatan kontraksi dan relaksasi yang berkurang. [ 37 – 39 ] Kekakuan hidrogel yang meningkat juga menyebabkan fluks kalsium maksimum yang lebih tinggi dan pengurangan waktu upstroke (T0) dan durasi puncak, yang menunjukkan bahwa kekakuan memodulasi pelepasan kalsium intraseluler dalam kardiomiosit (Gambar 4D ). Demikian pula, nilai waktu peluruhan kalsium (T30, T50, dan T75) berkurang pada organoid yang dikultur dalam hidrogel dibandingkan dengan yang tanpa enkapsulasi hidrogel, yang selanjutnya menekankan pengaruh isyarat biomekanik dari hidrogel kaku pada fluks kalsium. Pengamatan ini konsisten dengan penelitian yang menunjukkan bahwa substrat kaku menyebabkan waktu penanganan kalsium yang lebih pendek dalam sel jantung, yang berpotensi menyebabkan aritmia. [ 40 – 44 ] Secara keseluruhan, temuan ini menunjukkan bahwa hidrogel yang lebih lunak (misalnya, 3 wt.%) lebih baik untuk diferensiasi dan fungsi kardioid yang tepat.
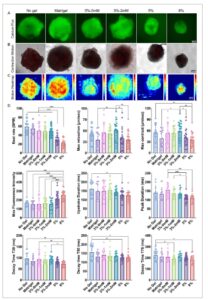
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Dampak sifat hidrogel pada fungsi kontraksi jantung. A) Pencitraan fluks kalsium fluoresen dan B) Analisis gerakan kontraksi kardioid berbasis video medan terang. C) Peta panas gerakan yang memvisualisasikan dinamika kontraksi di berbagai kondisi hidrogel. D) Analisis kuantitatif fungsi kontraktil, termasuk laju denyut, kecepatan relaksasi dan kontraksi maksimum, intensitas fluoresensi puncak, durasi upstroke (T0), durasi puncak, dan waktu peluruhan (T30, T50, dan T75). Signifikansi statistik ditentukan menggunakan ANOVA satu arah dengan koreksi post-hoc Tukey (* p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001, n ≥ 15).
2.4 Enkapsulasi Hidrogel Menghasilkan Reproduksibilitas Tinggi pada Kardioid
Bahasa Indonesia: Untuk menilai lebih jauh reproduksibilitas pembentukan kardioid dalam kondisi kultur yang berbeda, kami menghitung koefisien variasi (CV) untuk parameter utama, termasuk ukuran organoid, dimensi rongga, panjang sarkomer, fungsi kontraktil, dan transien kalsium (Tabel S2 , Informasi Pendukung). Kami menemukan bahwa hidrogel 3% PEG 2mM-RGD menunjukkan nilai CV rata-rata terendah di antara semua kondisi kultur, yang menunjukkan reproduksibilitas tertinggi dalam perkembangan dan fungsi kardioid. Secara khusus, dibandingkan dengan enkapsulasi Matrigel, hidrogel 3% PEG 2mM-RGD menunjukkan nilai CV yang lebih rendah untuk ukuran organoid, waktu puncak kalsium, dan kecepatan kontraksi, yang merupakan parameter fisiologis penting untuk memastikan produksi dan kultur kardioid yang konsisten. Temuan kami sejalan dengan penelitian sebelumnya yang menggunakan hidrogel matriks ekstraseluler yang berasal dari jaringan gastrointestinal sebagai alternatif Matrigel untuk kultur organoid lambung, melaporkan CV yang jauh lebih rendah dalam ukuran organoid dibandingkan dengan Matrigel. [ 45 ] Kami juga menyoroti pentingnya menggabungkan RGD dalam hidrogel PEG untuk mencapai perkembangan kardioid yang konsisten. Kami menemukan bahwa tanpa adanya RGD, hidrogel PEG bioinert memberikan interaksi adhesif sel yang minimal, yang menyebabkan variabilitas dalam pertumbuhan kardioid. Penggabungan RGD memperkenalkan situs pengikat integrin yang memfasilitasi interaksi kardioid-matriks yang lebih seragam, sehingga menstabilkan kardioid yang dienkapsulasi dan mengurangi CV. Hidrogel PEG sintetis memberikan lingkungan yang lebih terkontrol dan dapat disesuaikan, memungkinkan modulasi yang tepat dari sifat biokimia dan mekanis. Tingkat kontrol ini menghasilkan hasil yang lebih dapat direproduksi dalam perkembangan organoid.
2.5 Perbandingan Transkriptomik untuk Kardioid dalam Kondisi Kultur yang Berbeda
Berdasarkan hasil sebelumnya, kami mengamati bahwa hidrogel yang lebih lunak lebih mendukung perkembangan kardioid, mendorong pembentukan ruang yang lebih kuat dan meningkatkan fungsi kontraktil. Hasilnya, kami memilih hidrogel yang lebih lunak untuk perbandingan transkriptomik dengan metode kultur tradisional, termasuk kultur suspensi Matrigel dan tanpa gel. Pengurutan RNA massal (RNA-seq) dilakukan pada kardioid yang dihasilkan dalam berbagai kondisi: kardioid yang dienkapsulasi PEG (3 wt.% dengan dan tanpa RGD 2 mM), kardioid yang dienkapsulasi Matrigel, dan kardioid yang dikulturkan dengan suspensi tanpa gel. Setelah menyaring bacaan berkualitas rendah, ≈18 120 gen digunakan untuk analisis hilir. Analisis komponen utama (PCA) mengungkapkan pemisahan yang jelas antara kondisi. Kardioid dari hidrogel PEG 3 wt.% tanpa RGD sangat mirip dengan kardioid dari kultur suspensi tanpa gel, sementara kardioid yang dikultur dalam hidrogel PEG 3 wt.% dengan RGD 2 mM m lebih mirip dengan kardioid yang dienkapsulasi dalam Matrigel. Khususnya, distribusi sampel replikasi kardioid dari kelompok hidrogel PEG lebih terkonsentrasi dalam plot PCA dibandingkan dengan kelompok Matrigel dan tanpa gel, yang menunjukkan bahwa kardioid yang dihasilkan dengan hidrogel PEG menunjukkan konsistensi yang lebih besar dalam profil transkriptomiknya daripada yang tumbuh menggunakan metode tradisional ( Gambar 5A ).

Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Profil transkriptomik kardioid di berbagai kondisi kultur. A) Plot analisis komponen utama (PCA) yang menunjukkan pengelompokan kardioid yang berbeda yang dikultur dalam hidrogel PEG 3 wt.% (dengan dan tanpa RGD 2 mM), Matrigel, dan kultur suspensi (Tanpa Gel). B) Plot gunung berapi yang menggambarkan gen yang diekspresikan secara berbeda antara hidrogel Matrigel / 3 wt.% PEG-2 mM RGD dan kelompok 3 wt.% PEG-0 mM RGD / Tanpa Gel. C) Analisis jalur ontologi gen (GO), Reactome, dan KEGG yang menyoroti proses biologis yang berbeda dan jalur pensinyalan yang diperkaya dalam berbagai kondisi. Rata-rata tingkat ekspresi gen yang terkait dengan D) interaksi sel-ECM dan mekanotransduksi, E) perkembangan pembuluh darah, F) perkembangan jantung, dan G) saluran ion di berbagai kelompok kultur.
Kami kemudian mengelompokkan Matrigel dan hidrogel PEG-2 mM RGD 3 wt.% untuk dibandingkan dengan hidrogel PEG-0 mM RGD 3 wt.% dan tanpa kelompok gel. Analisis plot gunung berapi menunjukkan bahwa terdapat 1953 gen yang mengalami peningkatan regulasi dalam hidrogel PEG-0 mM RGD 3 wt.% dan tanpa kelompok gel (Gambar 5B ), yang diperkaya dalam perkembangan sistem saraf (LRP2, GBX2 dan NGFR), morfogenesis embrionik (SOX2, TFAP2A dan POU3F4) dan organisasi sambungan sel (ITGA2, CLDN11 dan GABRB3) (Gambar 5C ). 2560 gen diregulasi ke atas dalam kelompok Matrigel dan hidrogel PEG-2 mM RGD 3 wt.%, yang diperkaya dalam perkembangan jantung (ACTN2, NKX2-5 dan MYH6), perkembangan otot polos (ACTA1, TAGLN dan ACTC1), perkembangan pembuluh darah (ANG, ANGPT1, EDN1 dan VEGFC) dan organisasi matriks ekstraseluler (COL1A1, COL3A1, dan MMP2).
Kami selanjutnya menganalisis gen-gen yang menarik yang terkait dengan interaksi sel-ECM, saluran ion, perkembangan pembuluh darah, dan perkembangan jantung di seluruh kelompok. Dalam hidrogel PEG yang dipadukan dengan RGD, kami mengamati profil ekspresi gen yang mirip dengan Matrigel, dengan ekspresi gen yang tinggi yang terlibat dalam interaksi sel-ECM (COL3A1, ITGA1, ITGB5, ECM1, MMP2, dan MMP10), kemungkinan karena adanya molekul adhesi dalam kondisi ini (Gambar 5D ). Namun, ekspresi gen yang terkait dengan mekanotransduksi (TAZ, ZIC1, TMC2, dan KCNK10) meningkat dalam hidrogel RGD PEG-0 mM dan kelompok tanpa gel (Gambar 5D ). Yang lebih penting, gen yang terkait dengan perkembangan jantung (MYH6, ACTC1, MYL7, NKX2.5, dan TBX5) dan perkembangan pembuluh darah (ETS1, CDH5, ENG, VCAM1, dan TGFBR2), dan saluran ion (CACNA1C, CACNA1G, KCNJ5, KCNK6, dan SCN5A) diekspresikan secara tinggi baik dalam Matrigel maupun hidrogel PEG-2 mM RGD 3 wt.% (Gambar 5E–G ). Temuan ini selanjutnya menunjukkan bahwa hidrogel PEG yang difungsikan RGD memiliki efek yang sebanding dengan Matrigel dalam mendorong diferensiasi jantung.
Berikutnya, kami memilih 1000 gen teratas dengan varians tertinggi dari semua sampel dan memetakannya dalam peta panas dengan analisis klaster hierarkis ( Gambar 6A ). Segregasi gen-gen ini dapat diidentifikasi sebagai tiga wilayah utama: Wilayah I sangat terekspresikan dalam kelompok tanpa gel dan 3 wt.% PEG – 0mM RGD hidrogel, Wilayah II sangat terekspresikan dalam kelompok Matrigel dan 3 wt.% PEG – 2mM RGD hidrogel, dan Wilayah III sangat terekspresikan dalam kelompok hidrogel PEG dengan/tanpa RGD. Berikutnya, kami melakukan analisis global proses biologis (Gene Ontology) dan jalur pensinyalan (Reactome Pathway dan WikiPathway) berdasarkan pola ekspresi gen untuk setiap wilayah. Wilayah I menyoroti morfogenesis embrionik dan perkembangan sistem saraf, sementara analisis jalur menunjukkan pengayaan tinggi dalam pensinyalan Rho GTPase dan pensinyalan WNT, yang terkait dengan pemeliharaan sel punca dan diferensiasi neuron (Gambar 6B ). Wilayah II menunjukkan pengayaan gen yang terkait dengan pembentukan jantung dan perkembangan pembuluh darah, dan analisis jalur menunjukkan pengayaan tinggi dalam pensinyalan VEGF dan PI3K-Akt serta kontraksi otot (Gambar 6C ). Wilayah III memiliki gen yang diperkaya dalam proses metabolisme dan terlibat dalam pensinyalan NOTCH.
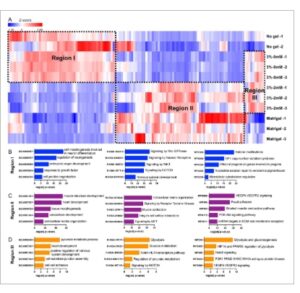
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Analisis 1000 gen teratas dengan varians tertinggi. A) Heatmap dan pengelompokan hierarkis menunjukkan profil transkriptom yang berbeda di antara kelompok yang berbeda untuk 1000 gen teratas dengan varians tertinggi. B–D) Ontologi gen, analisis Reactome, dan jalur KEGG menunjukkan organoid yang berasal dari 3%-2m M RGD dan Matrigel sangat memperkaya gen yang terkait dengan perkembangan jantung, pensinyalan kalsium, dan fungsi kontraktil, sementara organoid yang dikulturkan dengan 3%-0mM RGD dan No gel mengekspresikan gen yang terkait dengan perkembangan embrio. Gen yang diperkaya dalam kelompok hidrogel PEG terkait dengan aktivitas metabolik dan pensinyalan NOTCH.
Kami membandingkan 1000 gen teratas yang diekspresikan secara berbeda di keempat kelompok menggunakan plot gunung berapi, menerapkan ambang batas p -nilai <0,05 dan perubahan lipatan >2 (Gambar S7 , Informasi Pendukung). Dalam PEG 3 wt.% tanpa RGD dan kondisi kultur suspensi, gen yang terkait dengan pluripotensi dan morfogenesis embrionik (SOX2, SOX11, HOXB2) dan perkembangan neuron (TUBB2B, TUBB3, dan NGFR) diatur naik. Sebaliknya, gen yang diatur naik dalam Matrigel adalah penanda kardiomiosit khas (MYL9, MYL7, dan MYH6) dan penanda endotel (AQP1, ENG, CDH7) (Gambar S7A,B , Informasi Pendukung). Dibandingkan dengan Matrigel, kardioid dari hidrogel PEG fungsionalisasi RGD menunjukkan pengayaan gen yang terlibat dalam sintesis ECM (COL1A1, COL5A1, dan EMC10) dan perkembangan jaringan ikat (EGR1, FOS, dan PDGFRB) (Gambar S7C , Informasi Pendukung). Selain itu, jika dibandingkan dengan hidrogel PEG tanpa RGD, kardioid yang dikultur dalam hidrogel PEG fungsionalisasi RGD menunjukkan ekspresi penanda jantung yang lebih tinggi (ACTN2, NKX2.5, MYH7, dan MYH6) (Gambar S7D , Informasi Pendukung). Analisis komparatif ini menyoroti bahwa hidrogel PEG fungsionalisasi dengan RGD mempromosikan ekspresi penanda spesifik jantung yang lebih kuat dalam kardioid dibandingkan dengan kondisi kultur tanpa molekul adhesi eksternal. Untuk memvalidasi hasil RNAseq massal, kami menganalisis penanda jantung (MYH6, MYH7, TNNI1, MYL7) menggunakan RT-qPCR (Gambar S8 , Informasi Pendukung). Gen-gen khusus jantung ini diekspresikan jauh lebih tinggi dalam kardioid yang dihasilkan dari Matrigel dan hidrogel PEG yang tergabung dalam RGD, dibandingkan dengan yang dihasilkan dalam hidrogel bebas RGD dan kelompok Tanpa gel. Hasil RT-qPCR memiliki tren yang sama dengan hasil RNAseq massal.
3 Diskusi
3.1 PEG Hidrogel Sintetis Meningkatkan Reproduksibilitas Kardioid
Meskipun Matrigel efektif dalam membudidayakan organoid, asal usulnya yang berasal dari tumor, variabilitas batch, dan sifat biokimia yang tidak konsisten menyebabkan reproduktifitas yang buruk dalam kultur dan diferensiasi organoid. Untuk mengatasi tantangan ini dan meningkatkan reproduktifitas organoid, hidrogel sintetis yang ditentukan secara kimia dan mekanis telah dikembangkan sebagai alternatif yang sesuai untuk berbagai kultur organoid. [ 13 , 16 , 18 , 20 ] Dalam penelitian ini, kami membuat hidrogel PEG sintetis yang ditentukan sepenuhnya untuk kultur 3D kardioid secara in vitro. Enkapsulasi hidrogel terbukti lebih efisien dalam menginduksi diferensiasi kardioid dibandingkan dengan kultur suspensi tradisional. Kardioid yang tumbuh dalam hidrogel berbasis PEG menunjukkan perkembangan morfologi, fungsi kontraktil, dan profil transkriptomik yang serupa dengan yang dikultur dalam Matrigel. Reproduktifitas yang ditingkatkan dalam morfologi organoid, pembentukan ruang, fungsi kontraktil, dan profil transkriptomik lebih lanjut menyoroti keuntungan dan keandalan polimer yang ditentukan dengan baik ini dibandingkan Matrigel untuk kultur kardioid. Hal ini menunjukkan bahwa hidrogel sintetis yang terdefinisi dengan baik ini dapat berfungsi sebagai alternatif yang efektif untuk matriks yang berasal dari hewan untuk membudidayakan kardioid.
Beberapa penelitian telah melaporkan bahwa matriks yang terlalu kaku atau terlalu lunak dapat menghambat pembentukan organoid dan berdampak negatif pada perkembangan dan fungsi organoid. [ 13 , 20 , 46 – 49 ] Demikian pula, kami menemukan bahwa peningkatan kekakuan hidrogel menimbulkan kendala mekanis yang lebih besar, yang membatasi pertumbuhan kardioid dan menyebabkan kematian sel. Hidrogel yang paling kaku (8 wt.% PEG) menyebabkan penurunan laju detak dan perubahan transien kalsium. Dengan demikian, hidrogel yang lebih lunak mungkin lebih baik untuk diferensiasi dan kultur kardioid. Meskipun penelitian ini tidak berfokus pada mekanisme molekuler yang mendorong perbedaan dalam fungsi kontraktil dan perkembangan kardioid, diyakini bahwa beberapa jalur pensinyalan mekanotransduksi, seperti RhoA/ROCK dan YAP/TAZ, mungkin terlibat dalam proses ini. Misalnya, peningkatan aktivitas YAP telah dikaitkan dengan peningkatan diferensiasi dan pematangan jantung. [ 50 , 51 ] Analisis transkriptomik kami juga mengungkap ekspresi YAP yang tinggi dalam hidrogel yang mengandung RGD dan Matrigel dibandingkan dengan organoid yang dikultur dalam suspensi dan hidrogel tanpa RGD. Kami mencoba mengembangkan hidrogel dengan kekakuan serendah Matrigel dengan mengurangi konsentrasi PEG menjadi 1–2 wt.%, tetapi hidrogel yang terbentuk terlalu lunak untuk ditangani. Mendesain hidrogel PEG baru dengan kekakuan yang lebih rendah untuk menyelidiki lebih lanjut dampaknya terhadap perkembangan kardioid akan sangat menarik untuk penelitian di masa mendatang.
3.2 Kardioid untuk Pemodelan Pembentukan Ruang Baru Selama Embriogenesis
Karena struktur bola 3D mereka, kardioid tidak memiliki arsitektur jaringan selaras yang menjadi ciri otot jantung dewasa. Sebaliknya, jaringan jantung rekayasa (EHT) biasanya dirakit setelah sel-sel telah berdiferensiasi menjadi kardiomiosit atau jenis sel relevan lainnya. Ini menawarkan kontrol yang lebih besar atas susunan spasial sel untuk membentuk jaringan jantung yang lebih menyerupai arsitektur jantung dewasa. Sementara kardioid memiliki keterbatasan dalam hal pematangan jaringan, mereka memiliki sifat unik yang memungkinkan mereka untuk memodelkan pembentukan ruang jantung secara in vitro. Kardioid secara intrinsik membentuk rongga seperti ruang melalui modulasi sinergis jalur pensinyalan FGF, BMP4, dan Wnt. [ 5 , 52 , 53 ] Dalam penelitian ini, kami menunjukkan bahwa pembentukan rongga dalam kardioid kami dimodulasi oleh sifat mekanis matriks di sekitarnya. Penelitian sebelumnya telah menunjukkan bahwa pensinyalan Notch sangat penting untuk pengembangan ruang ventrikel, yang bekerja melalui EphrinB2 untuk mengaktifkan NRG1 di ventrikel. [ 54 , 55 ] Konsisten dengan ini, kami mengamati ekspresi gen yang terkait dengan pensinyalan Notch yang lebih tinggi pada kardioid yang dienkapsulasi dalam hidrogel PEG dibandingkan dengan yang dalam suspensi, yang mengarah pada pembentukan rongga yang lebih besar. Ini menunjukkan bahwa pembentukan ruang jantung dipengaruhi oleh isyarat biokimia dan biomekanik selama perkembangan jantung. Namun, ukuran rongga dalam kardioid kami lebih kecil daripada yang dilaporkan dalam model kardioid bilik lainnya, kemungkinan karena induksi biokimia yang tidak memadai, seperti BMP4. Ke depannya, penelitian kami akan fokus pada peningkatan pembentukan ruang penuh dalam kardioid dengan memanipulasi jalur pensinyalan BMP dan Notch kanonik bersama dengan matriks rekayasa kami.
3.3 Motif Perekat Sel Meningkatkan Perkembangan Endotel pada Kardioid
Penggabungan peptida adhesi sel, seperti RGD, AG73, IKVAV, GFOGER, dan YIGSR, dilaporkan memengaruhi morfogenesis dan diferensiasi organoid. [ 13 , 20 , 24 , 25 , 48 ] Kami juga menunjukkan bahwa fungsionalisasi hidrogel dengan 2 mM RGD meningkatkan diferensiasi kardioid, yang menunjukkan bahwa peptida adhesi sel merupakan faktor penting dalam perkembangan kardioid. Yang lebih penting, hasil transkriptomik kami menunjukkan bahwa hidrogel Matrigel dan PEG yang difungsikan dengan RGD meningkatkan ekspresi gen endotel, yang menunjukkan potensi peningkatan diferensiasi sel endotel pada kardioid. Penelitian sebelumnya telah menunjukkan bahwa hidrogel fungsionalisasi RGD dapat meningkatkan diferensiasi sel endotel dari badan embrioid yang dienkapsulasi dan sel punca mesenkimal. [ 56 – 58 ] Interaksi antarsel antara sel endotel dan kardiomiosit sangat penting untuk perkembangan jantung. Penggabungan sel vaskular dapat meningkatkan fungsi jantung dengan mengatur proliferasi kardiomiosit, [ 59 ] kekuatan kontraksi, [ 60 ] dan pematangan. [ 61 – 64 ] Komposisi sel terperinci dan rasio sel relatif dalam kardioid masih belum jelas, pekerjaan masa depan untuk memperluas studi ini akan fokus pada pelacakan garis keturunan dan pengurutan RNA sel tunggal untuk mengungkap identitas sel dan heterogenitas sel.
4 Kesimpulan
Dalam penelitian ini, kami mengembangkan matriks hidrogel PEG yang didefinisikan secara kimia dan mekanis untuk kultur kardioid manusia secara in vitro. Hidrogel PEG yang dioptimalkan (3 wt.% PEG-2mM RGD) mendukung pertumbuhan organoid, diferensiasi jantung, pembentukan ruang baru, dan fungsi kontraktil. Dibandingkan dengan kondisi kultur suspensi yang umum digunakan, enkapsulasi hidrogel dengan motif adhesi sel lebih lanjut mendorong perkembangan kardiovaskular dan pembentukan ruang baru. Dibandingkan dengan enkapsulasi Matrigel tradisional, hidrogel sintetis meningkatkan reproduktifitas baik dalam sifat struktural maupun transkriptomik kardioid. Hasil ini menggarisbawahi potensi hidrogel PEG sebagai alternatif Matrigel untuk kultur kardioid manusia dan aplikasi translasinya di masa mendatang.
5 Bagian Eksperimen
Pembuatan Hidrogel
Larutan stok (20 wt.% b/v) makromer PEG-norbornena 8 lengan 20kDa (Creative PEGWorks, TX, AS), pengikat silang peptida yang dapat terurai MMP GKKCGPQG↓IWGQCKKG (Genscript, NJ, AS) dan peptida adhesi RGD (urutan peptida: CRGDS, Genscript, NJ, AS) disiapkan dengan melarutkannya dalam PBS. Larutan prekursor hidrogel dibuat dengan mencampur larutan stok PEG, peptida berujung tiol (rasio tiol:ena 1:1) dan 0,05 wt.% fotoinisiator litium fenil-2,4,6-trimetilbenzoilfosfinat (LAP). Hidrogel dipolimerisasi di bawah sinar ultraviolet (UV) (≈5 mW cm −2 , 365 nm) selama 3 menit dan dipindahkan ke larutan penyangga fosfat (PBS) selama 24 jam sebelum karakterisasi. Konsentrasi RGD sebesar 1 dan 2 mM dan konsentrasi hidrogel sebesar 3%, 5%, dan 8% diteliti dalam penelitian ini.
Karakterisasi Mekanik
Sifat reologi hidrogel dikarakterisasi pada rheometer DR-H3 menggunakan pelat 8 mm (TA Instruments, New Castle, DE, AS). Untuk menentukan modulus penyimpanan awal (G’) dan kehilangan (G″), hidrogel yang dipolimerisasi dibiarkan membengkak selama 24 jam pada suhu 37 °C dalam PBS. Kemudian, dilakukan pemindaian frekuensi pada 1–10 rad s −1 dengan regangan 1%, yang ditetapkan berada dalam rentang viskoelastis linier. Untuk mengukur perubahan modulus dari waktu ke waktu, hidrogel dianalisis secara berkala selama periode yang ditentukan.
Untuk menguji rasio pembengkakan, sampel hidrogel direndam dalam PBS selama 24 jam pada suhu ruangan. Berat pembengkakan (Ws) dicatat setelah dikeringkan untuk menghilangkan kelebihan PBS. Hidrogel kemudian dikeringkan beku untuk menentukan berat kering (Wd). Rasio pembengkakan dihitung dengan persamaan berikut:
![]()
Ukuran jaring hidrogel diperkirakan menggunakan massa hidrogel pada pembengkakan kesetimbangan dan setelah liofilisasi seperti yang dijelaskan sebelumnya. [ 65 ]
Uji Ellman
Standar sistein dan reagen Ellman dilarutkan kembali dalam buffer reaksi natrium fosfat 0,1 M (pH 8) dengan EDTA 1 mM. Makromer PEG dan penghubung peptida ditiol kemudian dicampur pada rasio molar 1:1 dari gugus norbornena terhadap gugus tiol (3 mM Norb.: 3 mM SH) dan difotokurasi dengan adanya LAP. Konsentrasi peptida yang tidak bereaksi ditentukan dengan mencampur 25 µL sampel dengan 5 µL reagen Ellman yang dilarutkan kembali dan 250 µL buffer reaksi. Campuran diinkubasi pada suhu ruangan selama 15 menit sebelum analisis spektrofotometri pada 412 nm.
Pemeliharaan iPSC Manusia
Garis WTC-11 dan GCaMP6f hiPSC yang telah diedit genomnya (lab Bruce Conklin, Gladstone Institute of Cardiovascular Diseases) dipelihara dalam medium Essential-8 (E8) (ThermoFisher, Katalog # A1517001) dalam pelat kultur jaringan enam sumur yang dilapisi dengan 1% Geltrex (Fisher Scientific, Katalog # A1413302) dalam inkubator 37 °C yang mengandung 5% CO 2 . Media diganti setiap hari, dan sel disalurkan dengan Accutase (Stem Cell Tech. Katalog # 7922) saat mencapai konfluensi ≈70%. Inhibitor ROCK 10 µM Y-27632 (Stem Cell Technologies, Katalog # 72308) digunakan selama 24 jam pertama pasca-disosiasi untuk meningkatkan viabilitas sel.
Generasi Kardioid
hiPSC dipisahkan dan disemai pada konsentrasi 3000, 5000, dan 10.000 sel per sumur dalam pelat 96 sumur dengan dasar bulat dan perlekatan sangat rendah (Costar) dalam medium E8 yang dilengkapi dengan 10 µM Y-27632 (Katalog Stem Cell Tech. # 72308), disentrifugasi pada 300 g dan 4 °C selama 4 menit, lalu ditempatkan dalam inkubator untuk pembentukan agregat hiPSC. Diferensiasi agregat ini dimulai pada Hari ke-0 dengan mengganti medium E8 dengan medium RPMI/1640 (Thermo Fisher Scientific, Katalog # 11875135) yang mengandung suplemen B27 minus insulin (RPMI/B27-I) (Thermo Fisher Scientific, Katalog # A1895601) dan 6 µ M CHIR99021 (Stem Cell Technology, Katalog # 100-1042). Setelah 24 jam, medium diubah menjadi RPMI/B27–I. Pada Hari ke-2, RPMI/B27–I yang dilengkapi dengan 5 µM IWP4 (Teknologi Sel Punca, Katalog # 72554) ditambahkan selama 48 jam dan kemudian diubah menjadi RPMI/B27–I pada Hari ke-4. Mulai Hari ke-6 dan seterusnya, agregat dikultur dalam RPMI 1640 yang mengandung suplemen lengkap B27 (RPMI/B27+C) (Thermo Fisher Scientific, Katalog # A3582801). Pada hari ke-6, agregat dikumpulkan dari pelat 96-sumur dan kemudian dicampur dengan larutan prekursor hidrogel. Prekursor hidrogel-agregat dipipet ke dalam pelat 12-sumur dan difotopolimerisasi di bawah sinar UV selama 3 menit. Segera setelah polimerisasi, RPMI/B27+C ditambahkan ke pelat dan diganti setiap 2 hari. Untuk enkapsulasi Matrigel, kardioid ditanamkan dalam tetesan Matrigel (Corning, Katalog # 354234) dan dicetak ke dalam pelat 12-sumur pada hari ke-6. Setelah penanaman, pelat ditempatkan dalam inkubator selama 30 menit agar Matrigel mengeras. Selain itu, agregat yang terus dikulturkan dalam pelat 96-sumur tanpa proses enkapsulasi apa pun digunakan sebagai kelompok Tanpa Gel.
Kelangsungan Hidup Organoid
Untuk mengevaluasi daya tahan organoid yang dienkapsulasi, uji HIDUP/MATI (Invitrogen, Katalog #L3224) digunakan sesuai dengan petunjuk pabrik. 2 hari setelah enkapsulasi, Calcein AM (2 µ M ) dan etidium homodimer (4 µM) ditambahkan langsung ke media kultur. Setelah inkubasi selama 30 menit pada suhu 37 °C, sampel divisualisasikan dengan mikroskop Nikon Eclipse Ti dengan kamera Zyla 4.2 PLUS sCMOS. Tingkat kematian sel diukur dengan mengukur intensitas fluoresensi saluran merah dengan Image J.
Karakterisasi Fungsional Kardioid
Pada Hari ke-20, kardioid turunan GCaMP6f hiPSC divisualisasikan dalam inkubator mikroskop onstage (OkoLab Stage Top Incubator, UNO-TH-CO2) pada suhu 37 °C dan 5% CO2 untuk mempertahankan kondisi fisiologis pada mikroskop terbalik Nikon Ti-E dengan kamera CMOS digital Andor Zyla 4.2+. Video kardioid yang berkontraksi direkam pada 50 bingkai per detik selama 10 detik dalam brightfield dan diekspor sebagai serangkaian file gambar bingkai tunggal. Fisiologi kontraksi dianalisis menggunakan perangkat lunak pelacakan gerakan berbasis video yang menghitung vektor gerakan berdasarkan pergerakan piksel. [ 35 ] Untuk analisis transien kalsium, video diambil di bawah eksitasi 488 nm pada waktu pencahayaan 40 ms dengan 25 bingkai per detik. Sinyal fluks kalsium diekspor sebagai profil sumbu Z di ImageJ. Peluruhan pemutihan fluoresensi dikoreksi dan parameter terkait t0 , t50 , t75 dihitung menggunakan skrip MATLAB internal. Waktu naik t0 didefinisikan sebagai waktu yang dibutuhkan fluks kalsium untuk mencapai intensitas fluoresensi puncak, sedangkan waktu peluruhan t50 dan t75 menunjukkan waktu yang dibutuhkan fluks kalsium untuk meluruh masing-masing sebesar 50% dan 75% dari intensitas fluoresensi puncak.
Pewarnaan Imunohistokimia
Pada hari ke-20, organoid yang dienkapsulasi hidrogel difiksasi dengan 4% paraformaldehida (PFA) selama 30 menit pada suhu kamar. Hidrogel kemudian dicuci tiga kali dengan PBS dan ditanamkan dalam larutan Suhu Pemotongan Optimal (OCT, Tissue-Tek). Kemudian, organoid dipotong secara kriogenik menggunakan kriostat UV Leica CM13050S menjadi potongan 10 µm dan dipasang pada slide SuperFrost Plus (Fisher Scientific). Sampel diinkubasi dalam antibodi primer (Tabel S1 , Informasi Pendukung) selama 2 jam pada suhu kamar, dicuci dengan PBS tiga kali, dan kemudian antibodi sekunder selama 1,5 jam. Akhirnya, setelah tiga kali pencucian PBS, sel diinkubasi dengan DAPI untuk pewarnaan inti selama 10 menit. Semua sampel dicitrakan menggunakan mikroskop confocal Zeiss 980. Untuk mengukur rongga di dalam kardioid, Image J digunakan untuk menghitung luas dan dimensi rongga. Rongga-rongga tersebut pertama kali ditemukan dalam gambar fluoresensi organoid. Rasio luas rongga dihitung berdasarkan luas rongga total dan seluruh luas kardioid (Gambar S1 , Informasi Pendukung). Dimensi rongga dihitung berdasarkan panjang rongga (jarak terjauh yang diperkirakan). Jarak sarkomer diukur berdasarkan dua struktur sarkomer kardioid yang berdekatan menggunakan Image J.
Pengurutan RNA Massal
Pada hari ke-20, kardioid dikumpulkan dari hidrogel, disentrifugasi, dan dicuci dengan PBS beberapa kali untuk membuang semua media yang tersisa. mRNA diekstraksi menggunakan Trizol (Invitrogen, #15596026), Kloroform (Serva, #39553.01), dan isopropanol (Fisher, BP2618). Pelet RNA dilarutkan ke dalam 40uL air yang diolah UltraPureTM DEPC (Invitrogen, #750023) dan disimpan pada suhu -80 °C. RNA diukur menggunakan Spektrofotometer UV-Vis NanoDrop Microvolume. Kualitas RNA dievaluasi menggunakan Agilent 2100 Bioanalyzer di Molecular Analysis Core, SUNY Upstate Medical University. Sampel dengan RIN ≥ 8,0 dan konsentrasi ≥ 50 ng µL −1 digunakan untuk pengurutan RNA massal (Azenta USA Inc). Kit penghilangan rRNA Illumina Ribo-Zero digunakan untuk penipisan rRNA pada semua sampel. Sampel diurutkan menggunakan Illumina HiSeq dengan konfigurasi 2 × 150 pasangan basa, indeks tunggal, pembacaan ujung berpasangan per jalur.
File FASTQ mentah dianalisis menggunakan perangkat lunak Partek Flow, lisensi bersama yang disediakan oleh SUNY Upstate Medical Genomics Core. Hasil pembacaan yang tidak selaras dipangkas untuk basa guna memperoleh skor kualitas Phred >20, lalu diselaraskan menggunakan Spliced Transcripts Alignment to a Reference (STAR) ke genom manusia (hg38). Penilaian pasca-penyelarasan dilakukan untuk jaminan kualitas (QA) dan kontrol kualitas (QC), yang menunjukkan persentase penyelarasan untuk setiap sampel >75%. Skor kualitas basa rata-rata per pembacaan berada di antara 35,8 dan 38,7, yang menunjukkan pembacaan berkualitas baik. Kuantifikasi pasca-penyelarasan diterapkan pada model anotasi dan dinormalisasi berdasarkan parameter hitungan per juta (CPM) yang direkomendasikan. Analisis hilir mencakup analisis komponen utama (PCA), ekspresi gen diferensial (DESeq), pengelompokan hierarkis, ontologi gen (GO), dan analisis jalur.
Kuantifikasi Reproduktifitas Organoid
Koefisien variasi (CV), yang mengukur dispersi dari distribusi probabilitas, adalah metode yang umum digunakan untuk menilai reproduktifitas perkembangan organoid. [ 66 – 68 , 45 , 69 ] Untuk membandingkan reproduktifitas kardioid dalam kondisi kultur yang berbeda, CV = σ w /µ dihitung, di mana σ w adalah deviasi standar sampel, sedangkan µ adalah nilai rata-rata. Semakin tinggi koefisien variasi, semakin besar tingkat dispersi di sekitar rata-rata, tetapi reproduktifitasnya lebih rendah dalam sampel.
Analisis Statistik
Semua data disajikan sebagai rata-rata ± simpangan baku. Setidaknya tiga replikasi biologis dimasukkan dalam setiap kelompok untuk diferensiasi organoid yang berbeda. Beberapa organoid (6–15 organoid) dianalisis untuk setiap kelompok diferensiasi sebagai replikasi teknis. Statistik dianalisis menggunakan ANOVA satu arah dengan uji post-hoc Tukey. Semua analisis dilakukan menggunakan Prism 10 (GraphPad). Nilai p < 0,05 dianggap signifikan secara statistik.