Modifikasi Permukaan Langsung Epidermis Menggunakan Polydopamine yang Terinspirasi dari Kerang dengan Berbagai Fungsi Anti-Biofouling
Abstrak
Sifat permukaan epidermis sangat penting dalam perlekatan dan proliferasi patogen. Selain itu, kerusakan epidermis yang disebabkan oleh berbagai serangan fisik dan kimia menyediakan lingkungan yang baik untuk penetrasi dan proliferasi patogen melalui jaringan hidup internal yang terekspos. Modifikasi permukaan epidermis untuk memberikan sifat anti-biofouling dapat memberikan perlindungan yang efektif terhadap infeksi. Dalam penelitian ini, diperkenalkan metode mudah untuk memberikan beberapa fungsi anti-biofouling dengan memodifikasi langsung permukaan epidermis suatu organisme menggunakan dopamin, yang merupakan zat yang terinspirasi dari kerang. Polidopamin biokompatibel (PDA) diaplikasikan secara seragam pada permukaan organik dengan berbagai fitur morfologi dan energi permukaan, yang menunjukkan keserbagunaannya. Selain itu, keandalan modifikasi epidermis dengan PDA dikonfirmasi melalui pencegahan perubahan kronis yang diinduksi PDA pada impedansi epidermis. Yang terpenting, epidermis yang dimodifikasi PDA menunjukkan berbagai fungsi anti-biofouling, termasuk sifat antibakteri dan anti-adsorpsi terhadap bakteri dan mikroorganisme seluler/nonseluler. Sifat antibakteri yang lebih baik berhasil diwujudkan melalui integrasi dengan tobramycin, yang merupakan antibiotik representatif. Modifikasi permukaan langsung menggunakan PDA menawarkan pendekatan inovatif untuk melindungi permukaan biologis, khususnya epidermis manusia, terhadap berbagai patogen, dengan potensi untuk aplikasi pada plester medis dan perangkat yang ditempelkan pada kulit.
1 Pendahuluan
Kulit membentuk penghalang yang efektif antara bagian dalam dan luar suatu organisme, dan ia memperlihatkan berbagai fungsi perlindungan, [ 1 – 3 ] misalnya, epidermis melindungi individu dari ancaman fisik, seperti suntikan mekanis dan radiasi ultraviolet. [ 4 – 6 ] Ia juga mengatur permeabilitas dan mencegah hilangnya kelembapan yang berlebihan. [ 7 , 8 ] Di antara berbagai fungsi penghalang kulit, fungsinya sebagai penghalang imun biologis sangat penting, karena ia berhubungan langsung dengan kehidupan. Ia dapat mencegah penetrasi patogen dan memengaruhi adhesi dan proliferasi sel-sel organik. [ 9 ] Akan tetapi, penghalang kulit, khususnya epidermis, dapat dengan mudah rusak dan fungsinya memburuk oleh berbagai faktor, mulai dari serangan fisik, seperti goresan dan abrasi, hingga kondisi patologis, seperti dermatitis dan psoriasis. Terpaparnya jaringan internal karena kerusakan epidermis tidak hanya meningkatkan risiko penyakit yang disebabkan oleh agen infeksi eksternal, misalnya bakteri, [ 10 – 13 ] jamur, [ 14 ] dan virus, [ 15 – 17 ] tetapi juga menyebabkan berbagai masalah kesehatan, misalnya reaksi inflamasi dan penyakit kulit kronis. Wabah penyakit koronavirus 2019 (COVID-19) secara signifikan meningkatkan pentingnya melindungi kesehatan manusia dari sumber infeksi yang menyebar dengan cepat. Mengembangkan strategi baru untuk digunakan dalam modifikasi epidermis yang dapat mendukung fungsi penghalang biologis epidermis atau mengubah permukaan kulit untuk menyediakan berbagai fungsi anti-biofouling harus mengurangi risiko penyakit dan secara substansial meningkatkan kesehatan masyarakat.
Beberapa metode modifikasi permukaan tradisional, termasuk chemical vapor deposition (CVD) dan yang berdasarkan self-assembled monolayers (SAMs) [ 18 – 20 ] dan polymer brush coating, [ 21 – 26 ] berhasil mengubah kimia permukaan dan memberikan fungsi unik, seperti pencegahan kontaminasi, pembersihan sendiri, dan penolak air. Namun, beberapa tantangan tetap ada dalam menerapkan metode ini secara langsung ke permukaan organisme hidup, khususnya pada kulit telanjang atau epidermis, misalnya, meskipun proses larutan, seperti SAM dan polymer brush coating, menawarkan pendekatan sederhana dan serbaguna untuk modifikasi permukaan, mereka menimbulkan masalah yang tak terelakkan mengenai penggunaan pelarut organik karsinogenik, seperti heksana dan toluena. [ 27 – 30 ] Selain itu, teknik deposisi konvensional, seperti CVD dan atomic layer deposition, memerlukan lingkungan yang dikontrol secara ketat, seperti keadaan vakum, yang mengakibatkan universalitas rendah dan tantangan dalam aplikasi pada organisme hidup.
Dopamin, yang secara luas diakui sebagai zat yang memungkinkan kerang untuk melekat kuat pada batu, bahkan di lingkungan laut, menawarkan metode universal modifikasi permukaan. [ 31 – 33 ] Polimerisasi diri dopamin dapat diterapkan, terlepas dari sifat fisikokimia permukaan, termasuk bahan organik, [ 31 , 34 , 35 ] karena reaktivitas independen substrat dan ketersediaan air, yang menghasilkan pembentukan lapisan polidopamin (PDA). PDA memungkinkan modifikasi dan kontrol sederhana dari sifat permukaan melalui penerapan lapisan tipis pada skala nano, dan lebih jauh lagi, lapisan PDA dengan fungsi yang diinginkan dapat disiapkan melalui pasca-modifikasi dopamin untuk digunakan dalam berbagai aplikasi. [ 36 , 37 ] Akibatnya, PDA menarik minat yang besar karena potensinya untuk digunakan dalam modifikasi permukaan. [ 38 – 43 ]
Di sini, kami memperkenalkan metode mudah untuk memodifikasi epidermis organisme hidup secara langsung menggunakan polimer PDA yang terinspirasi dari kerang. Modifikasi permukaan langsung menggunakan PDA dapat diaplikasikan pada permukaan organik dengan berbagai fitur morfologi, termasuk kulit manusia dan permukaan tidak beraturan, seperti pori-pori dan bulu hidung. Strategi ini menunjukkan universalitas dalam modifikasi permukaan berbagai organisme dengan fitur morfologi dan energi permukaan yang berbeda, dan keandalannya dikonfirmasi melalui penekanan perubahan kronis pada epidermis dan pemeliharaan sifat permukaan yang stabil. Lebih jauh, beberapa fungsi anti-biofouling dari lapisan PDA ditunjukkan melalui reaktivitasnya dengan beberapa mikroorganisme. i) Ketika diaplikasikan secara langsung pada epidermis, lapisan PDA menunjukkan sifat antibakteri melalui inaktivasi mikroorganisme seluler, seperti Escherichia coli ( E. coli ). ii) Antibiotik tobramisin (TOB) diperkenalkan untuk membentuk lapisan TOB-PDA dan meningkatkan sifat antibakteri. iii) Lapisan PDA juga dapat memberikan fungsi anti-adsorpsi terhadap mikroorganisme nonseluler, khususnya sindrom pernapasan akut berat coronavirus-2 (SARS-CoV-2), berkenaan dengan epidermis. Modifikasi epidermis langsung menggunakan lapisan PDA harus menjadi strategi biomedis universal yang dapat meningkatkan kesehatan masyarakat melalui pencegahan infeksi, di luar modifikasi kimia permukaan. Perbandingan ringkas dari studi pelapisan PDA dan pelapisan biokompatibel sebelumnya disediakan (Tabel S1 , Informasi Pendukung), yang menggarisbawahi aplikasi epidermis langsung, pembentukan lapisan yang sangat tipis, kompatibilitas substrat yang luas, dan sifat anti-biofouling multifungsi dari pendekatan saat ini.
2 Hasil dan Pembahasan
2.1 Modifikasi Permukaan Langsung Epidermis dengan PDA
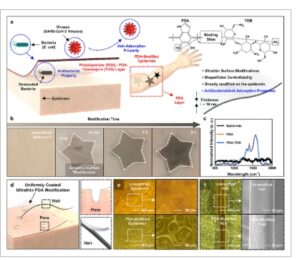
Gambar 1a menunjukkan skema modifikasi permukaan langsung epidermis dengan lapisan tipis PDA yang berasal dari kerang. PDA dapat memfasilitasi perlekatan semipermanen dari dua antarmuka yang berbeda melalui ikatan fisikokimia yang kuat, sehingga memungkinkan pembentukan lapisan PDA langsung pada epidermis. Modifikasi permukaan dengan lapisan PDA dapat menimbulkan kekhawatiran mengenai keamanan biokimia ketika diterapkan pada permukaan organik, khususnya epidermis manusia. Namun, air dapat digunakan sebagai pelarut dalam polimerisasi dopamin, dan bubuk dopamin pada dasarnya juga merupakan zat organik tidak berbahaya yang berasal dari organisme hidup, yang memastikan tidak berbahaya dan aman terhadap tubuh manusia. Lapisan PDA yang dihasilkan dapat membentuk film yang sangat tipis, dengan ketebalan yang dapat dikontrol pada skala nano, pada epidermis. Bentuk dan warna lapisan PDA juga dapat dengan mudah disesuaikan dengan mengendalikan polimerisasi sesuai dengan kebutuhan pengguna. Selain itu, kami mengungkap untuk pertama kalinya dalam studi ini bahwa lapisan PDA sangat tipis yang diaplikasikan langsung ke epidermis menunjukkan berbagai fungsi anti-biofouling, termasuk inaktivasi mikroorganisme seluler, misalnya, E. coli , dan fungsi anti-adsorpsi terhadap mikroorganisme nonseluler, misalnya, SARS-CoV-2.
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
a) Skema modifikasi permukaan langsung epidermis menggunakan lapisan PDA dan PDA-TOB yang sangat tipis dan fungsi serta tempat pengikatannya. b) Modifikasi epidermis yang dimodifikasi PDA secara lokal menggunakan waktu polimerisasi yang berbeda. c) Spektrum Raman epidermis polos dan yang dimodifikasi PDA dan PDA-TOB. d) Skema lapisan PDA yang sangat tipis yang dilapisi secara merata pada pori-pori dan rambut. e) Gambar mikroskop optik epidermis yang tidak dimodifikasi dan yang dimodifikasi PDA dengan pori-pori. f) Gambar mikroskop optik (kiri) dan mikroskop elektron pemindaian (kanan) rambut yang tidak dimodifikasi dan yang dimodifikasi PDA.
Permukaan kulit manusia dimodifikasi secara langsung menggunakan lapisan PDA. Khususnya, strategi kami tidak hanya menyediakan metode sederhana yang dapat diaplikasikan secara seragam pada area yang luas, tetapi juga memungkinkan pembuatan pola yang diinginkan melalui aplikasi selektif PDA pada area yang terlokalisasi, misalnya, ketika lapisan diaplikasikan dalam bentuk yang kompleks, seperti bintang, lapisan PDA hanya tumbuh di dalam area yang ditentukan seiring dengan bertambahnya waktu polimerisasi (Gambar 1b ). Hal ini menunjukkan bahwa strategi ini dapat menyediakan lapisan pelindung pada area yang memerlukan aplikasi selektif, seperti luka, yang mungkin menjadi jalur infeksi biologis. Selain itu, aplikasi pada area tertentu memungkinkan pengguna untuk menyesuaikan bentuk lapisan PDA, mirip dengan tato, sehingga menambahkan fungsi kosmetik. Selanjutnya, spektroskopi Raman dilakukan untuk mengonfirmasi keberhasilan modifikasi epidermis menggunakan lapisan PDA. Sementara itu, dengan memanfaatkan skalabilitas dopamin, yang mendukung reaksi dengan berbagai spesies organik untuk mewujudkan fungsi yang diinginkan, PDA dikombinasikan dengan antibiotik TOB untuk menghasilkan lapisan TOB-PDA, yang juga dikarakterisasi. Spektroskopi Raman mengonfirmasi bahwa puncak Raman yang terdeteksi dalam spektrum epidermis yang diobati dengan PDA dan TOB-PDA konsisten dengan puncak Raman intrinsik yang dilaporkan sebelumnya yang mewakili PDA murni, yang menunjukkan bahwa lapisan PDA berhasil memodifikasi permukaan epidermis (Gambar 1c ). [ 37 ] Lebih jauh lagi, strategi ini berpotensi diperluas ke substrat dengan fitur morfologi yang bervariasi—seperti pori-pori kulit dan rambut—dan mungkin cocok untuk permukaan yang melengkung atau tidak rata, seperti yang diilustrasikan dalam Gambar 1d . Perubahan morfologi pada epidermis yang tidak rata dan permukaan rambut yang disebabkan oleh lapisan PDA diamati menggunakan mikroskop optik. Sebuah film tipis polimer dibentuk untuk menghaluskan medan epidermis yang tidak rata (Gambar 1e ). Demikian pula, ketika rambut tidak dimodifikasi dengan PDA, kutikula terlihat jelas, tetapi kerutan permukaan yang disebabkan oleh kutikula rambut dikurangi melalui modifikasi PDA (Gambar 1f ).
2.2 Universalitas Modifikasi Permukaan Langsung dengan PDA
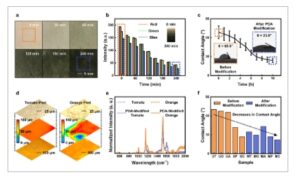
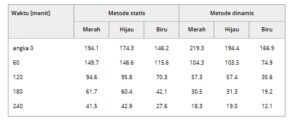
Metode statis merupakan strategi representatif untuk digunakan dalam pembentukan lapisan PDA, dan telah diadopsi dalam modifikasi permukaan langsung menggunakan PDA. Metode ini melibatkan perendaman sampel dalam larutan PDA selama durasi yang memadai untuk memodifikasi permukaan, dan metode ini menunjukkan keunggulan berupa kesederhanaan dan aksesibilitas. Selain keunggulan ini, modifikasi permukaan langsung menggunakan metode statis merupakan strategi universal yang dapat mengendalikan tingkat modifikasi permukaan. Selain itu, modifikasi permukaan langsung menggunakan metode statis dapat diterapkan pada berbagai permukaan organik dengan karakteristik morfologi dan energi yang berbeda dari epidermis. Gambar 2a menunjukkan gambar optik yang menggambarkan perubahan warna epidermis babi yang dilapisi dengan lapisan tipis PDA dari waktu ke waktu dengan interval 30–60 menit. Saat waktu modifikasi meningkat, ketebalan dan penyerapan cahaya lapisan meningkat, menghasilkan warna yang lebih gelap. Selain itu, metode kolorimetri digunakan untuk menganalisis secara kuantitatif penyerapan cahaya epidermis yang dimodifikasi PDA. Transmisi cahaya merah, hijau, dan biru (RGB) diukur pada interval 60 menit, dan mereka menurun secara linear seiring dengan peningkatan waktu pelapisan, yang menunjukkan bahwa ketebalan lapisan meningkat secara linear seiring waktu (Gambar 2b dan Tabel 1 ). Sudut kontak air diukur untuk memverifikasi perubahan energi permukaan karena lapisan PDA (Gambar 2c ). PDA dapat memberikan hidrofilisitas pada suatu objek, terlepas dari sifat permukaannya. Sudut kontak antara substrat yang diaplikasikan PDA dan tetesan air menurun saat polimerisasi berlangsung dan mencapai saturasi setelah ≈10 jam polimerisasi. Saturasi sudut kontak harus berasal dari peningkatan ketebalan lapisan PDA. Selama tahap awal, film ultratipis terbentuk pada tingkat satu lapisan, mempertahankan efek epidermis pada energi permukaan, yang dikenal sebagai transparansi pembasahan. [ 44 ] Namun, seiring dengan meningkatnya waktu polimerisasi, ketebalan lapisan PDA juga meningkat, dan pengaruh epidermis pada energi permukaan berkurang, yang menyebabkan sifat hidrofilisitas. Selain itu, perbedaan 20° antara sudut kontak maju dan mundur menunjukkan bahwa lapisan PDA yang tipis memungkinkan modifikasi permukaan yang seragam dan tahan lama, yang disebabkan oleh modifikasi kimianya dan efek penghalusan permukaan (Gambar S1 , Informasi Pendukung). Selanjutnya, universalitas metode ini dikonfirmasi dengan memodifikasi langsung permukaan berbagai bahan organik dengan perbedaan signifikan dalam morfologi dan energi permukaan. Seperti yang digambarkan dalam profil 3D yang ditunjukkan pada Gambar 2d, lapisan PDA diaplikasikan pada permukaan tomat dan jeruk yang relatif halus dan kasar. Hasilnya, spektrum Raman dari permukaan tomat dan jeruk yang dimodifikasi PDA menunjukkan puncak karakteristik yang sesuai dengan PDA murni, termasuk yang terkait dengan ikatan C═C pada ≈1590 cm −1 dan struktur fenol atau katekol pada ≈1180 cm −1 , masing-masing, terlepas dari kekasaran permukaan (Gambar 2e ). Selain itu, pengukuran sudut kontak mengonfirmasi bahwa berbagai permukaan organik, yaitu epidermis tomat (T), jeruk (O), apel (A), dan babi (P) dan ayam (C), yang menunjukkan perbedaan signifikan dalam energi permukaan, menampilkan karakteristik hidrofilik setelah modifikasi PDA, dengan penurunan substansial dalam perbedaan energi permukaan. Hasil-hasil ini menunjukkan bahwa strategi tersebut kuat, universal, dan dapat diterapkan terlepas dari karakteristik morfologi dan energi permukaan (Gambar S2–S4 , Informasi Pendukung). Khususnya, daun yang dimodifikasi PDA dan TOB-PDA juga efektif mencegah akses serangga, yang menunjukkan bahwa modifikasi permukaan langsung melalui lapisan PDA merupakan strategi praktis untuk digunakan dalam mengubah sifat permukaan berbagai sistem (Gambar S5 , Informasi Pendukung).
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
a) Gambar mikroskop optik epidermis yang dimodifikasi menggunakan PDA melalui metode statis dari waktu ke waktu. b) Karakteristik transmitansi cahaya RGB melalui lapisan PDA dengan waktu modifikasi yang berbeda. c) Perubahan energi permukaan epidermis yang dimodifikasi PDA dengan waktu modifikasi berdasarkan sudut kontak air ( n = 6, batang galat menunjukkan nilai rata-rata ± SD). d) Analisis kekasaran permukaan tomat (kiri) dan jeruk (kanan) yang dimodifikasi PDA menggunakan profil optik 3D dan mikroskop optik. e) Spektrum Raman permukaan tomat dan jeruk yang dimodifikasi PDA. f) Perubahan energi permukaan beberapa permukaan organik, termasuk tomat, jeruk, dan apel serta epidermis babi dan ayam, sebelum dan sesudah modifikasi PDA.
Tabel 1. Transmisi cahaya RGB setelah modifikasi PDA statis dan dinamis.
2.3 Keandalan Modifikasi Permukaan Langsung dengan PDA
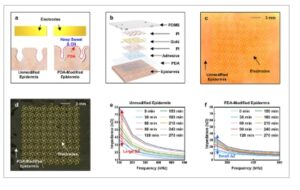
Sifat permukaan atau impedansi epidermis berubah secara kronis karena berbagai sekresi tubuh, seperti keringat dan minyak. Dengan demikian, verifikasi apakah epidermis yang dimodifikasi secara langsung dengan lapisan PDA dapat mempertahankan kimia dan fungsi permukaannya, meskipun terjadi perubahan kronis ini, diperlukan. Lapisan PDA yang diaplikasikan secara seragam pada permukaan kulit yang melengkung harus berfungsi sebagai penghalang terhadap sekresi cairan tubuh untuk meminimalkan gangguan biosignal dan mempertahankan homeostasis sifat permukaan epidermis, seperti yang ditunjukkan pada Gambar 3a . Untuk menunjukkan keandalan modifikasi permukaan langsung dengan PDA, perangkat yang dapat dikenakan biomedis yang terintegrasi dengan lapisan PDA dibuat, dan Gambar 3b menunjukkan skema berlapis dari perangkat yang dapat dikenakan yang ditumpuk pada lapisan PDA. Perangkat yang dapat dikenakan biomedis dirancang untuk memantau indikator kesehatan secara terus-menerus dan akurat, seperti impedansi. Gambar optik dari perangkat yang dapat dikenakan yang melekat pada epidermis yang telanjang dan yang diaplikasikan PDA ditunjukkan pada Gambar 3c,d , masing-masing, yang mengonfirmasi perlekatan yang tepat dalam kedua kasus. Untuk memverifikasi efek lapisan PDA pada variasi impedansi perangkat yang dapat dikenakan, impedansi diukur dalam rentang frekuensi 0–1 MHz pada interval 30 menit selama 270 menit. Gambar 3e,f menunjukkan perubahan impedansi perangkat yang dapat dikenakan yang masing-masing dipasang pada epidermis polos dan epidermis yang dipasang pada PDA. Dalam kedua kasus, impedansi meningkat seiring waktu, dengan perubahan yang lebih besar diamati di wilayah frekuensi rendah. Impedansi epidermis polos bervariasi dari minimum 10 kΩ (pada 1 MHz) hingga maksimum 50 kΩ (pada 1 Hz). Sebaliknya, impedansi epidermis yang dipasang pada PDA menunjukkan variasi yang lebih sedikit, berkisar dari minimum 6 kΩ (pada 1 MHz) hingga maksimum 25 kΩ (pada 1 Hz). Perubahan yang diminimalkan dalam impedansi epidermis yang diaplikasikan pada PDA menunjukkan bahwa lapisan PDA dapat menekan variasi impedansi dengan meminimalkan efek faktor eksternal yang mengganggu pengukuran perangkat yang dapat dikenakan. Hal ini menunjukkan bahwa modifikasi permukaan langsung dengan PDA merupakan strategi yang andal dan stabil untuk digunakan dalam memodifikasi kimia dan sifat permukaan (Gambar S6 , Informasi Pendukung).
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
a) Skema lapisan PDA sebagai lapisan penghalang bagi homeostasis permukaan epidermis. b) Skema perakitan perangkat yang dapat dikenakan yang ditumpuk pada lapisan PDA untuk mengukur impedansi epidermis. c,d) Gambar optik perangkat pengukuran impedansi yang dipasang pada epidermis c) yang tidak dimodifikasi dan d) yang dimodifikasi PDA. e,f) Perubahan impedansi epidermis e) yang tidak dimodifikasi dan f) yang dimodifikasi PDA berdasarkan frekuensi dan waktu.
2.4 Fungsi Antibakteri Terhadap Mikroorganisme Seluler
Sejumlah penelitian menunjukkan bahwa permukaan objek yang dilapisi dengan lapisan PDA menunjukkan aktivitas antibakteri terhadap mikroorganisme seluler. [ 44 ] Dalam konteks ini, modifikasi langsung sistem kulit manusia menggunakan PDA dapat memberikan sifat antibakteri. Namun, penelitian ini merupakan demonstrasi pertama dari modifikasi langsung sistem kulit manusia menggunakan PDA, yang memerlukan konfirmasi apakah PDA yang diaplikasikan pada epidermis menunjukkan karakteristik antibakteri. Gambar 4a menunjukkan skema sifat antibakteri epidermis yang diobati dengan PDA terhadap E. coli , yang merupakan mikroorganisme seluler yang representatif. Dibandingkan dengan epidermis telanjang, epidermis yang diaplikasikan dengan PDA dan TOB-PDA secara aktif menonaktifkan bakteri. TOB, yang banyak digunakan di lembaga medis karena sifat antibakteri intrinsiknya, harus menunjukkan karakteristik antibakteri yang lebih baik melalui efek sinergis ketika dikombinasikan dengan PDA. Dua mekanisme mendukung aktivitas antibakteri aktif-kontak (Gambar 4b ) . Salah satu yang mirip dengan mekanisme antibakteri beberapa polifenol alami, seperti asam tanat, didasarkan pada gugus katekol PDA. Katekol dapat mengkelat ion logam yang diperlukan untuk aktivitas fisiologis normal bakteri, selain beberapa protein heteromerik khusus pada membran sel mereka, yang mengganggu metabolisme fisiologis normal bakteri, dan dengan demikian, struktur bakteri runtuh. [ 45 – 47 ] Mekanisme antibakteri potensial lainnya adalah sebagai berikut: sifat antibakteri PDA dapat dikaitkan dengan gugus amina protiknya, karena interaksi antara gugus fungsi bermuatan positif dan dinding sel bakteri menginduksi interaksi elektrostatik, yang menyebabkan lisis bakteri dan pelepasan isi sel. [ 48 , 49 ] Meskipun muatan permukaan total membran PDA negatif pada pH > 4, amina terprotonasi masih terjadi di dalam PDA. Disosiasi amino secara kualitatif terkait dengan kapasitas bakterisida PDA, dan penerapan lapisan PDA pada E. coli menghasilkan efek penghambatan >99%. Lebih jauh, gugus katekol dalam PDA memfasilitasi pembentukan spesies oksigen reaktif (ROS) melalui reaksi transfer elektron. [ 50 ]ROS ini menghambat aktivitas seluler bakteri dan berkontribusi pada sifat antimikrobanya. Selama auto-oksidasi, gugus katekol dalam polidopamin berubah menjadi radikal semikuinon dan kuinon, menghasilkan ROS seperti anion superoksida dan hidrogen peroksida (H₂O₂) sebagai produk sampingan. H₂O₂, agen antimikroba yang terkenal, dilepaskan secara terus-menerus selama polimerisasi diri dopamin, menunjukkan aktivitas antimikroba spektrum luas terhadap bakteri Gram-positif dan Gram-negatif. [ 51 ] Karena ROS menimbulkan stres oksidatif pada bakteri, akumulasinya dapat menyebabkan putusnya untai DNA, peroksidasi lipid, dan bentuk kerusakan seluler lainnya, yang pada akhirnya mengakibatkan kerusakan bakteri. [ 52 ] Menerapkan PDA pada bakteri tidak hanya memungkinkan kontak penuh dengan permukaan bakteri tetapi juga mengendalikan pembelahan bakteri dan menghambat metabolisme normal. Untuk memverifikasi fungsi antibakteri dari lapisan PDA, perilaku E. coli pada epidermis diselidiki (lihat Bagian Eksperimen untuk detailnya). Gambar 4c menunjukkan gambar koloni E. coli yang diencerkan pada berbagai konsentrasi yang diperoleh menggunakan pour plating. [ 53 ] Istilah dip-inokulasi (DI) 1, 2, dan 3 menunjukkan jumlah pengenceran, dan penelitian dilakukan dengan penyesuaian yang tepat. Representasi visual mengonfirmasi sifat antibakteri. Akibatnya, epidermis yang diobati dengan agen PDA antibakteri menunjukkan perbedaan yang signifikan dalam jumlah sel E. coli hidup dibandingkan dengan epidermis polos. Gambar 4d menunjukkan grafik hasil hitungan saat E. coli hidup diaplikasikan pada epidermis polos (UE) dan PDA- (PE) dan TOB-PDA-modified (T-PE) menggunakan pour plating dalam analisis kuantitatif sifat antibakteri. Jumlah E. coli hidup pada epidermis polos adalah 6,1 ± 0,5 log CFU/mL. Sebaliknya, epidermis yang diobati menunjukkan jumlah E. coli hidup yang jauh lebih sedikit , dengan nilai 4,1 ± 0,5 dan 0 log CFU/mL, yang menunjukkan aktivitas antibakteri masing-masing >99% dan 100%. Analisis varians satu arah menunjukkan perbedaan signifikan dalam kelangsungan hidup E. coli berdasarkan jenis pelapis yang diterapkan ( p < 0,05). Gambar 4emenunjukkan hasil difusi cakram, di mana bakteri bertemu dengan larutan TOB-PDA atau PDA atau gel pembersih tangan di bagian tengah. Diameter area yang menghambat pertumbuhan bakteri dari larutan TOB-PDA dan PDA serta gel pembersih tangan masing-masing adalah 3,13, 1,57, dan 1,71 cm, dan dengan demikian, diameter terkecil diamati menggunakan larutan PDA. Akan tetapi, hasil difusi cakram mengesampingkan konsep keberlanjutan, dan dengan demikian, meskipun aktivitas antibakteri larutan PDA dan pembersih tangan serupa, hasil ini sesuai untuk tujuan penelitian kami.
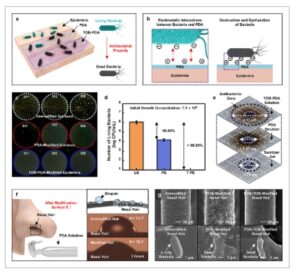
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
a) Skema tingkat kelangsungan hidup bakteri ( E. coli ) pada tiga jenis permukaan kulit: epidermis yang tidak dimodifikasi dan yang dimodifikasi dengan PDA dan TOB-PDA. b) Skema mekanisme yang mendasari sifat antibakteri PDA. c) Gambar mikroskop optik jumlah koloni bakteri pada berbagai konsentrasi. d) Aktivitas antibakteri terhadap E. coli pada epidermis yang tidak dimodifikasi (UE) dan dilapisi dengan PDA (PE) dan TOB-PDA (T-PE), berdasarkan pelapisan tuang ( n = 5, batang galat menunjukkan nilai rata-rata ± SD). e) Gambar mikroskop optik zona penghambatan antibakteri larutan TOB-PDA (atas) dan PDA (tengah) serta gel pembersih (bawah). f) Skema modifikasi rambut hidung dengan PDA dan sudut kontak air pada rambut hidung yang dimodifikasi dengan PDA. g) Gambaran mikroskop elektron pemindaian disfungsi bakteri pada rambut hidung yang tidak dimodifikasi (kiri) dan yang dimodifikasi PDA (tengah) dan TOB-PDA (kanan).
Berbagai bakteri dan virus dapat menginfeksi tidak hanya epidermis, tetapi juga tangan dan sistem pernapasan. Baru-baru ini, banyak penelitian dilakukan untuk menghambat infeksi dengan menyemprotkan larutan profilaksis ke dalam hidung. Dalam konteks ini, kami menerapkan PDA pada rambut hidung untuk mengevaluasi efektivitasnya dalam mencegah infeksi bakteri melalui sistem pernapasan (Gambar 4f ). Meskipun tingkat kelengkungan rambut hidung, penerapan PDA untuk waktu yang cukup menurunkan sudut kontak, mirip dengan hasil yang diamati pada permukaan epidermis yang datar. Ini menunjukkan pembentukan lapisan PDA yang seragam pada rambut hidung. Mikroskop elektron pemindaian (SEM) juga mengonfirmasi keberadaan bakteri hidup pada rambut hidung yang telanjang, tetapi kerusakan dan disfungsi bakteri diamati pada rambut hidung yang dimodifikasi PDA dan TOB-PDA, yang dengan jelas menunjukkan pengaruh modifikasi permukaan pada kelangsungan hidup bakteri (Gambar 4g ).
2.5 Fungsi Antiadsorpsi Terhadap Mikroorganisme Nonseluler
Di antara berbagai rute infeksi SARS-CoV-2, yang merupakan mikroorganisme nonseluler menular yang representatif, jalur yang dimediasi kulit sering kali diabaikan. Mempertimbangkan masa hidup SARS-CoV-2 yang panjang pada berbagai permukaan, [ 54 ] pengembangan lapisan anti-adsorpsi virus yang tahan lama yang dapat langsung diaplikasikan ke tubuh manusia menarik perhatian sebagai metode untuk meminimalkan infeksi virus. Dalam hal ini, kapasitas epidermis yang dimodifikasi PDA untuk memberikan karakteristik anti-adsorpsi terhadap mikroorganisme nonseluler, seperti SARS-CoV-2, diselidiki untuk menentukan apakah ini dapat berfungsi sebagai strategi anti-biofouling yang komprehensif (lihat detail di Bagian Eksperimen ). Gambar 5a menunjukkan skema studi anti-adsorpsi terhadap SARS-CoV-2 dalam tiga kondisi: epidermis polos dan epidermis yang dimodifikasi PDA dan TOB-PDA, bersama dengan gambar mikroskop elektron transmisi kriogenik dari SARS-CoV-2 yang digunakan dalam studi ini. Protein lonjakan SARS-CoV-2 juga terdeteksi di permukaan (Gambar 5b ), dan Gambar 5c menunjukkan skema studi adsorpsi SARS-CoV-2. Untuk mengukur tingkat adsorpsi virus pada permukaan epidermis di bawah kondisi modifikasi yang berbeda, kami mensimulasikan lingkungan infeksi dengan menyemprotkan larutan virus ke epidermis babi. Selanjutnya, permukaan dicuci secara menyeluruh dengan air deionisasi, dan jumlah virus yang teradsorpsi dihitung dengan mengukur tingkat protein nukleokapsid menggunakan uji imunosorben terkait enzim (ELISA). Metode ini menunjukkan linearitas yang baik (R2 = 0,9977), yang menunjukkan keandalannya (Gambar 5d ). Gambar 5e menunjukkan hasil studi adsorpsi virus menggunakan epidermis dengan kondisi permukaan yang berbeda. Dibandingkan dengan epidermis telanjang, epidermis yang dimodifikasi PDA dan TOB-PDA menunjukkan tingkat adsorpsi virus yang berkurang secara signifikan masing-masing sebesar 30% dan 55%, yang menunjukkan kapasitas anti-adsorpsi kedua lapisan. Khususnya, perilaku penyerapan yang diamati agak berlawanan dengan intuisi, karena PDA merupakan bahan perekat. Hal ini mungkin disebabkan oleh gugus fungsi katekolamin yang melekat pada permukaan PDA dan interaksinya yang kuat dengan membran lipid virus. Gugus katekolamin menstabilkan membran virus saat kontak, sebagaimana dibuktikan lebih lanjut oleh percobaan yang menunjukkan bahwa pemblokiran gugus ini dengan EDTA (asam etilen-diamin-tetraasetat), penghambat pengikatan katekol, secara signifikan mengurangi pengikatan virus (Gambar S7 , Informasi Pendukung). [ 55 ]Dengan demikian, ketika virus bertemu dengan permukaan PDA, membran lipidnya tertambat ke permukaan dan rentan pecah di bawah gaya geser. Akibatnya, pengamatan kami kemungkinan dipengaruhi oleh langkah pembilasan air yang ketat, yang dapat menyebabkan membran virus pecah dan melepaskan protein N sebelum ELISA (Gambar S8 , Informasi Pendukung). Tingkat adsorpsi virus pada epidermis yang dimodifikasi TOB-PDA setelah pembilasan air harus lebih tinggi daripada pada epidermis yang dimodifikasi PDA murni. Ini karena TOB harus berinteraksi dengan sebagian besar gugus fungsi katekolamin yang tersedia dari PDA yang dapat menstabilkan virus. Oleh karena itu, TOB-PDA memberikan adhesi virus yang lemah, yang mengarah pada berkurangnya pecahnya membran virus selama langkah pencucian dan retensi virus utuh yang lebih tinggi di permukaan. Bahasa Indonesia: Untuk menyelidiki lebih lanjut mekanisme yang mendasari adsorpsi SARS-CoV-2 yang tinggi pada epidermis telanjang, kami berhipotesis bahwa reseptor SARS-CoV-2 (enzim pengubah angiotensin 2, ACE2) sangat penting dalam adsorpsi epidermis dan melakukan penelitian yang sesuai. [ 56 ] Untuk menentukan apakah adsorpsi SARS-CoV-2 bergantung pada kepadatan permukaan ACE2, kami melakukan ELISA dengan ACE2 sebagai probe penangkap pada konsentrasi yang berbeda, seperti yang ditunjukkan pada Gambar 5f . Gambar 5g menunjukkan bahwa jumlah SARS-CoV-2 yang diadsorpsi sebanding dengan kepadatan permukaan ACE2. Akibatnya, adsorpsi SARS-CoV-2 yang lebih tinggi pada epidermis telanjang dapat dikaitkan dengan kepadatan ACE2 yang lebih tinggi pada epidermis telanjang. Untuk memvisualisasikan adsorpsi SARS-CoV-2, kami memperkenalkan protein anti-spike terkonjugasi titik kuantum dan melakukan studi adsorpsi. Gambar 5h menunjukkan gambar mikroskopi fluoresensi epidermis polos dan epidermis yang dimodifikasi PDA dan TOB-PDA setelah studi adsorpsi. Warna merah yang relatif terang hanya diamati pada epidermis polos, yang menunjukkan bahwa kedua modifikasi tersebut efektif, dengan lapisan PDA secara signifikan mengurangi adsorpsi SARS-CoV-2. Gambar 5i menunjukkan skema hipotetis adsorpsi SARS-CoV-2 pada epidermis polos dan epidermis yang dimodifikasi PDA dan TOB-PDA. Sebagai kesimpulan, prinsip yang mendasari mekanisme anti-adsorpsi adalah cakupan reseptor ACE2 pada permukaan oleh kedua lapisan, yang secara efektif memblokir tempat pengikatan SARS-CoV-2 dan mencegah adsorpsi virus. Perlunya lapisan TOB-PDA mungkin dipertanyakan, karena lapisan ini menunjukkan sifat anti-adsorpsi yang agak buruk terhadap virus dibandingkan dengan lapisan PDA murni. Namun, lapisan TOB-PDA seharusnya berharga dalam strategi anti-biofouling komprehensif yang secara bersamaan dapat mencegah infeksi oleh mikroorganisme seluler dan nonseluler karena lapisan ini menunjukkan sifat antibakteri dan virus yang sangat baik.
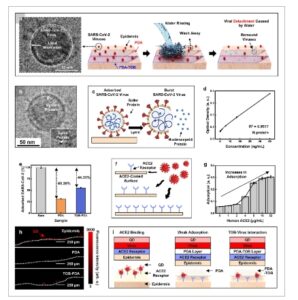
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
a) Gambar mikroskop elektron kriotransmisi SARS-CoV-2 dan skema virus yang teradsorpsi pada epidermis yang tidak dimodifikasi (atas) dan yang dimodifikasi PDA (tengah) dan TOB-PDA (bawah) sebelum dan sesudah pembilasan air. b) Gambar mikroskop lapisan lipid dwilapis dan protein spike yang utuh di permukaan (inset). c) Skema lisis SARS-CoV-2. d) Hasil uji immunosorbent terkait enzim (ELISA) SARS-CoV-2 menggunakan protein N ( n = 3, batang galat menunjukkan nilai rata-rata ± SD). e) Hasil adsorpsi pada epidermis yang tidak dimodifikasi dan yang dimodifikasi PDA dan TOB-PDA setelah pembilasan air ( n = 3, batang galat menunjukkan nilai rata-rata ± SD). f) Skema studi adsorpsi virus. g) Hasil studi adsorpsi virus permukaan bergantung ACE-2 terhadap adsorpsi SARS-CoV-2 ( n = 3, batang kesalahan menggambarkan nilai rata-rata ± SD). h) Gambaran mikroskop fluoresensi epidermis polos dan yang dimodifikasi PDA dan TOB-PDA setelah studi adsorpsi. i) Skema hipotetis adsorpsi SARS-CoV-2 pada epidermis yang tidak dimodifikasi dan yang dimodifikasi PDA dan TOB-PDA.
3 Kesimpulan
Dalam studi ini, kami memperkenalkan metode mudah untuk memodifikasi epidermis organisme hidup secara langsung menggunakan lapisan PDA yang terinspirasi dari kerang. Memodifikasi epidermis secara langsung dengan lapisan PDA adalah strategi biokompatibel yang dimungkinkan melalui pemanfaatan larutan yang tidak berbahaya. [ 57 , 58 ] Lapisan PDA memberikan cakupan yang seragam pada skala nano, dan menunjukkan universalitas karena dapat langsung diaplikasikan pada permukaan organik dengan berbagai fitur morfologi dan karakteristik permukaan. Selain itu, keandalan lapisan PDA ditunjukkan, karena sifat permukaan epidermis yang dirawat dengan PDA dipertahankan untuk periode yang cukup lama. Lebih jauh, lapisan PDA yang dilapisi pada permukaan organik bereaksi dengan berbagai entitas biologis, yang menunjukkan berbagai kapasitas anti-biofouling-nya. Ini termasuk i) sifat antibakteri terhadap mikroorganisme seluler dan ii) sifat anti-adsorpsi terhadap mikroorganisme nonseluler. Selain itu, aktivitas antibakteri lapisan PDA ditingkatkan ketika dikombinasikan dengan TOB, yang merupakan antibiotik representatif. Ringkasan atribut utama dari teknologi perlindungan epidermal yang ada disajikan (Tabel S2 , Informasi Pendukung), yang menunjukkan bahwa tidak ada alat sebelumnya yang menggabungkan modifikasi epidermal langsung dengan pelapis berskala nanometer dan fungsi antibakteri/antivirus yang komprehensif. Modifikasi permukaan menggunakan lapisan PDA merupakan metode serbaguna untuk melindungi permukaan biologis, khususnya epidermis manusia, dari patogen, sekaligus memungkinkan fungsionalitas khusus pengguna, dengan harapan untuk aplikasi pada patch medis, perangkat pintar yang dapat dikenakan, dan sensor yang menempel di kulit.
4 Bagian Eksperimen
Persiapan dan Karakterisasi Sampel
Epidermis babi (Hypork, Anseong, Republik Korea), apel (Freshine, Republik Korea), jeruk (Sunkist Growers, Valencia, CA, AS), dan tomat (Gwangsik’s Farm, Republik Korea) dipotong menjadi struktur kubik dengan dimensi 1,5 × 1,5 × 0,5 cm. Kulit leher ayam (Modern Food, Republik Korea) dipotong menjadi dimensi 1,5 × 1,5 × 0,1 cm, dan kulit kepala serta rambut hidung manusia yang diperoleh dari seorang penulis (SE Lee) dan daun ( Brassica oleracea var. acephala ) digunakan sebagai spesimen. Penggunaan sampel rambut dalam penelitian ini dikecualikan dari tinjauan etik oleh dewan peninjau kelembagaan DGIST (DGISTIRB-202505-001), dan tidak memerlukan persetujuan.
Spektroskopi Raman
Spektroskopi Raman dilakukan menggunakan mikroskop Raman inVia Qontor (Renishaw, Wotton-under-Edge, Inggris) dengan laser eksitasi 532 nm, mencakup rentang spektral 500–2500 cm⁻ 1 . [ 59 – 68 ]
Persiapan Kultur Bakteri
Kultur kerja E. coli (ATCC 25922; Korean Culture Center of Microorganisms, Seoul, Republik Korea) dikumpulkan dengan cara mengikis sebagian kultur pada agar kedelai triptik (TSA, Becton, Dickinson and Company, Franklin Lakes, NJ, AS) dan memindahkannya ke dalam 9 mL kaldu kedelai triptik (TSB, Becton, Dickinson and Company). Sel-sel diinkubasi pada suhu 37 °C selama 24 jam, kemudian dipindahkan ke TSB baru menggunakan loop dan diinkubasi pada suhu 37 °C selama 24 jam. Terakhir, konsentrasi akhir E. coli yang dikultur berkisar antara 8,5 hingga 9,0 log CFU/mL.
DI
Suspensi E. coli sebanyak 5,7 ± 0,2 log CFU/mL diperoleh dengan memindahkan bakteri ke dalam 9 mL air pepton. Aktivitas antibakteri dievaluasi dengan merendam sampel dalam suspensi bakteri selama 4 jam.
Uji Adhesi Bakteri
Untuk memeriksa sifat antibakteri dari pelapis, suspensi bakteri disiapkan pada konsentrasi 5,7 ± 0,2 log CFU/mL. Sampel referensi dan sampel yang dilapisi direndam dalam 9 mL suspensi bakteri selama 4 jam dan kemudian diangkat. [ 69 – 71 ] Pelapisan tuang digunakan untuk menilai metode pelapisan tuang dan difusi cakram. Untuk hitungan pelat, suspensi bakteri hidup diencerkan dalam air pepton 0,1% (b/v). Setelah pengenceran tiga kali lipat suspensi bakteri dalam air pepton dan menetes ke TSA, bakteri diinkubasi selama 24 jam dalam kondisi aerobik pada suhu 37 °C. Dalam difusi cakram, 50 µL bahan antibakteri diteteskan di bagian tengah pelat yang memuat suspensi bakteri yang mengandung TSA pada konsentrasi 5,7 ± 0,2 log CFU/mL. Pelat kemudian diinkubasi selama 24 jam dalam kondisi aerobik pada suhu 37 °C. Untuk meningkatkan keandalan hasil, setiap percobaan dilakukan lima kali dan nilai rata-ratanya dicatat.
SEM Bakteri yang Menempel pada Rambut
Bakteri yang menempel pada rambut diperiksa menggunakan SEM, dan sampel direndam dalam suspensi bakteri selama 4 jam. Sebagai persiapan untuk digunakan dalam SEM, bakteri dinonaktifkan menggunakan etil alkohol (Samchun Pure Chemical, Pyeongtaek, Republik Korea), dan lapisan tipis (14 nm) Pt diendapkan pada permukaan sampel untuk memastikan konduktivitas listrik yang dibutuhkan untuk SEM.
Koleksi SARS-CoV-2
SARS-CoV-2 yang diinaktifkan disediakan oleh Pusat Pengendalian dan Pencegahan Penyakit Korea (Cheongju, Republik Korea). Usap tenggorokan pasien COVID-19 dikumpulkan, dan SARS-CoV-2 diekstraksi. Sel Vero E6 digunakan untuk meningkatkan jumlah partikel virus. SARS-CoV-2 diinaktivasi melalui perawatan termal. [ 56 ] Sel Vero E6 (1 × 10 7 ) disemai ke dalam dua labu 175 T. Virus hidup (100 µL, 6,5 × 10 6 PFU/mL) diinokulasi ke dalam setiap labu (dengan 2% serum sapi fetal dan 1% polistirena). Tiga hari kemudian, virus dipanen setelah efek sitopatik (CPE) dikonfirmasi. Sel-sel kemudian dikeluarkan melalui sentrifugasi, dan supernatan dipindahkan ke dalam tabung 50 mL. Dalam inaktivasi virus, tabung tersebut diperlakukan secara termal dalam penangas air 70 °C selama 1 jam (P0). Sel Vero E6 disemai dalam pelat 12 sumur (2 × 10 5 sel/sumur) dan diinokulasi dengan larutan virus, dan CPE dipantau selama lima hari (P1). Setelah memastikan bahwa tidak ada CPE yang diamati, inokulasi diulang (P2). Akhirnya, asam ribonukleat diekstraksi dari larutan P0–P2, dan ambang siklus gen R/E diukur untuk menentukan apakah jumlah virus meningkat. Konsentrasi larutan virus yang digunakan dalam penelitian ini adalah 1,07 × 10 11 salinan/mL.
Studi Adsorpsi dan Pecahnya SARS-CoV-2
Adsorpsi SARS-CoV-2 dipantau dengan mengukur jumlah protein nukleokapsid menggunakan ELISA. Kulit polos dan yang dilapisi PDA dan TOB-PDA disemprot dengan tetesan larutan virus dan diinkubasi selama 30 menit. Setelah terpapar virus, setiap permukaan dicuci bersih setidaknya tiga kali dengan air deionisasi. Kulit yang telah dicuci kemudian direndam dalam larutan lisis virus (50 m m tris(hidroksimetil)aminometana dan 0,05% natrium azida) selama 30 menit untuk melepaskan protein N dari SARS-CoV-2 yang teradsorpsi. Jumlah protein N dalam lisat diukur menggunakan kit ELISA (ab274341, Abcam, Cambridge, Inggris). Untuk mengevaluasi tingkat adsorpsi SARS-CoV-2 pada berbagai kepadatan ACE2, proses yang sama dilakukan dengan menggunakan ACE2 (10108-H08B, Sino Biological, Beijing, Tiongkok) sebagai probe penangkap. Harap dicatat bahwa setiap percobaan dilakukan tiga kali, dan rata-rata dan deviasi standar disajikan pada Gambar 5 .
