Merekayasa Sifat Mekanik Anisotropik dalam Konstruksi Tulang Rawan yang Dibuat dalam Skala Besar Menggunakan Penguatan Mikrofiber
Abstrak
Meskipun prevalensi kerusakan tulang rawan pada sendi lutut semakin meningkat, perawatan regeneratif yang efektif masih terbatas. Salah satu tantangan saat ini adalah pencocokan akurat sifat mekanis lokal jaringan, yang bervariasi di seluruh permukaan sendi artikular. Studi ini menyelidiki fabrikasi konstruksi tulang rawan dengan sifat mekanis anisotropik. Secara khusus, studi ini bertujuan untuk mengembangkan konstruksi komposit dengan memperkuat hidrogel gelatin-metakriloil (gelMA) dengan serat melt electrowritten (MEW) yang disusun untuk meniru sifat mekanis anisotropik permukaan tulang rawan artikular asli. Perancah MEW anisotropik berukuran besar berhasil dibuat, setelah itu dibenamkan dalam hidrogel, menghasilkan konstruksi yang stabil. Sifat mekanis lokal dapat disesuaikan dengan memvariasikan jarak serat sambil menyediakan lingkungan yang sesuai bagi sel-sel Kondroprogenitor Tulang Rawan Artikular (ACPC) untuk menyimpan matriks seperti tulang rawan. Yang penting, tidak seperti penguatan dengan serat yang dihasilkan dengan fused deposition modeling (FDM), penguatan dengan MEW menghindari pelindungan stres, sehingga memfasilitasi respons sel. Hal ini menyoroti potensi konstruksi yang diperkuat ini untuk lebih mencocokkan karakteristik jaringan lokal dan memberikan solusi tahan lama untuk pemulihan cacat tulang rawan yang lebih besar.
1 Pendahuluan
Tulang rawan artikular (KA) adalah jaringan ikat khusus yang menutupi permukaan tulang yang mengartikulasi, dan ketebalannya berkisar antara 0,5 hingga 4 mm, dengan rata-rata 2 mm di kondilus femoralis (ujung tulang paha yang terhubung dengan tibia untuk membentuk sendi lutut). [ 1 – 4 ] Pasien dengan kerusakan tulang rawan mengalami nyeri yang signifikan dan masalah mobilitas karena KA memainkan peran penting dalam kelancaran pergerakan sendi kita, menyediakan permukaan yang hampir tanpa gesekan dan secara efisien mentransfer beban dari permukaan sendi ke tulang di bawahnya. [ 5 ] KA yang sehat memiliki koefisien gesekan yang sangat rendah (0,001), namun dapat menahan tekanan hingga 100 bar, beberapa kali berat tubuh selama gerakan dinamis. [ 6 ] Kerusakan tulang rawan lokal – biasanya mempengaruhi area yang terisolasi – dapat menyebabkan osteoartritis (OA) dini jika tidak diobati, meningkatkan rasa sakit pada pasien. [ 1 , 7 , 8 ] Artroplasti lutut total (TKA) adalah pengobatan yang efektif untuk OA, menghasilkan hasil pasien yang baik. [ 9 ] Namun, untuk pasien yang lebih muda (khususnya pria di awal usia 50-an), tingkat revisi secara signifikan lebih tinggi, karena daya tahannya terbatas dan rentan terhadap keausan permukaan gesekan polietilen, yang juga menyebabkan osteolisis. [ 9 – 11 ] Cacat osteochondral kecil, tidak diklasifikasikan sebagai OA skala penuh, memiliki beberapa pilihan pengobatan biologis, meskipun masing-masing memiliki keterbatasan. Alograft osteochondral menghasilkan hasil yang baik tetapi hanya tersedia di negara-negara tertentu dan bergantung pada ketersediaan donor. [ 12 ] Autograft osteochondral mengakibatkan morbiditas sisi donor, terutama untuk implan yang lebih besar. [ 13 , 14 ] Perawatan regeneratif dan biodegradable tetap menjadi tantangan karena kebutuhan untuk personalisasi dalam biomekanik, ukuran, dan bentuk, dan ketersediaan cetak sesuai permintaan.
Karakteristik AC berasal dari matriks ekstraseluler (ECM), yang sebagian besar terdiri dari proteoglikan bermuatan negatif dan kolagen tipe II. Aggrekan, proteoglikan yang paling umum, sangat penting untuk retensi air, menghasilkan kadar air hingga 95%. Kekuatan mekanis AC berasal dari dukungan struktural dari serat kolagen dan interaksinya dengan jaringan proteoglikan. [ 3 , 15 ] Jaringan kolagen berorientasi dalam struktur arcade, juga disebut sebagai arcade “Benninghoff”. [ 15 , 16 ] Struktur arcade ini membatasi pembengkakan air terkait proteoglikan dan memungkinkan jaringan menahan beban tekan yang tinggi. Pemuatan AC dikaitkan dengan kepadatan serat kolagen lokal dan orientasi pada lapisan superfisial, menghasilkan penyelarasan yang lebih baik di daerah yang terbebani jika dibandingkan dengan daerah yang tidak terbebani. [ 17 ] Akibatnya, permukaan AC tidak hanya menunjukkan sifat mekanis anisotropik tidak hanya melalui kedalamannya, tetapi juga di berbagai lokasi permukaan.
Biofabrikasi menjanjikan untuk secara akurat menyimpan biotinta berbasis hidrogel, yang selanjutnya dapat menangkap kompleksitas jaringan, berpotensi menciptakan konstruksi yang dapat memulihkan fungsi mekanis asli AC. [ 18 – 21 ] Berbagai bahan berbasis hidrogel telah dikembangkan dan terbukti menyediakan lingkungan seperti asli untuk sel-sel tulang rawan. [ 22 – 25 ] Namun, hidrogel lunak ini tidak mencerminkan dukungan mekanis jaringan asli, karena sifat mekanis awal sebagian besar ditentukan oleh kepadatan ikatan silang. [ 26 ] Upaya untuk mengembangkan hidrogel kekuatan tinggi terus menghadapi tantangan terkait dengan metode persiapan yang kompleks, kontrol sifat mekanis, tingkat toksisitas, dan pengendapan jaringan neo-tissue tulang rawan. [ 27 – 29 ] Karena kurangnya kekakuan mekanis pada hidrogel, kondrosit yang tertanam tidak merasakan rangsangan mekanis yang memadai dan cenderung kehilangan fenotipenya, sehingga menghasilkan penampilan fibroblastik dan dedifferensiasi. [ 30 , 31 ] Fused deposition modelling (FDM) dengan polimer termoplastik telah digunakan untuk memperkuat hidrogel lunak yang sarat sel ini, memperoleh struktur hibrida. [ 32 ] Dengan mengubah bentuk dan ukuran pori konstruksi, mekanika konstruksi hibrida dapat disesuaikan. [ 33 , 34 ] Namun, batasan signifikan penguatan FDM adalah diameter serat yang besar, biasanya ≈200 µm, karena serat dan ukuran pori yang besar ini berdampak negatif pada adhesi, pertumbuhan, dan diferensiasi sel. [ 34 , 35 ] Akibatnya, pendekatan ini dapat menyebabkan pelindungan tegangan, di mana gaya yang diberikan terutama diserap oleh serat penguat, sehingga berpotensi gagal untuk merangsang mekanotransduksi seluler. [ 36 ] Alternatif untuk penguatan FDM adalah melt electrowriting (MEW). Teknik ini menggunakan tegangan tinggi untuk mempercepat dan meregangkan polimer termoplastik, menghasilkan serat dengan diameter berkisar antara 2 hingga 50 µm. [ 37 ]Kombinasi kotak penguat MEW dengan biotinta berbasis hidrogel (pencetakan 3D) telah menghasilkan proses biofabrikasi baru yang menghasilkan implan penguat skala kecil (∅6 mm, tinggi total 7,2 mm – 1,2 mm untuk fase tulang rawan) dengan sifat mekanis homogen yang mendekati sifat mekanis AC asli, yang kemanjurannya telah ditunjukkan dalam aplikasi ortotopik in vivo. [ 38 – 43 ] Namun, aplikasi ini tidak memiliki ukuran yang diperlukan untuk penggunaan klinis dan kemampuan penyesuaian dalam bentuk dan desain mekanis.
Mekanisme yang mendasari penguatan perancah berbasis hidrogel dengan penguatan berbentuk kotak dapat dikaitkan dengan peregangan serat karena ekspansi lateral hidrogel di bawah kompresi, yang memainkan peran penting. Efek Poisson ini menyebabkan serat ditarik dalam ketegangan, meningkatkan kekakuan keseluruhan komposit. [ 44 ] Selain itu, pemindahan beban melalui interkoneksi perancah dan pencegahan tekuk meningkatkan kekakuan tekan keseluruhan. [ 44 ] Interkoneksi serat secara struktural lebih tahan daripada tumpukan serat individu dan secara efektif mendistribusikan beban tekan, mencegah perancah runtuh dan mempertahankan integritas struktural komposit. Akhirnya, jaring MEW meningkatkan tekanan fluida yang disebabkan oleh beban di dalam hidrogel dengan mengurangi permeabilitas hidrolik. Fluida ditahan di bawah tekanan oleh perancah kotak MEW, yang menyebabkan peningkatan tekanan fluida internal selama pembebanan mekanis. [ 45 ] Tekanan fluida ini penting untuk sifat mekanik dinamis komposit, meniru situasi in vivo di mana kolagen membatasi pembengkakan air yang disebabkan oleh proteoglikan.
Pada sendi lutut, terdapat beberapa zona berbeda di seluruh permukaan AC, masing-masing menunjukkan sifat kompresif berbeda yang menonjolkan sifat anisotropik permukaan. [ 46 – 51 ] Hal ini juga terwakili dalam penyelarasan kolagen di permukaan, yang menunjukkan perilaku dan penyelarasan berbeda antara area yang terbebani dan tidak terbebani. [ 17 ] Untuk integrasi optimal konstruksi tulang rawan fabrikasi, konstruksi cetakan harus secara mekanis sesuai dengan tulang rawan asli untuk mencegah pelindungan stres di jaringan sekitar, berlawanan, dan fabrikasi. Oleh karena itu, penelitian ini berfokus pada pencocokan sifat mekanis lokal dari konstruksi tulang rawan fabrikasi, yang bertujuan untuk mengatasi cacat berukuran lebih besar.
2 Hasil dan Pembahasan
2.1 Produksi Perancah MEW Anisotropik
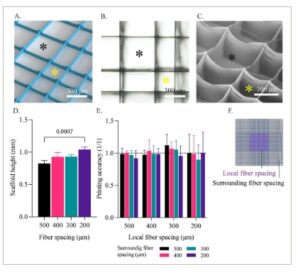
Perancah anisotropik dengan ketebalan 100 lapisan dicetak menggunakan MEW dan mencerminkan desain model yang diharapkan ( Gambar 1 A–C ). Zona dalam dan luar yang didedikasikan dapat dibedakan melalui jarak serat yang berbeda. Desain perancah secara keseluruhan juga mengakibatkan zona transisi di mana pori-pori bergeser dari bentuk persegi menjadi persegi panjang. Zona transisi ini dengan struktur kotak yang berbeda kemungkinan memengaruhi sifat mekanis dan perilaku konstruksi akhir. Perbedaan yang signifikan secara statistik antara tinggi struktur perancah jarak serat 500 (820 ± 47 µm) dan 200 µm (1040 ± 40 µm) diamati (Gambar 1D ). Hal ini dapat dijelaskan oleh muatan yang terbentuk di perancah, terutama ketika tinggi perancah total meningkat dan struktur menjadi lebih kompleks, seperti halnya perancah jarak 200 µm. Hal ini dapat mengakibatkan lebih banyak bridging dan cacat pada lapisan atas perancah, sehingga meningkatkan tinggi total. [ 52 ] Luas permukaan kotak yang difabrikasi mencerminkan luas permukaan yang dirancang, yang menunjukkan akurasi pencetakan sebesar 0,97 ± 0,19. Root mean square error (RMSE) meningkat untuk jarak serat yang terbaca 200 µm, tetapi tidak ditemukan perbedaan signifikan antara kelompok-kelompok tersebut (Gambar S4 , Informasi Pendukung). Oleh karena itu, perancah anisotropik dapat dicetak dengan akurasi dan pengulangan yang sama seperti desain perancah homogen, sejalan dengan laporan lain tentang perancah MEW. [ 53 , 54 ]
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Kemampuan cetak perancah anisotropik dengan jarak serat mulai dari 500 µm hingga 200 µm. A) Render 3D dari desain perancah anisotropik, yang menampilkan jarak serat bagian dalam 300 µm dan bagian luar 500 µm dengan tinggi 10 lapisan. B,C) Mikroskopi medan terang dan pencitraan elektron pemindaian perancah anisotropik dengan jarak serat bagian dalam 500 µm dan bagian luar 300 µm. D) Tinggi konstruksi yang diukur untuk perancah dengan jarak serat yang berbeda. E) Akurasi pencetakan perancah anisotropik dan perancah dengan jarak serat yang berbeda.
2.2 Sifat Mekanik
Baik perancah homogen maupun anisotropik berhasil dikombinasikan dengan hidrogel gelMA ( Gambar 2 A–C ), dan perancah anisotropik mempertahankan perbedaan yang jelas antara zona lokal dan sekitarnya yang menunjukkan jarak serat yang berbeda. Setelah pengecoran dan memungkinkan pembengkakan semalam, konstruksi tersebut mengukur tinggi rata-rata 1,23±0,03 mm. Peningkatan tinggi terutama disebabkan oleh perilaku pembengkakan gelatin metakrilol (gelMA), [ 55 ] meskipun tidak ada pembengkakan pada diameter yang terdeteksi. Hal ini kemungkinan besar disebabkan oleh pembatasan dari penguatan MEW, yang mencegah konstruksi membengkak ke arah ini, sehingga menghasilkan lapisan tipis gelMA yang tidak diperkuat di atas konstruksi. Ketebalan konstruksi tersebut adalah ≈60% dari AC manusia asli dan 80% dibandingkan dengan jaringan kuda. [ 3 ] Konstruksi tersebut dianalisis untuk sifat mekanis dengan penganalisa mekanis dinamis (DMA), yang menunjukkan perilaku linier setelah regangan pertama -3% hingga -30% dari regangan total. Perilaku linear ini menunjukkan bahwa beban awal dan regangan awal benar-benar menghilangkan variabilitas gelMA yang tidak diperkuat di atas konstruksi. Data kompresi mekanis menunjukkan bahwa jarak serat benar-benar memengaruhi sifat mekanis kompresif, yang menunjukkan hubungan linear negatif di mana modulus-E kompresif meningkat dengan menurunnya jarak serat. Ini diterapkan pada kompresi lokal dan massal (Gambar 2D,E ). Untuk kompresi lokal, modulus kompresif berkisar dari 0,49 ± 0,18 MPa hingga 2,52 ± 0,17 MPa (peningkatan 509%) untuk jarak serat 500 dan 200 µm, masing-masing. Sebaliknya, untuk kompresi massal, perbedaannya kurang jelas, dengan nilai berkisar dari 0,50 ± 0,2 MPa hingga 0,94 ± 0,16 MPa (peningkatan 193%) untuk 500 dan 200 µm, masing-masing. Tulang rawan asli menunjukkan modulus kompresi rata-rata untuk kompresi massal sebesar 2 MPa. [ 56 ] Perbedaan antara kompresi lokal dan massal menunjukkan bahwa, dalam kasus kompresi lokal, area di sekitarnya secara tidak langsung terpengaruh selama kompresi. Hal ini dapat dikaitkan dengan perilaku tekukan dan komponen air yang terperangkap dalam jaring MEW, sehingga meningkatkan tekanan hidrostatik. [ 53 ]Selama kompresi massal, sampel dapat mengembang secara lateral karena tidak dibatasi. Namun, dalam kompresi lokal, area yang dikompresi dibatasi oleh konstruksi di sekitarnya, yang menyebabkan tekanan hidrostatik yang lebih tinggi dari sisi-sisi dan mengakibatkan perilaku mekanis yang berbeda di bawah kompresi. Variasi ini juga dapat memengaruhi sifat mekanis konstruksi berukuran besar, di mana tepinya menunjukkan kekakuan mekanis keseluruhan yang lebih rendah karena kurangnya tekanan hidrostatik. Pengaruh variasi jarak serat yang diamati pada sifat mekanis area tersebut sejalan dengan penelitian sebelumnya. [ 53 ]

Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Sifat mekanis perancah anisotropik dan efek jarak serat pada E-modulus konstruksi setelah pengecoran dalam gelMA. A,B) Gambar stereomikroskopi konstruksi cakram dari perancah homogen dan anisotropik. C) Perancah anisotropik ukuran penuh dengan jarak serat bagian dalam 200 µm dan jarak serat sekeliling 400 µm yang dicor dalam gelMA. D) E-modulus untuk jarak serat yang berbeda saat konstruksi dikompresi secara lokal. # signifikan dengan semua kelompok lainnya. E) E-modulus untuk jarak serat yang berbeda untuk kompresi massal. # signifikan dengan semua kelompok lainnya p ≤ 0,05. F) E-modulus perancah anisotropik saat dikompresi dengan lekukan lokal. * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001, **** p ≤ 0,000.
Efek dari daerah sekitar paling dominan dalam sampel dengan jarak serat lokal 300 dan 200 µm (Gambar 2F ). Untuk kelompok tersebut, sifat mekanik lokal menunjukkan perbedaan signifikan dalam menanggapi perubahan jarak serat di sekitarnya . Konstruksi dengan jarak serat lokal yang sama (200 µm), menunjukkan E-modulus berkisar dari 1,7 hingga 2,5 MPa untuk jarak serat di sekitarnya masing-masing 500 dan 200 µm. Peningkatan ini mewakili 70%, yang hanya disebabkan oleh perubahan jarak serat, di luar area terkompresi (Gambar 2F ). Untuk konstruksi yang diperkuat dengan jarak serat 500 dan 400 µm, tidak ada perbedaan signifikan antara penguatan perancah homogen dan anisotropik yang diamati untuk kompresi massal dan lokal.
2.3 Tegangan Internal yang Dihitung
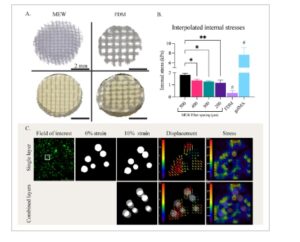
Konstruksi dengan MEW, FDM, dan tanpa penguat berhasil dicetak dengan gelMA yang mengandung manik-manik mikro fluoresen ( Gambar 3A ) . Konstruksi tersebut memiliki tinggi 1 mm. Karena penguat FDM mengambil lebih banyak volume polikaprolakton (PCL) karena untaian yang lebih tebal, volume gelMA yang tersisa lebih kecil dibandingkan dengan sampel MEW dan gelMA saja. Namun, area yang diukur – di antara untaian – mengandung jumlah manik-manik mikro fluoresen yang sama karena rasio dalam gelMA tetap konstan. Pelacakan manik-manik, dengan dan tanpa kompresi, menghasilkan peta perpindahan di mana dua keadaan yang berbeda dibandingkan. Seperti yang diharapkan, konstruksi gelMA saja menginterpolasi tegangan internal tertinggi sebesar 7,64 ± 1,18 kPa. Konstruksi yang diperkuat FDM menunjukkan tegangan internal terendah dengan nilai 0,32 ± 0,16 kPa. Sampel yang diperkuat MEW menunjukkan tegangan yang jauh lebih tinggi untuk kelompok 500 µm, tetapi tidak di antara jarak serat lainnya (Gambar 3B ). Tegangan internal dalam konstruksi yang diperkuat MEW bervariasi dari 1,8 ± 0,1 kPa (pada jarak serat 500 µm) hingga 1,2 ± 0,2 kPa (pada jarak serat 200 µm). Di semua sampel, perpindahan manik-manik dapat dilacak dengan sukses (Gambar 3C ).
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Data mikroskopi gaya traksi (TFM) dari sampel jarak serat yang berbeda. A) Gambar mikroskop stereo sampel MEW dan FDM sebelum dan sesudah pengecoran gelMA. B) Tegangan internal yang diinterpolasi oleh TFM. # Signifikan terhadap semua kelompok lainnya p ≤ 0,05, * p ≤ 0,05, ** p ≤ 0,01. C) Langkah-langkah analisis saat menerapkan TFM. Menunjukkan area fokus untuk visualisasi, membandingkan kondisi tanpa regangan dan 10% regangan, memvisualisasikan perpindahan dan tegangan yang diinterpolasi oleh plugin FTTC.
Setelah memeriksa tegangan internal, kami mengamati bahwa penguat FDM menunjukkan pelindung tegangan, dengan kurang dari 4 ± 2% tegangan awal yang tersisa di dalam gel. Sebaliknya, konstruksi yang diperkuat serat mikro menahan 19 ± 3% tegangan awal. Khususnya, kelompok jarak serat 500 µm menunjukkan tingkat tegangan yang jauh lebih tinggi dibandingkan dengan kelompok jarak serat lainnya. Data ini mengonfirmasi bahwa penguat secara efektif mengambil sebagian beban dari hidrogel, seperti yang diantisipasi. Secara khusus, penguat FDM menyerap hampir seluruh beban, sedangkan penguat MEW menanggung sebagian besar beban sambil tetap memungkinkan tegangan internal di dalam gel.
Pembebanan fisiologis secara positif memengaruhi produksi matriks tulang rawan oleh kondrosit. Respons seluler terhadap rangsangan mekanis bervariasi menurut jenis gaya yang diberikan (kompresi, geser, atau multiarah) dan durasi rangsangan. Stimulasi mekanis yang memadai sangat penting untuk membangun implan tulang rawan yang mendukung fungsi kondrosit yang tepat. Penelitian telah menunjukkan bahwa kondrosit memerlukan stimulasi mekanis untuk sintesis matriks yang efektif. [ 57 – 59 ] Menerapkan tekanan 1 kPa selama 30 menit meningkatkan enzim remodeling matriks, diikuti oleh peningkatan kolagen tipe II dan ekspresi gen aggrekan dibandingkan dengan sampel yang tidak terstimulasi. [ 60 ] Stimulasi 1 kPa ini konsisten dengan tegangan internal yang diinterpolasi oleh mikroskopi gaya traksi (TFM) dalam konstruksi yang diperkuat MEW untuk kelompok 400, 300, dan 200 µm.
Modulus E kompresif dari konstruksi gelMA yang diperkuat MEW lebih rendah daripada tulang rawan asli dan gelMA yang diperkuat FDM, di mana AC asli menunjukkan modulus E ≈2 MPa. [ 56 ] Namun, penilaian ini tidak mempertimbangkan keberadaan sel dan produksi ECM mereka, yang akan menambah stabilitas lebih lanjut. [ 61 ] Mengingat tekanan internal yang terukur, konstruksi ini harus memberikan stimulasi mekanis yang cukup bagi sel untuk menghasilkan ECM dengan fungsionalitas potensial menahan beban. Sementara gelMA yang diperkuat FDM menunjukkan sifat kompresif yang lebih tinggi daripada jaringan asli, ia tidak memungkinkan stimulasi mekanis pada sel yang tertanam dalam hidrogel. Selain itu, modulus kompresif yang lebih tinggi juga dapat menyebabkan pelindungan stres pada jaringan di sekitarnya pasca-implantasi.
2.4 Pembuatan Konstruksi dengan Ukuran yang Relevan Secara Klinis
2.4.1 Sifat Mekanik
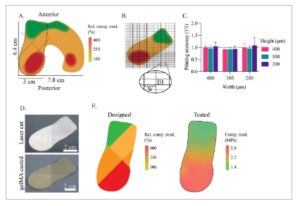
Desain peta panas kompresi kondilus femoralis dikembangkan menggunakan nilai-nilai dari literatur ( Gambar 4 A ). Variasi antara area yang berbeda ditunjukkan dalam nilai relatif. Perancah besar dibuat, mencapai akurasi 0,98 ± 0,15 di seluruh zona jarak serat yang berbeda (Gambar 4B, C ), konsisten dengan perancah anisotropik sebelumnya (Gambar 1 ). Perancah kemudian dipotong laser menjadi bentuk yang diinginkan dan dikombinasikan dengan gelMA (Gambar 4D ), menghasilkan konstruksi berbentuk kondilus datar dengan zona jarak serat yang berbeda dan ketebalan keseluruhan 1 mm. Kepadatan serat yang bervariasi ini sesuai dengan sifat mekanis yang berbeda. Area dengan jarak serat yang lebih kecil, dan dengan demikian kepadatan serat yang lebih tinggi, menunjukkan kekakuan mekanis yang lebih besar dibandingkan dengan area dengan kepadatan serat yang lebih rendah, yang ditunjukkan sebelumnya dalam penelitian ini dan masih diterapkan pada konstruksi bentuk bebas (Gambar 4E ). Secara keseluruhan, perancah anisotropik menunjukkan variasi dalam E-modulus mulai dari 1,4 hingga 3,0 MPa. Dengan demikian, lebih dari dua kali lipat modulus E kompresif dicapai dalam satu konstruksi tunggal, sambil mencerminkan variasi seperti yang dirancang. AC asli ditambatkan ke tulang subkondral, mencegah translasi lapisan kondral. Dalam penelitian ini, konstruksi anisotropik besar ditempatkan di dalam bingkai (Gambar S3 , Informasi Pendukung), yang membatasi ekspansi lateral, dengan demikian meniru penjangkaran asli. Karena gelMA berbasis air, ia dapat dianggap tidak dapat dikompresi. Di lingkungan asli, AC menukar cairan dengan cairan sinovial. [ 15 ] Efek yang sama terjadi dengan konstruksi gelMA yang diperkuat. Namun, karena ukuran indentor relatif terhadap total volume konstruksi, efek ini sangat kecil.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Konstruksi tulang rawan berukuran besar berdasarkan sifat mekanis tulang rawan artikular pada kondilus femoralis lateral lutut kanan. A) Peta panas dibuat dengan sifat kompresif relatif berdasarkan data dari literatur. [ 46 – 49 ] B) Desain perancah MEW untuk mencerminkan zona mekanis yang berbeda dari kondilus femoralis. C) Akurasi pencetakan zona mekanis yang berbeda. D) Perancah setelah pemotongan laser dan pengecoran dengan gelMA. E) Sifat kompresif relatif dari zona yang berbeda dari jaring MEW kondilus.
Meskipun sifat mekanis anisotropik dari perancah telah didokumentasikan dalam literatur, khususnya dalam aplikasi jantung dan vaskular, sifat-sifat ini biasanya dicapai dengan menyesuaikan desain yang homogen. [ 62 , 63 ] Akibatnya, di bawah tegangan, sifat mekanis tidak menunjukkan perilaku linier. Pendekatan ini menghasilkan konstruksi dengan sifat mekanis yang seragam secara keseluruhan, tidak memiliki kemampuan untuk desain mekanis anisotropik. Untuk regenerasi meniskus, pendekatan anisotropik telah menunjukkan terciptanya zona mekanis yang berbeda dengan menggabungkan jarak serat yang berbeda dalam satu konstruksi. [ 64 ] Namun, metode ini terbatas hanya pada dua zona yang berbeda. Selain itu, pendekatan ini mengharuskan jarak serat disejajarkan sedemikian rupa sehingga salah satunya merupakan kelipatan dari yang lain (misalnya, 400 µm – 200 µm dan 600 µm – 300 µm – 200 µm), yang memungkinkan serat berbaur dengan mulus. Oleh karena itu, penyesuaian dibatasi pada kombinasi jarak serat tertentu.
2.4.2 Perilaku Seluler dan Deposisi ECM dalam Perancah Anisotropik
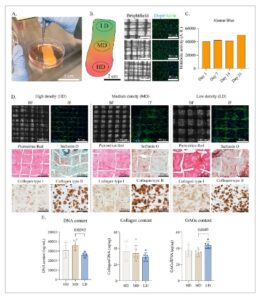
Perancah anisotropik besar berhasil digabungkan dengan sel progenitor tulang rawan artikular (ACPC) yang mengandung gelMA dan dikultur hingga 28 hari dalam media diferensiasi kondrogenik ( Gambar 5 A ). Jarak serat dalam konstruksi tetap tidak berubah dan dapat dibedakan setelah pengecoran hidrogel, dengan distribusi sel yang seragam diamati setelah penyemaian sel (Gambar 5B ). Aktivitas metabolisme sel tetap stabil selama periode kultur awal, yang menunjukkan bahwa sel beradaptasi dengan lingkungan 3D dan mempertahankan fungsi metabolisme setelah pengecoran sel awal, kemungkinan karena sifat biomimetik hidrogel yang mendukung. Dataran tinggi dalam aktivitas metabolisme dapat mencerminkan proliferasi yang berkurang sebagai akibat dari diferensiasi sel (Gambar 5C ). Setelah 28 hari kondrogenesis, ACPC didistribusikan secara merata di seluruh konstruksi, terutama melekat dan berkumpul di sekitar serat mikro MEW (Gambar 5D ). Khususnya, pada jarak serat yang besar (400 µm), ACPC cenderung mengelompok di sepanjang sudut kotak. Sebaliknya, pada jarak serat yang lebih kecil (300 dan 200 µm), sel-sel tersebut sebagian besar melekat pada jaringan PCL yang lebih padat, membentuk lapisan seragam yang menutupi ruang di antara serat-serat. ACPC menunjukkan morfologi yang memanjang tetapi mempertahankan kapasitas untuk menghasilkan kolagen tipe II dan glikosaminoglikan selama kultur dalam media diferensiasi kondrogenik (Gambar 5D ). Deposisi kolagen dikonfirmasi melalui imunohistokimia kolagen tipe I dan II. Karena GelMA mengandung kolagen tipe I, sebagian besar konstruksi juga menunjukkan pewarnaan sedikit positif untuk merah picrosirius. Kolagen tipe II yang disekresikan oleh ACPC yang berdiferensiasi secara kondrogenik diamati di sekitar sel-sel, dan demikian pula, GAG sebagian besar disimpan di daerah periseluler. Penelitian sebelumnya telah menunjukkan bahwa ACPC yang dikultur dalam gelMA secara progresif meningkatkan produksi komponen ECM, seperti GAG. [ 24 , 65 ] Oleh karena itu, diharapkan bahwa memperpanjang periode kultur akan menyebabkan akumulasi GAG dan kolagen tipe II yang lebih besar di seluruh konstruksi. Meskipun produksi ECM dari waktu ke waktu akan berkontribusi pada peningkatan sifat mekanik, efeknya pada tahap diferensiasi ini (28 hari) masih terbatas dibandingkan dengan penguatan mekanik yang disediakan oleh jaringan serat MEW. [ 24 ] Selain itu, tidak ada perbedaan signifikan dalam kandungan kolagen total yang diamati antara zona perancah yang berbeda (Gambar 5E ).
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Validasi in vitro dari perancah anisotropik skala besar. A) Kultur desain perancah anisotropik berukuran besar dengan gelMA bermuatan sel setelah pengecoran. B) Citra Brightfield dan pewarnaan imunofluoresensi inti (DAPI)/aktin dari berbagai zona langsung setelah penyemaian. C) Pengukuran biru Alamar dari seluruh konstruksi. D) Pencitraan Brightfield dan pewarnaan imunofluoresensi inti (DAPI)/aktin setelah 28 hari kultur; Pewarnaan imunofluoresensi merah Picrosirius, safranin-O, dan kolagen tipe I dan tipe II setelah 28 hari kultur. E) Kandungan DNA (ng/ml), kolagen per DNA (µg/µg), dan GAG per DNA (µg/µg) antara zona kepadatan rendah (LD), sedang (MD), dan tinggi (HD).
Kandungan DNA secara keseluruhan secara signifikan lebih rendah di area dengan kepadatan serat rendah dibandingkan dengan area dengan kepadatan sedang, yang menunjukkan kandungan sel yang lebih rendah pada hari ke-28 (Gambar 5E ), meskipun konstruksi dibuat dengan suspensi sel yang homogen. Namun, kandungan DNA memungkinkan normalisasi komponen ECM lainnya. Rasio GAG/DNA menunjukkan kandungan GAG yang lebih tinggi di zona kepadatan rendah. [ 63 ]
3 Diskusi
Bio-konstruksi berukuran besar yang dibuat dalam studi ini menunjukkan sifat mekanis anisotropik di berbagai zona, mencerminkan perilaku mekanis anisotropik yang diamati pada tulang rawan asli. Dalam studi ini, gelMA bermuatan sel ditambahkan dalam proses manual. Dengan menggabungkan MEW dengan bioprinting berbasis ekstrusi (EBBP), proses otomatis untuk biofabrikasi konstruksi tulang rawan besar yang disesuaikan secara mekanis akan menjadi mungkin. Telah ditunjukkan bahwa konvergensi kedua teknik ini memungkinkan kompleksitas yang lebih besar dalam pengendapan spasial sel dalam konstruksi. [ 42 , 43 , 66 ] Selain itu, desain anisotropik dapat diintegrasikan dengan pengaturan pencetakan multi-sumbu (5 atau 6-sumbu) yang meningkatkan jangkauan untuk substrat 3D yang kompleks. [ 67 , 68 ] Khususnya printer robotik 6-sumbu menunjukkan potensi terbesar, karena menawarkan kebebasan baik pada sumbu linier (x, y, dan z) maupun sumbu rotasi (roll, pitch, dan yaw), meningkatkan jangkauan untuk permukaan cembung dan cekung, seperti kondilus femoralis, troklea, dan patela. Peningkatan jangkauan akan memungkinkan untuk mencetak langsung ke struktur 3D yang mewakili kondilus femoralis, yang dibuat dari keramik osteoinduktif untuk berfungsi sebagai jangkar tulang, yang diperlukan untuk implan yang stabil, sambil mereplikasi zona mekanis yang berbeda. [ 56 , 69 , 70 ] Ini akan menghasilkan implan khusus pasien, tanpa perlu penyesuaian apa pun selama operasi, seperti yang dapat terjadi pada pendekatan lain yang memanfaatkan desain universal. [ 71 ]
Dari perspektif biologis, penelitian ini menunjukkan perilaku sel yang homogen dalam perancah anisotropik. ACPC terutama menempel dan berkumpul di sekitar serat mikro MEW pada jarak serat yang lebih besar, sementara pada jarak serat yang lebih kecil, mereka membentuk lapisan yang lebih seragam dengan menjembatani serat. Perilaku ini konsisten dengan temuan serupa yang dilaporkan dalam literatur sebelumnya. [ 72 , 73 ] Produksi ECM bersifat homogen di zona-zona konstruksi yang berbeda. Namun, area dengan kepadatan serat yang lebih rendah memiliki konsentrasi GAG yang jauh lebih tinggi. Ini mungkin disebabkan oleh fakta bahwa pori-pori yang lebih besar menyediakan lebih banyak ruang untuk pengendapan ECM, terutama penting untuk GAG karena sifatnya yang menarik air dan membengkak. Saat GAG terakumulasi, pori-pori yang lebih besar dapat meninggalkan lebih banyak ruang untuk pembengkakan terjadi tanpa dibatasi oleh serat. Selain itu, agregasi sel merupakan sinyal penting untuk ekspresi fenotipik penanda kondrosit, yang juga diamati terjadi lebih sering pada jarak serat yang besar. [ 74 ] Namun, beberapa aspek masih perlu dieksplorasi lebih lanjut. Pertama, pembebanan mekanis tidak disertakan dalam studi ini. Untuk lebih jauh membedakan dan mematangkan jaringan selama kultur, stimulasi mekanis (misalnya, oleh bioreaktor yang mewakili situasi in vivo) dapat meningkatkan produksi matriks. [ 75 ] Stimulasi mekanis penting karena kondrosit, sel primer dalam tulang rawan, mendeteksi rangsangan mekanis melalui sensor mekanotransduksi dan membutuhkannya untuk mempertahankan fungsi normalnya, sintesis ECM, dan homeostasis tulang rawan secara keseluruhan. [ 76 ] Dalam implan AC, distribusi beban secara signifikan memengaruhi perilaku kondrosit yang disemai pada konstruksi ini. [ 77 ] Eksplorasi lebih lanjut tentang stimulasi mekanis konstruksi yang disemai sel dan produksi ECM pada ukuran pori yang berbeda akan menjadi wawasan. Dengan TFM, dikonfirmasi untuk pertama kalinya bahwa penguatan FDM memang menghasilkan pelindungan stres, di mana penguatan MEW memungkinkan adanya stres internal. Jika perancah menyerap semua pembebanan mekanis, kondrosit terlindungi dari stres mekanis yang biasanya mereka alami di lingkungan aslinya. [ 78 , 79 ] Hilangnya sinyal mekanik yang sesuai menyebabkan perubahan aktivitas metabolisme dan produksi matriks, sehingga menyebabkan produksi tulang rawan fibrosa yang secara mekanis lebih rendah daripada tulang rawan hialin. [ 80 ]Di sisi lain, penguatan MEW memungkinkan pembebanan tegangan internal yang memadai dalam gel sebesar ≈1 KPa, yang telah terbukti meningkatkan ekspresi gen kolagen tipe II dan aggrekan. Sebaliknya, penguatan FDM hanya menyediakan pembebanan tegangan internal sebesar ≈300 Pa. [ 60 ]
Untuk stabilisasi jangka panjang, komposisi biodegradable dari bahan yang digunakan (PCL dan gelMA) harus dipertimbangkan. Awalnya, gelMA yang diperkuat memberikan sebagian besar dukungan ketika belum digantikan oleh ECM yang diproduksi oleh sel-sel yang berdiferensiasi. Sampel histologi menunjukkan bahwa ECM yang diproduksi tidak terorganisir dan tidak sebanding dengan jaringan asli yang sangat terorganisir. [ 56 ] Oleh karena itu, saat gelMA terdegradasi seiring waktu, ada risiko berkurangnya stabilitas mekanis. Perancah MEW menawarkan stabilitas jangka panjang tetapi juga menunjukkan degradasi in vivo yang signifikan setelah tahun pertama implantasi. [ 81 ] Untuk meningkatkan stabilitas jangka panjang, penelitian di masa depan harus mengeksplorasi strategi untuk meningkatkan penyelarasan kolagen baik di seluruh permukaan maupun di seluruh kedalaman jaringan untuk mendukung pembentukan jaringan AC seperti asli untuk stabilitas jangka panjang.
4 Kesimpulan
Studi ini menunjukkan untuk pertama kalinya keberhasilan fabrikasi dan pematangan konstruksi jaringan tulang rawan berukuran besar yang bersifat anisotropik secara mekanis dengan sifat mekanis lokal yang dapat disesuaikan dan sel-sel penghasil matriks tulang rawan yang hidup. Saat serat berinteraksi dengan lingkungan, penyesuaian lokal juga memengaruhi kekakuan mekanis area di sekitarnya. Efek ini dapat dimanfaatkan untuk menciptakan desain beban mekanis khusus dari konstruksi hidrogel yang diperkuat. Perilaku sel yang homogen ditunjukkan dalam berbagai zona konstruksi dan sel-sel tidak menunjukkan pelindung stres. Sel-sel tersebut dapat hidup dan menghasilkan GAG dan ECM, termasuk kolagen tipe II.
Studi ortotopik in vivo sebelumnya telah mengonfirmasi stabilitas mekanis konstruksi bertulang berdiameter kecil. Studi ini kini menunjukkan kelayakan peningkatan implan tersebut ke ukuran besar, yang menawarkan kemungkinan untuk menutupi seluruh kondilus femoralis sambil mempertahankan penyesuaian dalam perilaku mekanis dan respons sel yang homogen.
5 Bagian Eksperimen
Metode
Studi ini menyelidiki sifat mekanis konstruksi GelMA yang diperkuat MEW, dengan menekankan efek dari jarak serat yang bervariasi dan desain anisotropik. Perancah homogen dan anisotropik dibuat dan ditanamkan dalam GelMA, diikuti oleh pencitraan terperinci dan analisis mekanis. Konstruksi tulang rawan besar dengan daerah mekanis yang berbeda dibuat, diukur, dan ditanami dengan sel kondroprogenitor. Konstruksi tersebut dikulturkan untuk menilai perilaku seluler dan kinerja mekanis. Karakterisasi perancah dan sel yang komprehensif dilakukan untuk mengevaluasi kemanjuran konstruksi tersebut.
Pembuatan Perancah MEW—Pengaturan Printer
Perancah MEW dibuat dengan mencetak PCL (Corbion, Belanda) pada slide kaca setebal 1 mm menggunakan sistem bioprinter Discovery1 (RegenHU, Swiss). PCL dipanaskan hingga 80 °C dan diekstrusi melalui nosel 24 G. Rentang tegangan 5–5,5 kV, tekanan 0,1 MPa, jarak kolektor 4 mm, dan rentang kecepatan 8–12 mm s −1 diterapkan. Kode G khusus digunakan untuk mengendalikan kepala alat. Setelah dicetak, perancah disemprot dengan etanol 70% dan dilepaskan perlahan dari slide kaca. Etanol yang berlebih dibiarkan menguap.
Pembuatan Perancah MEW—Desain Perancah
Perancah homogen dibuat menggunakan desain kotak, yang terdiri dari 100 lapisan dengan diameter serat 10 µm. Jarak antar kotak bervariasi dari 500 hingga 200 µm dengan kelipatan 100 µm. Kisaran ini dipilih berdasarkan penelitian sebelumnya yang menunjukkan porositas optimal kasa MEW untuk penguatan GelMA, serta penelitian in vivo sebelumnya yang menunjukkan jarak serat ideal untuk penguatan dalam kisaran ini. [ 53 , 56 ] Jarak serat yang melebihi 500 µm tidak memiliki dukungan mekanis apa pun, dan di bawah 200 µm kemampuan cetaknya terbatas dengan diameter serat yang diinginkan. Perancah yang digunakan untuk analisis mekanis berukuran 15 × 15 mm dalam dimensi keseluruhan dengan ketebalan 1 mm. Selain itu, perancah anisotropik diproduksi, yang menampilkan pola kotak persegi dan persegi panjang, juga terdiri dari 100 lapisan dengan diameter serat 10 µm. Perancah dibagi menjadi dua wilayah: bagian dalam atau tengah berukuran 5 × 5 mm (disebut sebagai ” lokal “) dan bagian luar yang terdiri dari serat di sekitarnya, dengan ukuran total 15 × 15 mm (disebut sebagai ” sekitar “) (Gambar S1 , Informasi Pendukung). Kombinasi serat lokal dan sekitar digunakan dari 500, 400, 300, dan 200 µm, menggabungkan masing-masing untuk kedua zona, menghasilkan 16 kelompok.
Pembuatan Perancah MEW—Pencitraan
Sampel divisualisasikan menggunakan mikroskopi medan terang pada perbesaran 4 dan 10 kali (Olympus BX43) untuk menilai kemampuan cetak dan mikroskopi elektron pemindaian (SEM, Phenoms Pro, ThermoFischer) untuk tinjauan rinci konstruksi, yang beroperasi pada tegangan percepatan 5 kV dan 10 kV.
Pembuatan Perancah FDM—Pengaturan Printer
Perancah PCL (Corbion, Belanda) pemodelan deposisi fusi dibuat menggunakan sistem bioprinter Discovery1 (RegenHU, Swiss). Wadah PCL dipanaskan hingga 90 °C dan diekstrusi pada suhu 80 °C melalui nosel berdiameter 0,2 mm dengan laju ekstrusi 3 putaran per menit dan kecepatan cetak 5 mm s −1 .
Pembuatan Perancah FDM—Desain Perancah
Perancah FDM berbentuk cakram dengan diameter 6 mm, memiliki pola isi bujursangkar 500 µm dan serat berdiameter 200 µm, sehingga menghasilkan jarak antar serat 300 µm. Perancah terdiri dari 5 lapisan 200 µm, sehingga menghasilkan tinggi total 1 mm.
Gelatin Metakriloil
GelMA dengan tingkat fungsionalisasi 80% disintesis berdasarkan protokol yang dijelaskan sebelumnya. [ 82 ] Untuk menghasilkan hidrogel gelMA, 0,95 mL larutan gelMA 0,1 g mL −1 disiapkan dalam PBS. Selain itu, 0,025 mL larutan natrium persulfat 2,5% 5 mм (SPS, Sigma–Aldrich, AS) ditambahkan sebagai pengikat silang (2,5% vv −1 ). Ini diikuti dengan penambahan 2,5% 0,5 mм dikloro-ruthenium (II) heksahidrat (RU, Sigma–Aldrich, AS).
Penanaman Perancah MEW di gelMA
Desain perancah homogen (jarak serat yang sama di seluruh bagian) diambil sampelnya menggunakan biopsi punch 6 mm (Razormed, BAP medical) dari perancah besar. Perancah kemudian ditempatkan dalam cetakan cor Teflon yang dibuat khusus. [ 42 , 83 ] Untuk perancah anisotropik, cetakan yang dirancang khusus dicetak 3D pada printer X1 Carbon FDM (lab Bambu, Cina) untuk pengecoran gelMA. GelMA (10% wv −1 ) ditambahkan ke perancah dan diikat silang menggunakan LED lampu putih 20 Watt (Jobmate, Australia) selama 7 menit pada ketinggian 10 cm. Sampel disimpan pada suhu 4 °C semalaman dalam PBS untuk memungkinkan pembengkakan gelMA dan divisualisasikan menggunakan mikroskop stereo (Olympus SZ61). Selain itu, konstruksi yang diperkuat FDM dan konstruksi gelMA saja dibuat sebagai kontrol untuk mikroskopi gaya traksi, dengan mengikuti prosedur yang sama. Setelah analisis mekanis, sampel dicitrakan menggunakan mikroskop stereo (Olympus SZ61).
Pembuatan Konstruksi Anisotropik Besar
Desain konstruksi besar yang mencerminkan anisotropi mekanis, seperti yang diamati dalam AC asli kondilus femoralis, didasarkan pada data mekanis yang diperoleh dari literatur. [ 46 – 49 ] Perancah dicetak sebagai bagian dari konstruksi berbentuk persegi besar dan kemudian dipotong sesuai bentuk menggunakan pemotong laser Fusion Pro (Epiloglaser, Belanda) yang diatur ke daya 5%, kecepatan 100%, dan frekuensi 50%. Perancah berisi tiga zona: kepadatan tinggi (jarak serat HD 200 µm) kepadatan sedang (MD, jarak serat 300 µm), dan kepadatan rendah (LD, jarak serat 400 µm). Sisi anterior sendi, yang dicirikan oleh sifat mekanis rendah, berhubungan dengan kepadatan serat rendah. Sisi lateral, yang menunjukkan kekakuan tinggi, diwakili oleh kepadatan serat tinggi, dengan zona transisi (kepadatan sedang) di antaranya. Perancah MEW diposisikan dalam cetakan Teflon khusus, yang ditutup dengan kaca geser pada permukaan atas dan bawah (Gambar S2 , Informasi Pendukung), dan dicetak dengan gelMA.
Kultur Sel—Isolasi Sel, Penyemaian, dan Kondisi Kultur
Sel-sel kondroprogenitor tulang rawan artikular diisolasi dari sendi lutut sehat dari donor kuda dewasa yang telah meninggal, seperti yang dijelaskan sebelumnya. [ 24 ] Secara singkat, ACPC pertama kali dipilih berdasarkan adhesi mereka terhadap fibronektin dan kapasitas pembentukan koloni mereka. Sel-sel kemudian diperluas dalam medium pertumbuhan ekspansi DMEM-glukosa tinggi-GlutaMAX-piruvat (Gibco, 31966) yang disuplementasi dengan 10% serum sapi janin (FBS; Westburg, CA FBS-HI-11A), 1% penisilin/streptomisin (Gibco, 15140-122), 1% asam askorbat 2-fosfat (Merck A8960), 1% asam amino nonesensial (Gibco, 11140050), dan 5 µL mL −1 faktor pertumbuhan fibroblast dasar (bFGF; Bio-Techne, 233-FB) hingga passage 3. Setelah ekspansi, ACPC ditanamkan dalam gelMA 80% DoF pada konsentrasi 20 × 106 sel /mL dengan menambahkan sel ke hidrogel dan mencampur dengan pipet perpindahan positif hingga suspensi homogen tercapai. Perancah MEW anisotropik dicetak dengan 2 mL gelMA bermuatan sel, diikat silang seperti yang dijelaskan sebelumnya dan dikultur selama 28 hari dalam medium diferensiasi kondrogenik yang terdiri dari DMEM-glukosa tinggi-GlutaMAX-piruvat (Gibco, 31966) yang disuplemen dengan 1% ITS Premix (Corning, 354352), 1% penisilin/streptomisin (Gibco, 15140-122), 1% asam askorbat 2-fosfat, 1% buffer HEPES (1м; Gibco, 15630080), 0,4% deksametason (0,1 × 10 −6 м Sigma–Aldrich, D8893) dan 0,1% faktor pertumbuhan transformasi manusia rekombinan β (TGFβ1) (10 ng/mL, Prepotech,100-21). Media disegarkan dua kali seminggu, seperti yang dijelaskan sebelumnya. [ 24 ] Selama kultur, sampel divisualisasikan menggunakan mikroskopi medan terang (Olympus BX43).
Analisis Perancah—Analisis Mekanik
Perancah MEW yang tertanam GelMA diuji menggunakan (DMA (instrumen TA Q800). Beban awal 0,001 N diterapkan untuk membuat kontak yang cukup antara penekan dan sampel dan untuk mengukur tinggi sampel. Ramp regangan kemudian ditetapkan ke -20%/menit dari regangan 0% hingga -30%, sementara tegangan diukur secara bersamaan setiap 0,5 detik. Modulus E kompresif diukur dari daerah linier kurva tegangan-regangan, antara 10% dan 15% regangan, karena ini mencerminkan pembebanan asli untuk AC dan sesuai dengan prosedur pengujian yang ditetapkan. [ 84 , 85 ] Untuk kompresi lokal, penekan datar dengan diameter 2 mm digunakan. Untuk kompresi massal, intenter datar yang menutupi seluruh konstruksi (∅25 mm) digunakan. Untuk perancah anisotropik besar, konstruksi ditempatkan dalam dudukan cetak 3D untuk mencegah ekspansi lateral (Gambar S3 , Informasi Pendukung). Dudukan tersebut menampilkan indentor khusus area bagi penekan untuk mengukur konstruksi. Protokol pengujian yang sama, dari regangan 0 hingga -30%, diterapkan menggunakan penekan datar 2 mm.
Analisis Perancah—Ketinggian dan Akurasi Pencetakan
Ketinggian perancah cetak diukur menggunakan penekan datar 2 mm pada DMA dan menerapkan beban awal 0,001 N untuk memastikan kontak yang tepat dan pengukuran yang akurat pada persilangan serat. Akurasi cetak dinilai dengan mengukur luas kotak cetak menggunakan Fiji (ImageJ 1.54f). [ 86 ] Luas permukaan yang diukur kemudian dibandingkan dengan luas permukaan teoritis, dan akurasi cetak dihitung menggunakan Persamaan 1. Untuk perancah anisotropik, luas lokal digunakan untuk menentukan akurasi cetak.
![]()
Analisis Perancah—Mikroskopi Gaya Traksi dan Tekanan Internal
Mikroskopi gaya traksi digunakan untuk menginterpolasi tegangan internal pada konstruksi gelMA yang diperkuat. [ 87 , 88 ] Mikrobead polistirena fluoresensi (∅5 µm, panjang gelombang eksitasi 508 nm, 35-2 ThermoFischer) didispersikan dalam gelMA pada konsentrasi 3 ± 0,2 mg ml −1 dan dipusarkan sebelum pengikatan silang untuk memastikan distribusi manik-manik yang tepat. Gaya tekan yang diperlukan untuk mencapai kompresi 10% dari sampel gelMA yang diperkuat MEW 300 µm dihitung menggunakan Persamaan 2. Tekanan internal ini kemudian diterapkan secara merata ke semua kelompok tekan. Dengan menggunakan gaya yang dihitung dan nilai tegangan yang sesuai dari data DMA, regangan yang diperlukan untuk mencapai tegangan tekan yang sama ditentukan. Alat kompresi khusus digunakan untuk mencitrakan sampel dengan dan tanpa tegangan yang diterapkan menggunakan mikroskopi fluoresensi (Thunder, Leica). Gambar-gambar ini diimpor ke Fiji (ImageJ 1.54f) dan diproses seperti yang dijelaskan sebelumnya. [ 88 ] Particle Image Velocimetry (PIV) menganalisis perpindahan manik-manik dalam sampel dengan membandingkan keadaan terkompresi dan tidak terkompresi. Metode Fourier Transform Traction Cytometry (FTTC) digunakan untuk menginterpolasi tegangan internal. [ 88 ] Metode PIV dan FTTC dianalisis dengan plugin PIV dan FTTC untuk Fiji. [ 89 ]
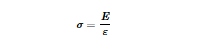
Karakterisasi Sel dan ECM—Aktivitas Metabolisme
Untuk menilai aktivitas metabolisme sel dalam sampel, uji Alamar Blue (garam natrium Resazurin, Alfa Aesar) dilakukan sesuai dengan protokol pabrik. Sampel diinkubasi dengan reagen Alamar Blue selama 4 jam pada suhu 37 °C. Setelah inkubasi, intensitas fluoresensi diukur menggunakan pembaca mikroplat (Clariostar, Jerman) pada panjang gelombang eksitasi 560 nm dan panjang gelombang emisi 590 nm. Aktivitas metabolisme kemudian diekstrapolasi dari pembacaan fluoresensi, yang memberikan indikasi aktivitas metabolisme sel.
Karakterisasi Sel dan ECM—Histologi
Sampel diambil dari zona kepadatan tinggi, sedang, dan rendah dari konstruksi anisotropik besar dengan menggunakan tusuk biopsi 6 mm. Selanjutnya, sampel difiksasi dalam paraformaldehida 4% selama 30 menit dan didehidrasi sebelum penanaman parafin. Irisan (ketebalan 5 µm) dipotong menggunakan mikrotom (Leica, Jerman). Sampel dideparafinisasi dan diwarnai dengan larutan merah picrosirius 0,1% (1 jam) untuk pewarnaan kolagen, larutan hematoksilin Weigert 1/1 (10 menit) untuk pewarnaan nukleus, dan safranin-O 0,125% (5 menit) untuk pewarnaan GAG, yang terakhir diwarnai tandingan dengan 0,4% hijau cepat berair selama 4 menit.
Untuk imunohistokimia kolagen tipe I dan tipe II, Pronase (1 mg mL −1 ) (Merck PRON-RO) dan hialuronidase (10 mg mL −1 ) (Merck H3884) digunakan sebagai pengambilan antigen setelah deparafinisasi. Irisan diblokir dengan 5% bovine serum albumin dan diinkubasi semalam pada suhu 4 °C dengan antibodi kolagen tipe I kelinci (Abcam, ab138492) yang diencerkan 1:400 atau antibodi kolagen tipe II tikus (DSHB, II-II6B3) yang diencerkan 1:100. IgG tikus dan IgG kelinci berfungsi sebagai kontrol negatif untuk kolagen tipe I dan kolagen tipe II, masing-masing. Untuk kolagen tipe I, antibodi sekunder konjugasi peroksidase lobak antikelinci (DAKO EnVision+ (K4010)) diinkubasi selama 30 menit pada suhu kamar. Untuk kolagen tipe II, antibodi sekunder yang dikonjugasikan dengan peroksidase lobak anti-tikus (DAKO PO447) yang diencerkan 1:100 diinkubasi selama 1 jam pada suhu ruangan. Deteksi dicapai dengan menggunakan larutan substrat peroksidase DAB (Vector Laboratories, SK-4100) selama 2 menit. Nukleus diwarnai sebentar dengan hematoksilin Mayer. Sampel dipasang dengan media pemasangan permanen berbasis xilena (DePeX, 06522) dan dicitrakan menggunakan mikroskopi medan terang (Olympus BX51).
Karakterisasi Sel dan ECM—Pewarnaan Imunofluoresensi Filamen Aktin
Sampel difiksasi dalam 4% paraformaldehida selama 30 menit dan dipermeabilisasi dengan 0,3% Triton X-100. Setelah permeabilisasi, sampel diblokir dengan 5% bovine serum albumin selama 30 menit dan diinkubasi dengan Alexa Fluor 488 phalloidin (ThermoFisher) selama 30 menit untuk mewarnai filamen aktin. Nukleus diwarnai dengan DAPI (Sigma-Aldrich) pada pengenceran 1:1000. Morfologi dan distribusi sel dicitrakan menggunakan mikroskopi confocal (Leica TCS SP8 X).
Karakterisasi Sel dan ECM—Kuantifikasi Kolagen
Sampel yang diambil dari perancah besar dikeringkan beku dan dicerna dengan papain (Merck P3125). Sampel yang dicerna kemudian dikeringkan beku lagi dan dihidrolisis dengan 0,4 м NaOH pada 108 °C semalaman. Setelah hidrolisis, sampel dinetralkan dengan 1,4 м asam sitrat, Kloramin-T (Merck 2426) dan diinkubasi selama 20 menit pada 170 rpm, diikuti dengan penambahan dimetilaminobenzaldehida (Merck 3058). Campuran reaksi diinkubasi pada 60 °C selama 20 menit, dan absorbansi diukur pada 570 nm menggunakan pembaca mikroplat (Clariostar, Jerman).
Karakterisasi Sel dan ECM—Kuantifikasi DNA
Kandungan DNA diukur menggunakan Quant-iT PicoGreen dsDNA Reagent Kit (ThermoFisher, P7589) sesuai petunjuk pabrik. Fluoresensi diukur menggunakan pembaca mikroplat (Clariostar) yang diatur pada eksitasi 485 nm dan emisi 520 nm.
Karakterisasi Sel dan ECM—Kuantifikasi GAG
Glikosaminoglikan diukur dengan uji kolorimetrik dimetilmetilen biru (DMMB, Sigma–Aldrich, AS) mengikuti petunjuk pabrik, dan dikoreksi untuk kandungan DNA. Kandungan GAG dari sampel diukur setelah reaksi pewarna DMMB dengan pembaca mikroplat (Clariostar), mengukur absorbansi pada 525 nm.
Statistik
Perbedaan statistik ditentukan menggunakan ANOVA dengan beberapa perbandingan, yang dilakukan di Prism 10 (GraphPad Prism 10.4.0). Ukuran sampelnya adalah sebagai berikut: biokimia ( n = 6), kemampuan cetak dan analisis mekanis ( n = 5), TFM dan cetakan kondilus ( n = 3). Perbedaan dianggap signifikan jika p ≤ 0,05. Uji Alamar Blue dilakukan pada satu sampel, sehingga tidak termasuk analisis statistik.
