Formulasi Imunosupresif untuk Pertahanan Imunologis terhadap Cedera Otak Traumatis
Abstrak
Cedera otak traumatis (TBI) dan neurodegenerasi berikutnya sebagian didorong oleh peradangan kronis baik secara lokal maupun sistemik. Namun, strategi intervensi klinis saat ini tidak mengurangi gejala sisa peradangan yang memerlukan pengembangan pendekatan inovatif untuk mengurangi peradangan dan meminimalkan efek buruk TBI. Di sini, formulasi subkutan berdasarkan polimer alfa-ketoglutarat (paKG) yang memberikan penghambat glikolisis PFK15 (penghambat PFKFB3, langkah pembatas laju dalam glikolisis), alfa-ketoglutarat (untuk bahan bakar siklus Krebs) dan antigen peptida dari protein proteolipid mielin (PLP139-151) digunakan sebagai formulasi imunosupresif profilaksis dalam model tikus TBI. In vitro, formulasi paKG(PFK15+PLP) merangsang proliferasi sel T regulator imunosupresif dan menginduksi pembentukan sel T helper-2. Bila diberikan secara subkutan di bagian tepi dua minggu sebelum tikus mengalami TBI, formulasi tersebut meningkatkan frekuensi makrofag imunosupresif dan sel dendritik (DC) di bagian tepi dan otak pada hari ke-7 pasca-TBI dan pada hari ke-28 pasca-TBI, sel imunosupresif spesifik PLP yang ditingkatkan menyusup ke otak. Pengukuran imunohistologi neuroinflamasi diubah 28 hari pasca-TBI, proteomik spasial mengungkapkan bukti peningkatan autofagi di penumbra cedera, dan formulasi aktif meningkatkan fungsi motorik. Secara keseluruhan, data ini menunjukkan bahwa formulasi imunosupresif TBI berhasil menginduksi profil antiinflamasi dan mengurangi inflamasi terkait TBI.
1 Pendahuluan
Setiap tahun ≈1,5 juta orang di AS mengalami cedera otak traumatis (TBI). Dari populasi ini, 80.000 hingga 90.000 menderita kecacatan jangka panjang terkait dengan TBI. [ 1 , 2 ] Menariknya, risiko terkena TBI paling tinggi di kalangan remaja, dewasa muda, dan orang yang berusia lebih dari 75 tahun. [ 1 ] TBI juga memiliki prevalensi lebih tinggi di kalangan personel militer, atlet, dan orang-orang di fasilitas pemasyarakatan, dibandingkan dengan populasi umum. [ 2 ] TBI sedang-berat dikaitkan dengan peningkatan risiko penurunan kognitif dan berkembangnya penyakit neurodegeneratif, namun intervensi terapeutik terbatas. [ 3 – 8 ] Oleh karena itu, kami memeriksa kemanjuran partikel polimer imunomodulatori alfa-ketoglutarat (paKG) yang diberikan secara profilaksis sebelum TBI pada tikus untuk mengurangi peradangan kronis yang terkait dengan kecacatan jangka panjang.
Sel imun bawaan seperti makrofag, mikroglia, dan sel dendritik (DC) bertanggung jawab atas peradangan akut setelah TBI. [ 8 – 11 ] DC imun bawaan yang diaktifkan ini menginduksi respons imun adaptif di otak yang menyebabkan peradangan kronis atau bahkan gejala seperti autoimunitas. [ 10 ] Oleh karena itu, mengubah fenotipe sel imun bawaan dan adaptif yang spesifik untuk jaringan otak sebelum cedera dapat mengurangi keparahan TBI. Saat ini, ada pemahaman yang buruk tentang bagaimana sel imun adaptif mendorong dan mempertahankan peradangan di otak. Selain itu, peran sistem imun perifer pada penyebaran respons imun bawaan dan adaptif juga tidak dipahami dengan baik. Oleh karena itu, formulasi baru diperlukan untuk tidak hanya mengurangi peradangan, tetapi juga membantu dalam memahami peran sel imun perifer dalam mengurangi gejala kondisi ini.
Studi telah menunjukkan bahwa respons imun perifer yang dihasilkan oleh DC konvensional memainkan peran penting dalam regulasi homeostatik respons terhadap cedera. Selain itu, DC ini juga menginstruksikan dan menghasilkan sel T imunosupresif untuk mengurangi cedera. [ 12 ] Yang penting, protein matriks ekstraseluler alami dan formulasi biomaterial sintetis memainkan peran penting dalam memodulasi respons imun dalam trauma. [ 13 ] Faktanya, imunoterapi berbasis biomaterial untuk TBI muncul sebagai pendekatan yang menjanjikan untuk meningkatkan pemulihan dan perbaikan. Terapi ini menggunakan bahan canggih seperti hidrogel, peptida yang merakit sendiri, dan nanofiber elektrospun untuk mendukung regenerasi jaringan dan memodulasi respons inflamasi. [ 14 ] Misalnya, hidrogel dapat dikombinasikan dengan faktor pertumbuhan seperti faktor neurotropik yang berasal dari otak (BDNF) dan faktor pertumbuhan fibroblast dasar (bFGF) untuk meningkatkan neurogenesis dan vaskularisasi di lokasi cedera. [ 14 ] Lebih jauh lagi, terapi berbasis makrofag, seperti terapi ransel–makrofag, sedang dieksplorasi untuk menangani komplikasi TBI kronis, termasuk epilepsi pascatrauma dan gangguan kognitif. [ 15 ] Pendekatan ini memanfaatkan kemampuan biomaterial untuk menciptakan lingkungan yang kondusif bagi sel imun, meningkatkan kemanjuran terapeutiknya. Lebih jauh lagi, biomaterial dapat direkayasa untuk melepaskan sitokin antiinflamasi dan agen imunomodulatori lainnya, sehingga mengurangi fase cedera sekunder dan meningkatkan pemulihan secara keseluruhan. Dalam studi ini, mikropartikel paKG (MP) yang sebelumnya telah kami tunjukkan bersifat non-imunogenik [ 12 , 13 ,16] membungkus penghambat glikolisis PFK15 sendiri atau dalam kombinasi dengan antigen peptida PLP 139-151 untuk menghasilkan fenotipe sel imunosupresif dalam model tikus TBI (dampak kortikal terkontrol: CCI).
2 Hasil
2.1 Generasi dan Karakterisasi MP paKG yang Mengenkapsulasi PFK15 dan PLP
Formulasi paKG MP yang dinilai di sini dirancang untuk mengurangi peradangan kronis yang diinduksi TBI dengan menstimulasi sel T imunosupresif yang dapat melakukan kemotaksis ke otak dan mengurangi fungsi sel imun auto-reaktif ( Gambar 1 a ). paKG MP dihasilkan dengan membungkus PFK15 dan PLP menggunakan teknik penguapan emulsi. Mikroskop elektron pemindaian menunjukkan bahwa paKG(PFK15+PLP) MP memiliki morfologi halus; hamburan cahaya dinamis mengukur diameter semua MP pada 1,963 ±.5 µm (Gambar 1b,c ). Hasil SEM menunjukkan varians ukuran yang lebih tinggi dibandingkan dengan hasil DLS (Gambar 1b,c ), yang dapat dikaitkan dengan pengendapan partikel yang lebih besar selama pengukuran DLS. Namun, ukuran partikel masih diidentifikasi dalam kisaran yang dapat difagositosis, [ 18 ] dan karenanya digunakan seperti yang dihasilkan. Kinetika pelepasan menunjukkan pelepasan berkelanjutan PFK15 selama 10 hari dan PLP selama 8 hari (Gambar 1d ). Efisiensi pemuatan PFK15 dalam paKG(PFK15) ditetapkan sebesar 5 ± 0,1% dan dalam paKG(PFK15+PLP) ditetapkan sebesar 10 ± 0,7%. Efisiensi enkapsulasi PFK15 dalam paKG(PFK15) ditetapkan sebesar 7,3 ± 0,1% dan dalam paKG(PFK15+PLP) ditetapkan sebesar 16 ± 1%. Efisiensi pemuatan PLP dalam paKG(PLP) ditetapkan sebesar 1,8 ± 0,03% dan dalam paKG(PLP+PFK15) ditetapkan sebesar 1,085 ± 0,01%. Efisiensi enkapsulasi PLP dalam paKG(PLP) ditetapkan sebesar 2,9 ± 0,06% dan dalam paKG(PLP+PFK15) ditetapkan sebesar 1,08 ± 0,03%. Selanjutnya, kami menetapkan bahwa MP paKG(PFK15+PLP) dapat difagositosis oleh DC. MP paKG(PFK15+PLP) yang diberi tanda fluoresensi diinkubasi dengan DC selama 2 jam dan mikroskopi konfokal mengonfirmasi penyerapan MP ( Gambar 2 a ).
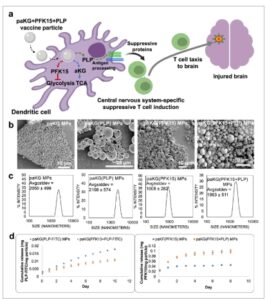
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Partikel yang membungkus PLP dan PFK15 dapat dihasilkan. a) Skema keseluruhan proyek, di mana partikel paKG yang memberikan penghambat glikolisis PFK15, metabolit siklus TCA alfa(ketoglutarat) (aKG) dan peptida PLP sebagai formulasi. b) Gambar mikroskop elektron pemindaian dari partikel menunjukkan bahwa mereka memiliki morfologi yang halus (harap dicatat bahwa batang skala tidak berukuran sama), dan c) DLS menunjukkan ukuran partikel. d) Kinetika pelepasan PLP dan PFK15 ditunjukkan dari mikropartikel paKG(PFK15) dan paKG(PFK15+PLP) (MP), n = 3, rata-rata ± SEM.
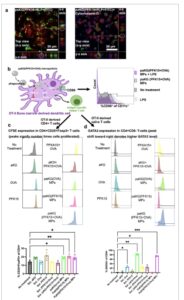
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
DC dapat memfagositosis partikel dan menghasilkan respons sel T imunosupresif secara in vitro. a) Gambar konfokal DC (aktin berlabel MERAH), dengan partikel (berlabel HIJAU) dan nukleus (berlabel BIRU), menunjukkan internalisasi mikropartikel dengan sitokalasin-D (gambar kanan) yang digunakan sebagai kontrol negatif (gambar representatif dari 2 replikasi). Skala batang = 50 µm. b) Skema keseluruhan percobaan dengan DC, dan ekspresi CD86 dalam DC setelah pengobatan dengan paKG(PFK15+OVA) dengan adanya LPS menurun dibandingkan dengan LPS saja (gambar representatif n = 6). c) Ekspresi CFSE pada sel T regulator paling encer (beberapa puncak) saat DC diobati dengan paKG(PFK15+OVA) dan dikultur dengan sel T CD4+ yang diisolasi dari limpa, yang menunjukkan proliferasi tertinggi dibandingkan dengan kontrol (gambaran representatif dari n = 3 replikasi biologis), rata-rata ± SEM, ANOVA satu arah. d) Ekspresi GATA3 pada sel T CD4+ paling meningkat saat DC diobati dengan paKG(PFK15+OVA) dan dikultur dengan sel T CD4+ naif yang diurutkan dari aliran limpa, yang menunjukkan induksi sel T helper 2 (gambaran representatif dari n = 3 replikasi biologis), rata-rata ± SEM, ANOVA satu arah.
2,2 paKG(PFK15+OVA) MPs Menginduksi Sel T Helper Tipe 2 dari Sel T Naif dan Menyebabkan Proliferasi pada Sel T Regulatori
Untuk memahami mekanisme kemampuan imunosupresif DC pada TBI, paKG MP dihasilkan dengan membungkus PFK15 dan ovalbumin (OVA). OVA dipilih sebagai antigen model karena tikus transgenik dengan sel T CD4+ yang spesifik terhadap peptida OVA tersedia, disebut tikus OT-II, untuk mempelajari respons spesifik antigen. Pertama, partikel paKG(PFK15+OVA) diinkubasi dengan DC yang berasal dari sumsum tulang tikus OT-II selama 2 jam dan 24 jam kemudian ekspresi CD86 ditentukan menggunakan flow cytometry. Diamati bahwa bahkan dengan adanya LPS, paKG(PFK15+OVA) MP menurunkan ekspresi CD86 pada DC dibandingkan dengan LPS saja (Gambar 2b ), sehingga menunjukkan fenotip imunosupresif. Selanjutnya, DC dihasilkan dari sumsum tulang tikus OT-II dan kemudian diobati dengan mikropartikel dan kontrol selama 2 jam. Partikel-partikel tersebut dicuci, dan sel-sel selanjutnya dikultur selama 24 jam. Selanjutnya, sel-sel T CD4+ yang diisolasi dari limpa tikus OT-II, diwarnai dengan pewarna proliferasi (CFSE) diinkubasi dengan DC yang diobati pada rasio satu banding enam (sel DC:T) selama 64 jam. Sitometri aliran menilai proliferasi pada sel-sel T CD4+ di mana MP paKG(PFK15+OVA) menyebabkan proliferasi tertinggi pada sel-sel T regulatori (Treg) dibandingkan dengan kontrol (Gambar 2c ), yang menunjukkan perkembangan respons Treg spesifik antigen.
Selain itu, dalam rangkaian percobaan lain, DC yang berasal dari sumsum tulang OT-II diperlakukan dengan mikropartikel selama 2 jam dan kemudian dicuci. Selanjutnya, 24 jam kemudian, DC ini diinkubasi dengan sel T naif yang disortir dari limpa tikus OT-II selama 64 jam. Percobaan ini dilakukan untuk mengevaluasi apakah partikel dapat menginduksi diferensiasi sel T naif menuju subset sel T tertentu. Menariknya, MP paKG(PFK15+OVA) dan paKG(OVA) menghasilkan induksi tertinggi sel T helper tipe 2 (Th2) (Gambar 2d ), yang dalam konteks TBI, dapat menghasilkan sitokin neuroprotektif. [ 5 , 19 ]
2,3 paKG(PFK15+PLP) MPs Menghasilkan Fenotipe Anti-Inflamasi pada Sel Bawaan di Organ Limfoid Sekunder Perifer dan Otak pada Hari ke-7 setelah Cedera
Untuk menguji apakah paKG(PFK15+PLP) MP menghasilkan sel bawaan anti-inflamasi, model tikus CCI yang sudah mapan digunakan. Karena paKG(PFK15) dan paKG(PFK15+PLP) MP menunjukkan perbedaan antara proliferasi Treg dan induksi Th2 secara in vitro, kedua formulasi ini digunakan untuk eksperimen in vivo. Khususnya, penelitian ini menilai pengobatan profilaksis tikus dengan formulasi paKG MP sebelum menginduksi TBI. Singkatnya, tikus jantan dewasa C57Bl/6J disuntik dengan paKG(PFK15+PLP) MP atau paKG(PFK15) MP pada hari ke-0 dan hari ke-14; suntikan salin berfungsi sebagai kelompok kontrol, secara subkutan di bagian perifer (punggung tikus). Tikus kemudian mengalami cedera CCI sedang-berat pada hari ke-17. Pada hari ke-7 pasca cedera (hari ke-24 sejak awal penelitian), tikus disuntik mati dan diperfusi dengan buffer fosfat. Organ diambil untuk analisis flow cytometry termasuk limpa, kelenjar getah bening inguinal, kelenjar getah bening serviks, dan otak ( Gambar 3 a ). Organ yang diisolasi diproses menjadi suspensi sel tunggal dan diwarnai dengan antibodi fluoresen sebelum menjalankan flow cytometry untuk menilai fenotipe sel imun.
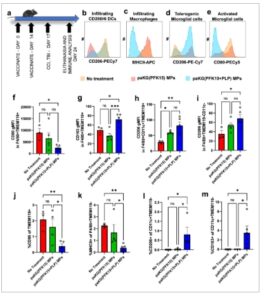
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
paKG(PFK15+PLP) MP meningkatkan respons imun bawaan anti-inflamasi di otak pada hari ke-7. a) Skema rancangan penelitian untuk menganalisis respons imun pada model tikus cedera CCI. b–e) Plot histogram menunjukkan bahwa formulasi paKG(PFK15+PLP) MP memodulasi ekspresi penanda aktivasi dan supresif dalam sel bawaan yang menyusup maupun yang berada di otak. Formulasi paKG(PFK15+PLP) MPs dibandingkan tanpa perlakuan secara signifikan f) menurunkan CD80 gMFI pada sel F4/80+TMEM119+, g) meningkatkan CD163 gMFI pada sel F4/80+TMEM119+, h) meningkatkan CD206 gMFI pada sel F4/80+CD11c+TMEM119+, i) meningkatkan CD206 gMFI pada sel F4/80+TMEM119-, j) menurunkan frekuensi sel mikroglia CD80+TMEM119+, k) menurunkan frekuensi makrofag yang menginfiltrasi MHCII+F4/80+TMEM119-, l) meningkatkan frekuensi DC yang menginfiltrasi CD206+CD11c+TMEM119-, dan m) meningkatkan frekuensi DC yang menginfiltrasi CD163+CD11c+TMEM119-. ANOVA satu arah dengan uji LSD Fisher, * – p < 0,05, ** – p < 0,01, *** – p < 0,001. n = 3–5, Rata-rata ± SEM.
Untuk memahami efek perubahan respons imun bawaan dan adaptif perifer di otak tikus CCI, flow cytometry pada sel-sel yang diisolasi dari otak dilakukan. Di dalam otak, lima populasi diselidiki termasuk sel-sel mikroglia yang diaktifkan, sel-sel mikroglia tolerogenik, makrofag yang menyusup ke otak, DC yang menyusup ke otak, dan fenotipe DC yang tidak diaktifkan yang menyusup ke otak. Skema gating untuk mengidentifikasi sel-sel ini ditunjukkan pada Gambar S1 (Informasi Pendukung). Di otak tikus yang diobati dengan paKG(PFK15+PLP) MP, ekspresi CD206 tetap tinggi pada DC yang menyusup, MHC-II menurun pada makrofag yang menyusup, ekspresi CD206 tetap tinggi pada sel-sel mikroglia, dan CD80 menurun pada sel-sel mikroglia yang diaktifkan (Gambar 3b–e ), dibandingkan dengan kontrol pengobatan salin dan kontrol paKG(PFK15) MP. Data ini menunjukkan bahwa profil aktivasi makrofag dan sel-sel mikroglia dapat berkurang di otak. Kelenjar getah bening serviks yang mengalir dari tikus yang diobati dengan paKG(PFK15+PLP) MP menunjukkan DC migrasi yang meningkat secara signifikan sebagaimana diidentifikasi oleh penanda CD103 dibandingkan dengan tikus yang diobati dengan paKG(PFK15) MP atau salin (Gambar S2b , Informasi Pendukung). Selain itu, dalam populasi DC migrasi, frekuensi sel yang mengekspresikan penanda inflamasi CD80 dan CD86 menurun secara signifikan dalam kondisi paKG(PFK15) MP dan paKG(PFK15+PLP) MP dibandingkan dengan kontrol salin (Gambar S2c , Informasi Pendukung). Selain itu, dalam kelenjar getah bening inguinal, paKG(PFK15) MP secara signifikan menurunkan frekuensi DC MHCII+CD86+, yang bertanggung jawab untuk menginduksi respons T helper (Th), dibandingkan dengan kontrol salin (Gambar S2d , Informasi Pendukung). Padahal, paKG(PFK15+PLP) MP secara signifikan menurunkan DC MHCII+CD86+ jika dibandingkan dengan paKG(PFK15) MP dan kondisi salin (Gambar S2d , Informasi Pendukung). Mirip dengan DC, formulasi paKG(PFK15+PLP) MP meningkatkan frekuensi makrofag migrasi jika dibandingkan dengan paKG(PFK15) MP dan kondisi tanpa perlakuan (Gambar S2e , Informasi Pendukung). Selain itu, dalam populasi ini baik paKG(PFK15) MP maupun paKG(PFK15+PLP) MP menurunkan frekuensi sel yang positif untuk penanda aktivasi CD80 dan CD86 (Gambar S2f , Informasi Pendukung). paKG(PFK15+PLP) MP juga meningkatkan frekuensi makrofag yang mengekspresikan penanda imunosupresif CD163 (Gambar S2g, Informasi Pendukung). Data ini menunjukkan bahwa formulasi paKG(PFK15+PLP) tidak hanya meningkatkan makrofag migrasi, tetapi juga menurunkan penanda inflamasi pada DC dan makrofag dalam populasi ini, dan meningkatkan penanda supresif pada populasi makrofag migrasi. Temuan ini sangat penting karena kelenjar getah bening serviks yang mengalir dapat mencerminkan respons imun yang dihasilkan di otak. Khususnya, sel imun bawaan memodifikasi respons imun adaptif, dan oleh karena itu, dalam penelitian ini fenotipe sel T adaptif juga dianalisis menggunakan flow cytometry (lihat data di bawah).
Di otak, paKG(PFK15+PLP) MP menurunkan ekspresi CD80, meningkatkan CD163, dan meningkatkan CD206 pada sel mikroglia dibandingkan dengan kontrol saline. Selain itu, paKG(PFK15+PLP) MP meningkatkan CD163 dan CD206 pada sel mikroglia dibandingkan dengan kontrol paKG(PFK15) MP (Gambar 3f–h ; Gambar S4 , Informasi Pendukung). Selain itu, paKG(PFK15+PLP) MP meningkatkan ekspresi CD206 dibandingkan dengan tanpa pengobatan dan paKG(PFK15) MP dalam makrofag yang menyusup (Gambar 3i ), secara signifikan menurunkan frekuensi sel mikroglia CD80+ pro-inflamasi (Gambar 3j ), secara signifikan menurunkan frekuensi makrofag MHCII+ pro-inflamasi yang menyusup (Gambar 3k ), dan secara signifikan meningkatkan frekuensi sel DC anti-inflamasi CD206+ dan CD163 yang menyusup (Gambar 3l,m ). Dengan demikian, penelitian ini menunjukkan bahwa paKG(PFK15+PLP) MP meningkatkan respons imun bawaan anti-inflamasi di otak pada hari ke-7.
2,4 paKG(PFK15+PLP) MP Mengembangkan Respons Sel T Adaptif Spesifik Antigen di Otak, Limpa, dan Kelenjar Getah Bening pada Hari ke-7 Pasca Cedera
Efek pengenalan PLP, peptida terkait selubung mielin, ke dalam formulasi MP untuk memodifikasi cabang adaptif sistem imun diperiksa dengan mengikuti garis waktu penyuntikan, cedera, dan pengorbanan yang sama seperti yang dijelaskan di atas (Gambar 3a ). Sel T di otak, limpa, dan kelenjar getah bening dianalisis dengan flow cytometry. Skema gating untuk mengidentifikasi sel-sel ini ditunjukkan pada Gambar S3 (Informasi Pendukung). Di otak, hanya tikus yang diobati dengan paKG(PFK15+PLP) MP yang positif untuk populasi sel T helper memori sentral tipe 2 spesifik PLP ( Gambar 4a ) . Sel-sel ini menghasilkan memori jangka panjang terhadap peptida spesifik dan mengeluarkan IL-4; oleh karena itu, temuan ini mungkin penting dalam mengurangi respons pro-inflamasi di masa mendatang terhadap antigen PLP. Selain itu, hanya tikus yang diobati dengan paKG(PFK15+PLP) MP yang menunjukkan peningkatan frekuensi sel T regulator (Treg) secara signifikan di otak (Gambar 4b ). Menariknya, baik paKG(PFK15) maupun paKG(PFK15+PLP) MP menurunkan sel T memori sentral CD8+ di otak (Gambar 4c ). Pengurangan populasi sel ini mungkin terbukti penting karena mereka mungkin terlibat langsung dalam membunuh oligodendrosit yang mengekspresikan PLP. [ 4 ] Sel-sel ini penting dalam konteks TBI karena sel-sel spesifik antigen ini menginduksi peradangan dengan mengeluarkan sitokin pro-inflamasi. [ 20 ]
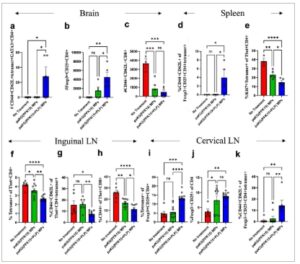
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
paKG(PFK15+PLP) MPs meningkatkan respons imun adaptif anti-inflamasi di otak, limpa, dan kelenjar getah bening. Semua grafik menggambarkan jaringan/organ yang dikumpulkan pada hari ke-7 pasca-TBI. Di otak, formulasi paKG(PFK15+PLP) MPs a) peningkatan jumlah sel T helper memori sentral tipe 2 spesifik PLP, b) peningkatan jumlah sel T regulator dan c) penurunan jumlah sel T CD8+ memori sentral. Di limpa, formulasi paKG(PFK15+PLP) MPs d) peningkatan frekuensi sel T regulator memori sentral spesifik PLP, dan e) penurunan frekuensi proliferasi sel Th1 spesifik PLP. Di kelenjar getah bening inguinal, formulasi paKG(PFK15+PLP) MPs f) penurunan frekuensi sel Th1 spesifik PLP, g) penurunan frekuensi sel Th1 memori sentral spesifik PLP, h) penurunan frekuensi sel T sitotoksik yang diaktifkan. Pada kelenjar getah bening serviks, formulasi paKG(PFK15+PLP) MPs i) meningkatkan frekuensi sel T regulator spesifik PLP, j) meningkatkan frekuensi sel T regulator dan k) meningkatkan frekuensi sel T regulator memori sentral spesifik PLP. ANOVA satu arah dengan uji LSD Fisher, * – p < 0,05, ** – p < 0,01, *** – p < 0,001, **** – p < 0,0001. n = 5–10, rata-rata ± SEM.
Respon imun di limpa dan kelenjar getah bening inguinal menunjukkan respons sistemik terhadap MP ini dalam konteks TBI, dan oleh karena itu formulasi ini juga memeriksa kemampuan untuk memodulasi respons imun perifer. [ 21 ] Dalam populasi Treg, paKG(PFK15+PLP) MP secara signifikan meningkatkan frekuensi sel T memori sentral spesifik PLP imunosupresif di limpa (Gambar 4d ). Selain itu, paKG(PFK15+PLP) MP secara signifikan menurunkan frekuensi proliferasi sel T helper tipe 1 spesifik PLP dibandingkan dengan paKG(PFK15) MP dan kontrol salin di limpa (Gambar 4e ). paKG(PFK15+PLP) MP menurunkan respons Th1 spesifik PLP dibandingkan dengan paKG(PFK15) MP dan tidak ada kontrol pengobatan di kelenjar getah bening inguinal (Gambar 4f ). paKG(PFK15+PLP) MP menurunkan frekuensi Th1 memori sentral spesifik-PLP dibandingkan dengan paKG(PFK15) MP, dan tidak ada kontrol pengobatan pada kelenjar getah bening inguinal (Gambar 4g). Selain itu, paKG(PFK15+PLP) MP menurunkan frekuensi sel Th1 sitotoksik teraktivasi dibandingkan dengan paKG(PFK15) MP, dan tidak ada kontrol pengobatan pada kelenjar getah bening inguinal (Gambar 4h). Frekuensi Treg dan populasi Treg spesifik-antigen tidak dimodifikasi pada kelenjar getah bening inguinal dibandingkan dengan kontrol (Gambar S5 , Informasi Pendukung). Yang penting, paKG(PFK15+PLP) MP meningkatkan Treg, Treg spesifik-PLP, dan frekuensi Treg spesifik-PLP memori sentral dibandingkan dengan paKG(PFK15) MP dan tidak ada kontrol pengobatan pada kelenjar getah bening serviks yang mengalir (Gambar 4i–k ). Sel-sel ini penting dalam menghasilkan respons imunosupresif jangka panjang spesifik antigen dalam konteks peradangan kronis/akut pada sistem saraf. [ 22 ]
2,5 paKG(PFK15+PLP) MP Meningkatkan Penanda Protein Autofagi di Otak Secara Spasial pada Hari ke-7 Pasca Cedera
Kelompok tikus tambahan yang mengikuti garis waktu eksperimen yang sama (Gambar 3a ) digunakan untuk melakukan analisis proteomik spasial pada irisan otak menggunakan Nanostring; kelompok tersebut mencakup kontrol naif (tanpa kontrol cedera) atau tikus yang mengalami CCI yang disuntik dengan saline atau paKG(PFK15+PLP) MP. Profil proteomik dari kedua kelompok yang cedera dibandingkan dengan kontrol naif untuk mengidentifikasi perubahan dari garis dasar yang sehat. Wilayah minat (ROI) yang paling dekat dengan lokasi cedera dipilih untuk dianalisis lebih lanjut ( Gambar 5a ) . Pada tikus yang cedera yang diobati dengan saline, enam protein diekspresikan secara berbeda secara signifikan (DE) dibandingkan dengan kontrol naif: cathepsin D (CTSD), protein tyrosine phosphatase receptor type C (CD45), cluster of differentiation 9 (CD9), cluster of differentiation 11b (CD11b), ionized calcium-binding adapter molecule 1 (Iba1), dan glial fibrillary acids protein (GFAP). Pada tikus yang terluka yang diobati dengan paKG(PFK15+PLP) MP, delapan protein mengalami DE: faktor transkripsi EB (TFEB), kinase 1 mirip unc-51 (ULK1), sinaptofisin (SYP), reseptor faktor perangsang koloni 1 (CFS1R), CD45, IBA1, CD11b, dan GFAP (Gambar 5b ).
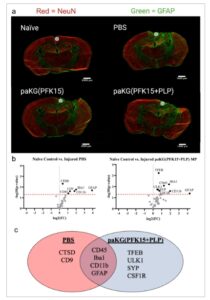
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Penanda protein neuroproteksi di otak tikus yang diberi paKG(PFK15+PLP) MP pada hari ke-7 pasca cedera. a) Untuk analisis Nanostring, irisan jaringan diwarnai terlebih dahulu dengan imunomarker (GFAP – Hijau, NeuN – Merah) untuk mengidentifikasi area yang diinginkan. Lingkaran menunjukkan ROI yang dianalisis di seluruh wilayah. Skala Batang = 1.000 µm. b) Plot gunung berapi yang mengilustrasikan hasil proteomik spasial NanoString untuk tikus PBS yang cedera yang dijadikan dasar untuk tikus kontrol naif. Plot gunung berapi tikus paKG(PFK15+PLP) yang cedera yang dijadikan dasar untuk tikus kontrol naif. Garis putus-putus merah menunjukkan p = 0,05, dan semua protein signifikan di atas ambang batas tersebut diberi label. c) Diagram Venn yang mengilustrasikan protein yang meningkat secara signifikan pada kelompok yang tidak diobati (PBS) dan diobati (paKG(PFK15+PLP)) dibandingkan dengan kontrol naif. n = 4 tikus per kelompok, jumlah protein dinormalisasi dengan jumlah protein pemeliharaan dalam ROI. Setiap protein menjalani uji- t (varians sama dua sisi) secara individual. Tidak ada faktor koreksi yang diterapkan.
Perbandingan antara tikus yang naif dan yang cedera yang diobati dengan salin menghasilkan dua protein yang tidak ditemukan sebagai DE dalam perbandingan antara tikus yang naif dan yang cedera yang diobati dengan paKG(PFK15+PLP) MP: CD9 dan CTSD (Gambar 5b ). CD9 diekspresikan oleh semua subset utama leukosit, termasuk sel T CD4+, sel T CD8+, sel B, dan makrofag. [ 23 ] CD9 memainkan peran kunci dalam pensinyalan dan adhesi sel imun. Ekspresi CD9 dapat memiliki efek positif atau negatif tergantung pada situasinya, tetapi sebagian besar dianggap sebagai anti-inflamasi. [ 24 ] Di otak, CD9 juga ditemukan pada oligodendrosit dewasa. [ 25 ] Namun, demielinasi adalah ciri khas TBI yang terdefinisi dengan baik, [ 26 ] sehingga peningkatan regulasi CD9 pada tikus yang cedera dibandingkan dengan kontrol naif yang sehat kemungkinan besar disebabkan oleh ekspresi sel imun. CTSD adalah protein lisosomal pada neuron dan sel glia yang memicu apoptosis neuron dan proliferasi sel. CTSD secara khusus mengaktifkan protein pro-apoptotik, termasuk Bid dan CASP3. [ 27 ]
Perbandingan paKG(PFK15+PLP) MP naif versus cedera menghasilkan empat protein yang tidak ditemukan sebagai DE dalam perbandingan saline naif versus cedera: TFEB, ULK1, SYP, dan CSF1R (Gambar 5b ). TFEB dan ULK1 keduanya terkait dengan autofagi. TFEB adalah faktor transkripsi yang meningkatkan transkripsi gen terkait autofagi [ 28 ] dan ULK1 mengintegrasikan sinyal untuk menginduksi autofagi. [ 29 ] SYP adalah protein vesikel sinaptik yang ditemukan dalam neuron, dan peningkatan ekspresi SYP biasanya dikaitkan dengan peningkatan kepadatan sinaptik. [ 30 , 31 ] Setelah cedera, neuroplastisitas dan sinaptogenesis memungkinkan otak untuk merombak dan memulihkan koneksi, yang ditunjukkan oleh protein neuronal seperti SYP. [ 32 – 34 ] CSF1R di sistem saraf pusat berperan dalam homeostasis dan proliferasi mikroglia, serta kelangsungan hidup neuron [ 35 , 36 ]
Dari sepuluh protein DE antara dua perbandingan, empat adalah DE di keduanya: CD11b, Iba1, CD45, dan GFAP (Gambar 5c ). CD11b dan IBA1 terutama terkait dengan mikroglia dan makrofag. CD11b, juga dikenal sebagai integrin alfa M, adalah reseptor yang meningkat regulasinya selama aktivasi mikroglia dan sering dikaitkan dengan peradangan neurodegeneratif. [ 37 ] IBA1 adalah protein pengikat kalsium yang meningkat regulasinya di mikroglia dan makrofag setelah aktivasi. [ 38 ] CD45, juga dikenal sebagai antigen umum leukosit, adalah protein yang ditemukan terutama pada permukaan sel hematopoietik, seperti sel T, sel B, dan makrofag. [ 39 ] CD45 juga ditemukan dalam konsentrasi rendah di mikroglia. [ 40 ] GFAP adalah filamen intermediet yang meningkat regulasinya selama aktivasi astrosit. [ 41 ]
2,6 paKG(PFK15+PLP) MP Mengurangi Gangguan Fungsi Motorik, Mengatur Respons Sel T Kronis, dan Profil Neuroinflamasi Lokal pada Hari ke-28 Pasca Cedera
Untuk menilai dampak pengobatan profilaksis paKG(PFK15+PLP) MP pada gangguan fungsional dan profil neuroinflamasi pada titik waktu yang lebih lama pasca-TBI, kelompok tikus kedua diselesaikan dengan desain studi yang diuraikan dalam Gambar 6a . Serangkaian penilaian motorik meliputi grid walk (hari ke-1 pasca-cedera), rotarod (hari ke-1–8 pasca-cedera), dan lapangan terbuka (hari ke-27 pasca-cedera). Pada hari ke-28 pasca-cedera, tikus dikorbankan dan dibagi rata di antara kelompok analisis jaringan untuk flow cytometry dan imunohistokimia (otak). Pada hari ke-1 pasca-cedera, efek cedera yang signifikan tetapi tidak ada efek pengobatan terdeteksi dari persentase kesalahan kaki pada grid walk (Gambar S6 , Informasi Pendukung). Rotarod dilakukan tanpa melatih hewan sebelum cedera untuk mengevaluasi fungsi motorik dan pembelajaran motorik (Gambar 6b ). Data disajikan sebagai peningkatan lipat dari hari ke-1 untuk menilai dampak pada pembelajaran motorik berkenaan dengan defisit cedera awal yang spesifik untuk setiap hewan. Selama minggu pengujian (hari ke-1–8 pasca-cedera), hewan yang diobati dengan paKG(PFK15+PLP) menunjukkan peningkatan lipat tertinggi dari hari ke-1, secara signifikan lebih besar daripada paKG(PFK15) dan naif (tanpa kontrol cedera); pada hari ke-8, perbandingan post-hoc mendekati signifikan untuk paKG(PFK15+PLP) dibandingkan dengan tanpa kontrol pengobatan (Gambar 6b ). Hasil ini menunjukkan bahwa tikus yang disuntik dengan paKG(PFK15+PLP) dapat menyebabkan peningkatan pembelajaran motorik pasca-TBI. Uji lapangan terbuka pada 27 hari pasca-cedera mengungkapkan jarak yang ditempuh secara signifikan lebih besar dalam kelompok paKG(PFK15+PLP) MP dibandingkan dengan kelompok naif dan paKG(PFK15) MP (Gambar 6c,d ). Tidak ada perbedaan signifikan dalam waktu kumulatif di bagian tengah atau transisi ke bagian tengah (data tidak ditampilkan). Penafsiran hasil ini rumit, karena beberapa penelitian mengartikan jarak tempuh yang lebih jauh sebagai berkurangnya kecemasan, sementara penelitian lain menyatakan bahwa hal ini menunjukkan kecemasan yang lebih besar karena hiperaktif. [ 5 – 7 ]
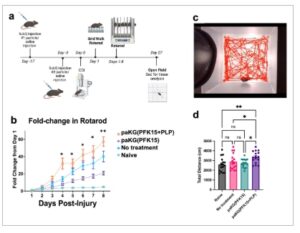
Gambar 6
Buka di penampil gambar
Presentasi PowerPoint
Fungsi motorik meningkat pada tikus yang diberi perlakuan paKG(PFK15+PLP) MP bersamaan dengan respons imun adaptif yang berubah. a) Garis waktu desain studi untuk injeksi formulasi, CCI, dan uji perilaku. b) paKG(PFK15+PLP) MP menunjukkan peningkatan pembelajaran motorik yang signifikan dibandingkan dari hari ke-1 hingga hari ke-8 dibandingkan dengan semua kelompok lain pada rotarod. * p < 0,05 paKG(PFK15+PLP) MP dibandingkan dengan paKG(PFK15) dan naif, * p < 0,05 paKG(PFK15+PLP) MP dibandingkan dengan semua kelompok; n = 14–16/kelompok. ANOVA dua arah dengan pengukuran berulang dengan Fisher’s LSD. c) Gambar representatif dari jejak tikus lapangan terbuka yang dihasilkan dengan DeepLabCut. d) paKG(PFK15+PLP) MPs secara signifikan meningkatkan jarak total yang ditempuh tikus dibandingkan dengan tikus yang naif (** p < 0,01) dan paKG(PFK15) dan tanpa perawatan (* p < 0,05); n = 14–16/kelompok, ANOVA satu arah dengan Fisher’s LSD.
Untuk analisis imunohistokimia irisan koronal otak hari ke-28 pasca-cedera ( Gambar 7 ), perbandingan langsung untuk setiap imunomarker/jumlah sel diselesaikan dan dicatat signifikansi yang nyata di seluruh kelompok perlakuan dan di berbagai regio anatomi (ANOVA satu arah; lihat Tabel S1–S5 , Informasi Pendukung untuk detail statistik). Untuk semua regio/kelompok, tidak ada perbedaan signifikan dalam persentase area DAPI (Gambar S7 , Informasi Pendukung), yang mengindikasikan bahwa jumlah sel di antara kelompok tidak berbeda dan perbedaan selanjutnya dalam imunomarker fenotipik bukan karena perbedaan jumlah total sel. Perbandingan berpasangan post-hoc selanjutnya lebih lanjut menunjukkan peningkatan regulasi sel inflamasi dalam kelompok MP paKG (PFK15) dibandingkan dengan kelompok naif tanpa adanya efek cedera pada penanda berikut (Gambar 7e–l ): persentase sel Iba1+ di hemisfer ipsilateral dan hipokampus; persentase sel CD86+ di hemisfer ipsilateral, korteks serebral, dan korpus kalosum; dan persentase sel Iba1+/CD86+ di korteks serebral ipsilateral dan korpus kalosum. Di hemisfer ipsilateral dan talamus, terdapat persentase sel CD86+, persentase sel Iba1+/CD86+, dan persentase area CD86+ yang secara signifikan lebih besar pada kelompok MP paKG (PFK15) dibandingkan dengan kelompok MP paKG (PFK15+PLP) (Gambar 7e–l ). Khususnya, ada ekspresi sel inflamasi yang signifikan lebih besar pada kelompok tanpa pengobatan dan paKG (PFK15) MPs dibandingkan dengan naif, tetapi tidak pada kelompok paKG (PFK15+PLP) MPs dibandingkan dengan naif untuk penanda berikut: persentase sel Iba1+/CD86+ di hemisfer ipsilateral, persentase area GFAP di talamus ipsilateral, dan persentase area CD86 di korteks serebral ipsilateral (Gambar 7e–l ). Ada efek cedera yang signifikan tetapi tidak ada efek pengobatan yang signifikan dalam persentase sel Iba1+ di korteks serebral ipsilateral, korpus kalosum, dan talamus; persentase area GFAP di hemisfer ipsilateral dan korpus kalosum; dan persentase area CD86 di korpus kalosum ipsilateral. Sementara hippocampus juga dianalisis, tidak ada perbedaan signifikan selain persentase sel Iba1+ yang lebih besar dalam kelompok paKG (PFK15) MPs dibandingkan dengan kelompok naif (Gambar S8–S10 , Informasi Pendukung). Secara kolektif, paKG(PFK15) MPs sendiri dapat memperburuk penanda neuroinflamasi tertentu dalam hemisfer yang cedera di atas kontrol tanpa pengobatan. Namun, kami menekankan bahwa formulasi penuh paKG(PFK15+PLP) MPs mengurangi neuroinflamasi, dalam beberapa kasus di bawah kontrol tanpa pengobatan.
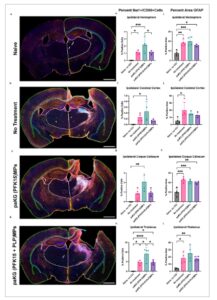
Gambar 7
Buka di penampil gambar
Presentasi PowerPoint
Imunomarker neuroinflamasi diubah dengan paKG(PFK15+PLP) MP. a–d) Gambaran IHC representatif dari irisan otak koronal pada hari ke-28 pasca-cedera dari naif utuh, CCI + tanpa pengobatan, CCI + paKG(PFK15), dan CCI + paKG(PFK15+PLP). Anotasi menggambarkan segmentasi untuk analisis regio anatomi (kuning = hemisfer, hijau = korteks, putih = talamus, biru kehijauan = korpus kalosum, merah = hipokampus). Skala Batang = 1.000 µm. e–l) Kuantifikasi penanda neuroinflamasi utama di hemisfer ipsilateral, korteks serebral, korpus kalosum, dan talamus. e–h) Persentase total sel yang imunopositif untuk Iba1 dan CD86, yang menunjukkan fenotip mikroglia aktif, yang paling menonjol dalam pengobatan CCI + paKG(PFK15). i–l) Persentase area positif imunopewarnaan GFAP dalam setiap ROI anatomi. n = 4 tikus per kelompok, *** p < 0,001, ** p < 0,01, dan * p < 0,05.
3 Diskusi
Perawatan konvensional untuk TBI seperti kortikosteroid dan metilprednisolon bekerja untuk mengurangi pembengkakan dan pendarahan tengkorak. [ 42 – 44 ] Namun, perawatan ini menyebabkan penekanan kekebalan, membuat sistem kekebalan tidak mampu melawan infeksi. [ 45 ] Secara historis, terapi berbasis biomaterial telah berpusat di sekitar suntikan hidrogel atau nanopartikel lokal untuk regenerasi neuron, [ 46 ] perekrutan populasi progenitor saraf endogen, penurunan neuroinflamasi, dan promosi model angiogenesis dan antioksidan. [ 47 , 48 ] Sementara beberapa terapi berbasis biomaterial berhasil dalam menargetkan neuroinflamasi di otak, [ 49 – 54 ] mereka gagal untuk mengatasi kontrol peradangan spesifik antigen. Di sisi lain, beberapa biomaterial telah terbukti menargetkan peradangan dengan menginduksi toleransi [ 55 , 56 ] dan toleransi imun spesifik antigen terutama pada penyakit autoimun telah menjadi pusat perhatian. [ 17 , 57 – 59 ] Namun, menginduksi toleransi profilaksis dalam sistem TBI sambil mempertahankan toleransi yang berkelanjutan masih merupakan tantangan tersendiri.
Dalam studi ini, kami menggunakan paKG(PFK15+PLP) MP untuk memodulasi respons imun perifer dan memengaruhi hasil TBI. PFK15 dan PLP digunakan untuk studi ini dan efisiensi enkapsulasi serta kapasitas pemuatan untuk peptida hidrofilik kecil dan PFK15 yang sukar larut dalam air yang diamati merupakan ciri khas bahan poliester hidrofobik. [ 60 ] Kinetika pelepasan enkapsulasi diamati, yang merupakan ciri khas mikropartikel poliester. [ 61 ] Kinetika pelepasan ini mungkin disebabkan oleh campuran erosi massal dan erosi permukaan akibat hidrolisis. Dalam studi mendatang, kemampuan formulasi ini untuk melepaskan obat secara berkelanjutan untuk periode yang lebih lama akan diuji. Untuk tujuan ini, metodologi untuk mengenkapsulasi obat ini dapat dioptimalkan untuk lebih meningkatkan enkapsulasi dan kapasitas pemuatan dalam partikel paKG.
Kami sebelumnya telah menunjukkan bahwa formulasi paKG, yang memberikan PFK15 dan antigen, dapat menurunkan ekspresi CD86 baik secara in vitro maupun in vivo. [ 17 ] Selain itu, formulasi ini meningkatkan siklus sitrat (siklus Krebs, seperti yang ditunjukkan oleh analisis metabolomik), OXPHOS, dan rantai transpor elektron, sekaligus mengurangi glikolisis (ECAR) dan ekspresi gen yang terkait dengan respons pro-inflamasi dalam BMDC secara in vitro. Temuan ini menunjukkan bahwa paKG(PFK15 + PLP) MP dapat meningkatkan respons imun spesifik antigen yang supresif. Oleh karena itu, formulasi ini dapat bermanfaat untuk memodulasi respons imun dalam penyakit inflamasi seperti TBI.
TBI menyebabkan infiltrasi leukosit yang cepat ke dalam otak yang didominasi oleh monosit. [ 62 – 64 ] Namun, respons makrofag terkait TBI telah terbukti menurun selama periode 3 hari pasca cedera. [ 65 ] Penurunan makrofag yang bersirkulasi dan khususnya mikrofag terpolarisasi M2 beberapa hari pasca TBI dapat merugikan pemulihan cedera. paKG(PFK15+PLP) MP adalah formulasi tolerogenik spesifik antigen dan memulihkan penipisan makrofag dengan meningkatkan makrofag CD206+ di otak (Gambar 3i,l ). Mikroglia residen dan sel T yang menyusup ke jaringan dapat menyebabkan peradangan kronis di otak. [ 66 ] Oleh karena itu, mengurangi mikroglia aktif dan sel T yang menyusup dapat secara masif mengatur peradangan kronis dan akut. [ 67 , 68 ] paKG(PFK15+PLP) MP efektif dalam menurunkan ekspresi CD80 pada sel mikroglia residen di otak (Gambar 3f ) dan meningkatkan mikroglia reparatif (Gambar 3g,h ). Mereka juga meningkatkan jumlah sel T regulator di jaringan otak (Gambar 4b ).
Kerusakan pada sawar darah-otak memungkinkan kebocoran aliran sel inflamasi ke otak dari kelenjar getah bening di sekitarnya. Dengan cairan serebrospinal yang mengalir ke kelenjar getah bening serviks, sel-sel otak yang cedera menyediakan antigen yang dibawa ke kelenjar getah bening sehingga mengaktifkan sel-sel imun. Oleh karena itu, modulasi respons sel imun [ 69 – 72 ] di kelenjar getah bening perifer menjadi penting untuk inflamasi terkait cedera. Efek MP paKG(PFK15+PLP) dalam meningkatkan sel T regulator spesifik antigen di kelenjar getah bening serviks (Gambar 4i–k ) menunjukkan cara yang menjanjikan dalam mempertahankan toleransi perifer. Lebih jauh lagi, penurunan sel Th1 spesifik antigen di kelenjar getah bening inguinal (Gambar 4f–h ) memberikan perlindungan sistemik terhadap inflamasi yang dimediasi antigen.
Peradangan terkait TBI dapat menjadi sistemik karena peningkatan jumlah leukosit dan sitokin sirkulasi yang dikenal sebagai sindrom respons inflamasi sistemik. [ 73 ] Kehadiran sel T dalam darah bahkan setelah 60 hari pasca-cedera [ 74 ] pada tikus memerlukan pendekatan pengobatan sistemik untuk TBI. Penurunan frekuensi sel Th1 spesifik PLP, Th1 spesifik PLP memori, dan sel T sitotoksik yang diaktifkan dalam kelenjar getah bening inguinal pada kelompok pengobatan (Gambar 4f–h ) dapat menyiratkan regulasi sistemik peradangan pasca-cedera. Selain tes ini, pengukuran sitokin seperti TNF-α, TGF-β, IL-6, IL-10, akan lebih jauh menjelaskan efek paKG(PFK15+PLP) MP pada respons imun perifer dan akan dipertimbangkan dalam penelitian mendatang.
Proteomik spasial memungkinkan kami untuk melokalisasi ekspresi protein saraf dalam wilayah tertentu pada 7 hari pasca-cedera, dalam kasus kami suatu wilayah dalam korteks ipsilateral. Analisis kami terhadap subpopulasi sel imun (Gambar 3 dan 4 ) menunjukkan bahwa pengobatan paKG(PFK15+PLP) MP mengarahkan sel imun ke arah fenotip anti-inflamasi dalam seluruh otak. Enam protein (CD9, CTSD, TFEB, ULK1, SYP, CSF1R) menunjukkan perbedaan dalam ekspresi antara pengobatan paKG(PFK15+PLP) MP dan tikus yang diberi PBS jika dibandingkan dengan kontrol naif. CD9 dan CTSD menunjukkan peningkatan regulasi dalam kelompok PBS (Gambar 5b,c ), dan TFEB, ULK1, SYP, dan CSF1R menunjukkan DE dalam kelompok paKG(PFK15+PLP) MP (Gambar 5b,c ).
Autofagi adalah proses biologis utama yang mendegradasi zat-zat berbahaya di dalam sel dengan memanfaatkan autophagosom dan lisosom. [ 75 ] Dua protein terkait autofagi, ULK1 dan TFEB, hanya meningkat regulasinya pada kelompok paKG(PFK15+PLP) MP (Gambar 5 ). Baik TFEB maupun ULK1 memulai autofagi. [ 28 , 29 ] Penelitian sebelumnya telah menunjukkan bahwa fluks autofagi terganggu pada model CCI, yang menyebabkan efek neurotoksik. [ 76 ] Mempromosikan autofagi telah dieksplorasi sebagai terapi potensial untuk meningkatkan kesehatan neuron. [ 77 , 78 ] Secara keseluruhan, peningkatan ekspresi TFEB, ULK1, CSF1R, dan SYP pada kelompok paKG(PFK15+PLP) MP dapat menjadi indikasi aktivitas autofagi yang sehat dan efek neuroprotektif setelah pengobatan. Kelompok paKG(PFK15+PLP) MP juga tidak menunjukkan DE CTSD, yang mungkin mengindikasikan berkurangnya apoptosis di otak.
Analisis perilaku memberikan wawasan ke dalam dampak fungsional dari perawatan formulasi imunosupresif untuk TBI. Hasil kami menunjukkan bahwa tikus yang disuntik dengan paKG(PFK15+PLP) dapat menyebabkan peningkatan pembelajaran motorik pasca-TBI (Gambar 6b ). Interpretasi bidang terbuka lebih bernuansa, di mana kelompok paKG(PFK15+PLP) MP menempuh jarak yang jauh lebih jauh jika dibandingkan dengan kontrol naif utuh dan kelompok paKG(PFK15) MP (Gambar 6d ). Temuan ini menarik karena komunitas neurotrauma dan ilmu saraf terpecah apakah perilaku ini ditafsirkan sebagai perbaikan atau eksaserbasi patologi. Beberapa penelitian menafsirkan jarak yang lebih jauh yang ditempuh sebagai berkurangnya kecemasan, sementara yang lain menyatakan bahwa itu menunjukkan kecemasan yang lebih besar karena hiperaktif. Untuk menentukan apakah perbedaan yang diamati positif atau negatif, diperlukan lebih banyak penelitian.
Pemeriksaan neuroinflamasi pada hari ke-28 pasca-cedera melalui IHC mengungkapkan bahwa kelompok paKG(PFK15) MP secara konsisten menunjukkan ekspresi CD86 dan kolokalisasi CD86/Iba1 yang meningkat secara signifikan dibandingkan dengan kelompok naif utuh, tanpa pengobatan, dan paKG(PFK15+PLP) MP, bahkan tanpa adanya efek cedera (Gambar 7 ). Sebaliknya, ada respons inflamasi yang secara signifikan lebih besar pada kelompok tanpa pengobatan dan paKG(PFK15) MP dibandingkan dengan naif, tetapi tidak pada kelompok paKG(PFK15+PLP) MP dibandingkan dengan naif untuk persentase sel CD86+ dan persentase sel Iba1+/CD86+ di hemisfer ipsilateral serta persentase area GFAP dan persentase area CD86 di talamus ipsilateral (Gambar 7e–l ). Lebih jauh lagi, ketika PLP hadir dalam kelompok paKG(PFK15+PLP) MPs, penanda inflamasi jauh lebih sedikit daripada dalam kelompok paKG(PFK15) MPs, seperti dalam kasus persentase sel CD86+, persentase sel Iba1+/CD86+, dan persentase area CD86 di hemisfer ipsilateral dan talamus, tanpa mempengaruhi area lesi (Gambar 7e–l ; Gambar S11 , Informasi Pendukung). Secara kolektif, hasil-hasil ini mengindikasikan bahwa elemen spesifik antigen diperlukan untuk efek potensial. Lebih jauh lagi, imunopewarnaan neuroinflamasi ini berkorelasi dengan jarak tempuh yang diamati ketika berfokus hanya pada kelompok-kelompok perlakuan paKG MP, di mana kelompok paKG(PFK15+PLP) MPs lebih tinggi dibandingkan dengan kelompok paKG(PFK15) MPs dalam uji lapangan terbuka.
4 Kesimpulan
Sebagai kesimpulan, data menunjukkan bahwa formulasi spesifik PLP yang menargetkan otak dengan MP paKG dapat dihasilkan dan dimodulasi respons imun bawaan secara sistemik. Modulasi respons imun bawaan ini menimbulkan perubahan dalam sistem imun adaptif dan menyebabkan infiltrasi sel imun bawaan dan adaptif ke dalam otak. Yang penting, penelitian ini menunjukkan bahwa modulasi sistem imun perifer juga menyebabkan peningkatan pembelajaran motorik, modulasi perilaku seperti kecemasan, perubahan fenotipe sel mikroglia yang ada di otak, dan dengan demikian dapat digunakan sebagai strategi untuk mengurangi gejala inflamasi kronis TBI. Dalam penelitian mendatang, kemampuan formulasi ini untuk mengurangi inflamasi pada model tikus kronis akan dipelajari.
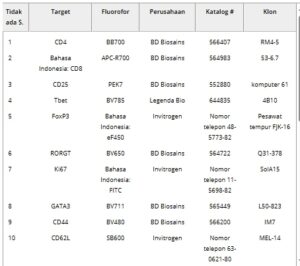
Tabel 1. Antibodi dan penghambat transpor protein yang digunakan dalam penelitian ini.
5 Bagian Eksperimen
Semua penelitian dilakukan sesuai dengan protokol yang disetujui oleh ASU IACUC atau IBC.
Sintesis Mikropartikel paKG(PFK15) dan paKG(PFK15+PLP)
Mikropartikel paKG(PFK15) (MP) dihasilkan menggunakan teknik emulsi air-minyak-air yang telah dilaporkan sebelumnya. [ 79 – 81 ] Secara singkat, 200 mg polimer paKG dilarutkan dalam 3 mL diklorometana (DCM) (VWR, Radnor, PA). 10 mg PFK15 (Selleckchem, Houston, TX) dilarutkan dalam 1 mL DCM dan 250 µL air DI ditambahkan. Campuran polimer paKG dan PFK15 yang terlarut digabungkan dan disonikasi selama 1 menit pada amplitudo 50%. Campuran ini kemudian digabungkan dengan 15 mL polivinil alkohol (PVA) 4% (Acros Organics, Fairlawn, NJ) dalam 15 mL DIH2O dan dihomogenkan pada 7.000 rpm selama 3 menit. MP paKG(PFK15+PLP) dihasilkan dengan melarutkan polimer paKG dan PFK15 menggunakan metode di atas dengan penambahan 4 mg PLP 139-151 terlarut yang dilarutkan dalam 250 µL air DI sebelum digabungkan. Setelah sonikasi selama 1 menit pada amplitudo 50%, emulsi ini juga ditambahkan ke 15 mL PVA 4% dalam 15 mL DIH2O dan dihomogenkan pada 7.000 rpm selama 3 menit.
Setelah homogenisasi, emulsi paKG(PFK15) dan paKG(PFK15+PLP) ditambahkan ke 37,5 mL PVA 4% dalam 112,5 mL air DI dan diaduk pada 600 rpm selama 3 jam untuk menguapkan DCM. Partikel yang terbentuk disentrifugasi pada 2.000 g selama 5 menit (Eppendorf, Hauppauge, NY). Supernatan dibuang dan disuspensikan kembali dalam DIH2O. Pencucian ini diulang 3 kali untuk menghilangkan sisa PVA. Partikel kemudian disuspensikan kembali dalam 5 mL DIH2O, ditempatkan pada suhu -80 °C selama minimal 2 jam, dan dikeringkan dalam suhu beku selama 48 jam. MP disimpan pada suhu -20 °C dan digunakan untuk percobaan berikutnya.
Karakterisasi Mikropartikel
Citra MP yang dihasilkan diperoleh dengan mikroskop elektron pemindaian XL30 Environmental FEG – FEI dan Zeiss Aruga di Erying Materials Center di Arizona State University. Diameter MP dan indeks polidispersitas (PDI) ditentukan dengan hamburan cahaya dinamis (Malvern Panalytical, Malvern, Inggris).
Efisiensi Enkapsulasi dan Pemuatan PFK15
Untuk mengukur jumlah PFK15 yang dimuat dan dienkapsulasi dalam paKG MP, 10 mg partikel dilarutkan dalam 100 µL DMSO. Absorbansi larutan ini diukur pada 370 nm menggunakan spektrofotometer absorbansi (SpectraMax M5, Molecular Devices, San Jose, CA). DMSO sendiri dan partikel paKG yang tidak mengenkapsulasi PFK15 digunakan untuk pengurangan latar belakang. Rumus yang digunakan untuk menentukan efisiensi adalah: Efisiensi Enkapsulasi = (berat obat yang dimasukkan / berat obat yang ditambahkan selama formulasi) × 100%; dan Efisiensi pemuatan = (berat obat yang dimasukkan / berat partikel paKG yang dimuat obat) × 100%.
Efisiensi Pemuatan dan Enkapsulasi PLP
Untuk mengukur jumlah PLP yang dimuat dan dienkapsulasi dalam paKG MP, 10 mg partikel dilarutkan dalam 500 µL DCM. PLP kemudian diekstraksi dengan menambahkan 500 µL PBS, mengocoknya dengan kuat, dan mengumpulkan fase air. Langkah ekstraksi ini diulang tiga kali, dan PBS digabungkan dalam tabung eppendorf. Absorbansi pada 280 nm menggunakan UV-VIS (Nanodrop2000, Fisher Scientific, Pittsburgh, PA) digunakan untuk menentukan kadar PLP. Efisiensi pemuatan setiap kelompok disamakan dengan massa PLP yang diukur dengan absorbansi per massa MP. Efisiensi enkapsulasi setiap kelompok MP setara dengan pemuatan aktual dibagi dengan pemuatan PLP teoritis dikalikan 100.
Kinetika Pelepasan PFK15 dan Laju Degradasi Mikropartikel Berbasis paKG
Kinetika pelepasan PFK15 ditentukan dengan menginkubasi 5 mg MP dalam 1 mL Tween 80 0,2% (dibuat dalam 1 x larutan penyangga fosfat (PBS – pH 7,4)). Setiap sampel sebanyak tiga kali ditempatkan pada rotator rotisserie pada suhu 37 °C. Pada jam ke-2, sampel disentrifugasi pada kecepatan 2.000 g selama 5 menit dan 800 µL supernatan dipindahkan dan disimpan pada suhu -80 °C hingga digunakan. Cairan yang dipindahkan diganti, dan sampel dikembalikan ke rotator rotisserie. Pengumpulan diulang setiap hari pada hari ke-1–8. Pelepasan PFK15 dari mikropartikel selama periode waktu 8 hari diukur dengan spektroskopi absorbansi pada 330 nm. Kurva standar PFK15 dalam 0,2% tween 80 dibuat dan absorbansi digunakan untuk mengukur konsentrasi PFK15 yang dilepaskan seiring waktu.
Kinetika Pelepasan PLP
PLP 139-151 yang dikonjugasikan dengan fluoresensi isothiocyanate (FITC) (Anaspec Inc.) dimasukkan ke dalam MP paKG(PFK15+PLP) berlabel FITC dan disintesis seperti yang disebutkan di atas. Kinetika pelepasan PLP-FITC dari MP mengikuti metode kinetika pelepasan PFK15, namun MP PLP-FITC diinkubasi dalam 1 x PBS (pH 7,4). Pelepasan PLP-FITC dari MP selama periode waktu 10 hari dianalisis dengan mengukur fluoresensi pelepasan pada eksitasi 488 nm, emisi 530 nm, menggunakan Bio Tek Synergy H1 Plate Reader (Agilent, Santa Clara, CA).
Isolasi dan Kultur Sel Dendritik
Sel punca hematopoietik (HSC) diisolasi dari sumsum tulang tikus C57BL/6j berusia 6–8 minggu sesuai dengan komite perawatan dan penggunaan hewan institusional (IACUC) Universitas Negeri Arizona untuk protokol 19–1712R yang disetujui. BMDC yang belum matang diperoleh dari HSC yang diisolasi menggunakan protokol 10 hari yang dimodifikasi. [ 61 , 82 – 85 ] Secara singkat, tulang paha dan tibia diekstraksi dari tikus dan ditempatkan dalam media pencuci yang terdiri dari DMEM/F-12 (1:1) dengan L-glutamin (VWR, Radnor, PA), 10% serum sapi janin (Atlanta Biologics, Flowery Branch, GA) dan 1% penisilin-streptomisin (VWR, Radnor, PA). Sumsum tulang dari tulang paha dan tibia dibilas dengan 10 mL media pencuci dan dipipet untuk menghasilkan suspensi yang homogen. Suspensi homogen kemudian disentrifugasi pada 300 g selama 5 menit dan supernatan dibuang. Pelet sel disuspensikan kembali dalam 3 mL buffer lisis sel darah merah (RBC) 1 x selama 3 menit pada suhu 4 °C. Suspensi sel kemudian disentrifugasi pada 300 g selama 5 menit dan disuspensikan kembali dalam DMEM/F-12 dengan L-glutamin (VWR, Radnor, PA), 10% serum sapi fetal, 1% natrium piruvat (VWR, Radnor, PA), 1% asam amino nonesensial (VWR, Radnor, PA), 1% penisilin–streptomisin (VWR, Radnor, PA) dan 20 ng mL⁻ 1 rekombinan mouse GM-CSF (VWR, Radnor, PA) (media DC). Suspensi sel kemudian dipindahkan ke labu T-75 yang telah diolah dengan kultur jaringan (hari ke-0) dan diinkubasi dalam inkubator 37 °C, 5% CO2 . Pada hari ke-2 (48 jam kemudian), sel yang mengapung dari labu dikumpulkan, disentrifugasi, disuspensikan kembali dalam media baru dan disemai dalam pelat perlekatan rendah 6-sumur (VWR, Radnor, PA) selama 6 hari. Setengah dari media diisi ulang setiap dua hari. Pada hari ke-8, sel diangkat dari pelat perlekatan rendah dengan cara memipet dengan hati-hati dan menyemai sel pada pelat polistirena dasar bulat 96-sumur yang telah diolah dengan kultur jaringan selama 2 hari tambahan sebelum mengolahnya (sel apa pun yang tersisa pada pelat perlekatan rendah 6-sumur disuspensikan kembali dalam EDTA 20 mm ( dibuat dalam 1 x PBS) dan diinkubasi pada suhu 37 °C selama 10 menit untuk disemai pada pelat 96-sumur). Pada hari ke 10, sel-sel diobati dengan paKG MP (0,1 mg mL⁻ 1 ), paKG(PFK15) MP (0,1 mg mL⁻ 1 ), paKG(PFK15+bc2) MP (0,1 mg mL⁻ 1 ), aKG terlarut (0,1 mg mL⁻ 1 ), diol (0,1 mg mL⁻ 1 ), bc2 terlarut (75 µg mL⁻ 1 ), DMSO 0,1%, atau PFK15 (200 nm ) . Untuk menguji bagaimana setiap kelompok pengobatan memodulasi peradangan, 1 µg mL⁻ 1 LPS juga ditambahkan ke setiap kondisi. Tidak ada pengobatan dan LPS saja yang digunakan sebagai kontrol. Hasil dan kemurnian DC (CD11c, MHCII dan CD86) ditentukan dengan pewarnaan imunofluoresensi dan flow cytometry.
Mikroskopi Konfokal
Protokol 10 hari yang dimodifikasi diikuti untuk memperoleh BMDC matang. [ 11 – 15 ] Pada hari ke-10, 100.000 sel disemai pada penutup kaca dalam pelat 24 sumur dan diinkubasi selama 24 jam dalam 37 °C. Sel-sel kemudian diobati dengan MP rhodamine-paKG berlabel fluoresensi dan nukleus diwarnai dengan DAPI. Sampel divisualisasikan dengan mikroskop confocal pemindai laser Nikon C2 menggunakan lensa imersi minyak 60 x dengan aperture numerik 1,4. DAPI dan MP rhodamine-paKG berlabel fluoresensi dieksitasi dengan laser 405 nm dan 561 nm masing-masing, digabungkan dengan deteksi emisi saluran biru dan merah yang sesuai. Saluran fluoresensi dipindai secara berurutan dan cahaya yang ditransmisikan dari laser 561 nm digunakan untuk kontras interferensi diferensial (DIC). Dimensi gambar adalah 1.024 × 1.024 piksel yang dipindai dengan zoom digital 2x. Tumpukan Z dibuat dengan cara yang sama dengan ukuran langkah 0,25 µm di antara irisan optik. Sel yang diobati dengan rhodamine-paKG MP dan sel yang tidak diobati digunakan sebagai kontrol pencitraan negatif untuk mengidentifikasi sinyal yang diinginkan. Intensitas laser dan penguatan detektor disesuaikan untuk menghilangkan latar belakang atau autofluoresensi dan menghindari saturasi piksel. Perangkat lunak Nikon, Elements digunakan untuk menyesuaikan skala intensitas, membuat tampilan ortogonal, dan mengonversi gambar ke format TIFF 8-bit.
Kultur Limfosit Campuran
Limpa dan sumsum tulang tikus OT-II berusia 6–8 minggu diisolasi untuk studi reaksi limfosit campuran (MLR). Sel-sel diekstraksi dari limpa dengan memberikan tekanan kuat dari alu pada saringan sel. Efluen disentrifugasi pada 300 x Gs selama 5 menit. Supernatan dibuang dan splenosit kemudian disuspensikan kembali dalam 3 mL buffer lisis RBC 1 x selama 5 menit pada suhu 4 °C. Sel-sel kemudian disentrifugasi pada 300 x Gs selama 5 menit dan pelet disuspensikan kembali dalam DMEM/F-12 dengan L-glutamin (VWR, Radnor, PA), 10% serum sapi janin, dan 1% penisilin-streptomisin (VWR, Radnor, PA). Sel T CD3+ atau naif kemudian diisolasi menggunakan kit isolasi sel magnetik (Miltenyi Biotech, Gaitersburg, MD). Sel sumsum tulang diisolasi [ 83 ] dan DC yang berasal dari sumsum tulang dibuat menggunakan protokol 10 hari. DC dan sel T dikultur pada rasio 1:3 sebelum pewarnaan antibodi dan flow cytometry.
Perawatan Eksperimental dan Dampak Kortikal Terkendali (CCI)
Tikus jantan dewasa (8–10 minggu) menerima suntikan subkutan salin atau paKG MP pada hari ke-17 dan ke-3 sebelum mengalami CCI, sesuai dengan komite perawatan dan penggunaan hewan institusional (IACUC) dari Arizona State University untuk protokol 20–1793R dan 23–1998R yang disetujui. Prosedur CCI didasarkan pada protokol yang sudah mapan untuk menghasilkan kontusio unilateral pada korteks frontoparietal lateral menggunakan alat impaktor elektromagnetik. [ 72 , 86 , 87 ] Tikus dibius dengan gas isoflurana 1–3,5% dan dipasang pada rangka stereotaxic. Kemudian dibuat sayatan di sepanjang garis tengah untuk melakukan kraniektomi. Setelah korteks terekspos, trauma dihasilkan dengan mengaktifkan piston (diameter 2 mm) pada 1,0–2,0 mm di bawah dura pada 5,0 m −1 s selama durasi 100 ms. Perhatikan, kedalaman cedera 1,0 mm digunakan dalam semua eksperimen, kecuali untuk uji perilaku dan titik akhir pengorbanan 28 hari yang menggunakan kedalaman cedera 2,0 mm. Desain penelitian ini digunakan karena kedalaman benturan 2,0 mm pada CCI memberikan defisit motorik pada rotarod, grid walk, dan lapangan terbuka. Setelah benturan, lokasi pembedahan kemudian dibersihkan sebelum penutupan. Hewan menerima suntikan SQ analgesia (buprenorfin; 0,05 mg k −1 g) dan salin steril (0,25 mL). Akhirnya, tikus dipantau selama 30–240 menit sebelum dikembalikan ke kandang rumah, dengan pemeriksaan kesehatan berkala selama 3 hari setelah CCI. Sepanjang penelitian, tikus naif utuh yang disesuaikan dengan usia digunakan sebagai kontrol karena operasi semu pada CCI menyebabkan cedera yang dapat membingungkan interpretasi hasil. [ 88 , 89 ]
Sitometri Aliran
Pada titik akhir yang ditentukan (7 dan 28 hari pasca cedera), tikus disuntik mati melalui dosis mematikan Euthasol, torakotomi, dan perfusi buffer fosfat dingin. Segera setelah perfusi, otak, limpa, dan kelenjar getah bening (inguinal dan serviks) diekstraksi dan dipisahkan menjadi suspensi sel tunggal. Semua antibodi imunofluoresensi (Tabel 1) dibeli dan digunakan apa adanya (BD biosciences, Tonbo Biosciences, Biolegend, Thermo Scientific, Invitrogen). Buffer pewarnaan aliran 0,1% disiapkan dengan mencampur 0,1% bovine serum albumin (VWR, Radnor, PA), 2 m m EDTA (VWR, Radnor, PA) dan 0,01% NaN 3 (VWR, Radnor, PA) dalam 1 x PBS pH 7,4. CD16/CD32 Fc Shield (Tonbo Biosciences, San Diego, CA) digunakan untuk mengurangi pewarnaan non-spesifik, set buffer pewarnaan faktor transkripsi Foxp3 (Invitrogen, Carlsbad, CA) digunakan untuk pewarnaan intranuklear, dan manik kompensasi UltraComp (Invitrogen, Carlsbad, CA) digunakan untuk kontrol warna tunggal. Flow cytometry diselesaikan dengan mengikuti panduan produsen Attune NXT Flow cytometer (ThermoFisher Scientific, Waltham, MA, AS) di inti flow cytometry Arizona State University.
Tes Perilaku (Jalan Grid, Rotarod, dan Lapangan Terbuka)—Jalan Grid
Pada hari ke-1 pasca-CCI, penilaian grid walk dilakukan pada 16 tikus dari setiap kelompok (utuh naif, tanpa pengobatan, paKG(PFK15) MPs, dan paKG(PFK15+PLP) MPs) mengikuti garis waktu pada Gambar 6a . Uji grid walk digunakan untuk mengukur gangguan motorik dan keseimbangan. Hewan-hewan tersebut diletakkan di atas kawat grid (32 cm x 20 cm x 50 cm dengan bukaan 11×11 mm) selama 5 menit; percobaan tersebut direkam dalam video untuk analisis selanjutnya. Bantalan yang cukup ditempatkan tepat di bawah dan di sekitar gird walk jika hewan tersebut jatuh selama percobaan (ketinggian grid maks = 20 cm). Setidaknya dua peneliti yang dibutakan menilai setiap video untuk kesalahan kaki selama percobaan (jumlah langkah dan kesalahan kaki ipsilateral dan kontralateral). Data dilaporkan sebagai persentase dari total kesalahan kaki untuk setiap kaki depan ipsilateral dan kontralateral.
Tes Perilaku (Grid Walk, Rotarod, dan Open Field)—Rotarod
Pada hari ke-1–8 pasca-cedera, penilaian rotarod dilakukan pada enam belas tikus dari setiap kelompok (utuh naif, tanpa perawatan, paKG(PFK15) MP, dan paKG(PFK15+PLP) MP) mengikuti garis waktu pada Gambar 6a . Rotarod digunakan untuk menilai koordinasi motorik dan gangguan keseimbangan. Itu terdiri dari batang berputar berlapis karet yang digantung di atas bantalan busa tempat tikus ditempatkan. Batang itu berada 20 cm di atas bantalan busa, sehingga jatuh dari batang tidak akan melukai tikus. Tikus ditempatkan di batang, dan batang itu berputar pada kecepatan yang berbeda saat percobaan berlangsung (kisaran: 4–40 rpm) selama 5 menit. Metrik hasil termasuk waktu dan kecepatan tikus jatuh. Seluruh tugas mencakup tiga percobaan per hari, yang dihentikan pada saat jatuh, dengan setidaknya 15 menit di antara setiap percobaan. Pengujian dilakukan sekali sehari pada hari pasca-cedera 1–8. Hewan dievaluasi setelah selesainya uji coba untuk mengetahui adanya efek samping dari uji coba.
Tes Perilaku (Grid Walk, Rotarod, dan Open Field)—Tes Open Field
Pada hari ke-27 pasca-CCI, uji lapangan terbuka dilakukan dengan 16 tikus dari setiap kelompok (naif, tanpa pengobatan, paKG(PFK15) MPs, dan paKG(PFK15+PLP) MPs) mengikuti garis waktu pada Gambar 6a . Uji ini dilakukan menggunakan arena persegi 38,1 cm2 dengan cahaya 150 ± 5 lumen yang ditempatkan di atas bagian tengah. Setiap tikus ditempatkan di tengah arena dan direkam video dari atas. Framerate video ditetapkan pada 30 frame per detik dan target dan bitrate maks ditetapkan pada 0,19 megabit per detik. 5 menit pertama setiap video kemudian dianalisis menggunakan DeepLabCut [ 90 , 91 ] versi 2.3.8, perangkat lunak sumber terbuka yang menggunakan jaringan saraf dalam untuk estimasi pose tanpa penanda. Perangkat lunak pertama kali dilatih dengan memberi label secara manual sepuluh titik anatomi yang berbeda dalam 20 frame yang dipilih dari masing-masing dari lima video. Pelatihan dilakukan sebanyak 500.000 iterasi. Data keluaran setiap video yang dijalankan melalui perangkat lunak yang telah dilatih, yang terdiri dari koordinat X dan Y dari setiap penanda tubuh, diekstraksi dari DeepLabCut dan dianalisis menggunakan kode Python khusus yang terdiri dari fungsi untuk menentukan jarak total yang ditempuh, waktu kumulatif di kuadran tengah, dan transisi ke kuadran tengah berdasarkan koordinat penanda yang diposisikan pada tulang belakang setiap tikus di antara tulang belikat.
Imunohistokimia
Pada hari ke-28 pasca-CCI, empat tikus dari masing-masing kelompok dieutanasia secara manusiawi melalui injeksi Euthasol dan torakotomi diikuti oleh perfusi dengan buffer fosfat dingin dan kemudian paraformaldehida 4%. Otak diisolasi, difiksasi ulang, dan dikriopreservasi dalam sukrosa 30%, kemudian ditanamkan dalam OCT dan disimpan pada suhu -80 °C hingga digunakan. Kriostat Leica CM1950 digunakan untuk memperoleh irisan koronal mengambang berukuran 30 µm, dikumpulkan secara serial dan ditempatkan ke dalam sumur individual dari pelat enam sumur dengan PBS (pH 7,4). Satu sumur untuk setiap otak dipilih untuk pewarnaan imunohistokimia mengambang. Irisan tersebut kemudian diputar pada suhu ruangan selama 30 menit dalam buffer permeabilisasi/pemblokiran yang terdiri dari 10% Serum Kuda Normal (NHS) dan 0,3% Triton X-100 dalam PBS. Potongan-potongan itu kemudian diinkubasi semalaman pada suhu 4 °C dalam larutan antibodi primer yang terdiri dari anti-GFAP ayam (1:1000, Abcam, ab4674), anti-CD86 tikus (1:500, BD Biosciences, 550 542), anti-Iba1 kelinci (1:500, Wako, 019–19741), 0,4% penyangga permeabilisasi/pemblokiran, dan 5% NHS dalam PBS. Setelah tiga kali pencucian bergilir selama 15 menit dengan PBS, irisan diinkubasi selama 1 jam dengan memutar pada suhu ruangan dalam larutan antibodi sekunder yang terdiri dari anti-ayam AF555 (1:1000, Thermo Fisher, A78949), anti-tikus AF647 (1:1000, Jackson Labs, 712-605-153), anti-kelinci CF750 (1:1000, Biotium, 20 298), 0,4% buffer permeabilisasi/pemblokiran, dan 5% NHS dalam PBS. Irisan menjalani tiga kali pencucian bergilir selama 15 menit dan NucBlue Fixed Cell Stain ReadyProbes Reagent (2 tetes/mL, Invitrogen, R37606) ditambahkan ke pencucian ketiga untuk pewarnaan DAPI. Irisan kemudian dicuci tiga kali lagi, dengan memutar masing-masing selama 5 menit. Mereka dipasang pada slide mikroskop bermuatan, Fluoro-Gel dioleskan, dan ditutup dengan kaca penutup. Slide disimpan pada suhu 4 °C sebelum pencitraan dengan Olympus VS200 Slide Scanner. Pengaturan paparan saluran adalah sebagai berikut: DAPI pada 10 ms, TRITC (GFAP) pada 35 ms, Cy5 (CD86) pada 1000 ms, Cy7 (Iba1) pada 800 ms. Untuk setiap otak, satu bagian diproses melalui protokol yang sama tanpa aplikasi antibodi primer untuk berfungsi sebagai kontrol antibodi sekunder saja. Bagian otak koronal dicitrakan melalui Evident VS200 Slide Scanner (Olympus) menggunakan pengaturan fluoresensi yang sesuai berdasarkan fluorofor; pengaturan paparan dipertahankan konstan untuk semua bagian yang dianalisis.
Seluruh gambar penampang otak koronal dianalisis menggunakan perangkat lunak gambar digital HALO Image Analysis Platform versi 4.0.5107 dan HALO AI versi 4.0.5107 (Indica Labs, Inc.). Tiga penampang per otak (bregma -1,4 mm ± satu penampang) diberi anotasi secara manual untuk hemisfer ipsilateral dan kontralateral, korteks serebral, korpus kalosum, hipokampus, dan talamus. Pada otak naif yang utuh, ROI ini dianalisis hanya pada satu hemisfer otak. Pengklasifikasi HALO AI Object Phenotyper dilatih untuk mengidentifikasi sel Iba1+, dan ini disematkan dalam modul HighPlex FL yang kemudian digunakan untuk mengidentifikasi persentase sel CD86+ dan sel Iba1+ di setiap ROI. Algoritma AI Nuclei Seg V2 (HALO AI) yang telah dilatih sebelumnya dengan HALO digunakan untuk segmentasi nuklir. Data objek HighPlex FL diekspor dan digunakan untuk menentukan persentase sel Iba1+/CD86+ yang terlokalisasi. Area Quantification digunakan untuk menentukan persentase area positif untuk GFAP, CD86, dan DAPI. Ambang batas untuk sel positif CD86 di HighPlex FL serta area positif untuk GFAP, CD86, dan DAPI dalam modul Area Quantification ditentukan dengan menggunakan jendela penyetelan waktu nyata dan menyesuaikan pengaturan agar sesuai dengan intensitas piksel positif rata-rata yang diamati di beberapa bagian otak dalam penelitian. Semua pengaturan yang digunakan dalam modul HighPlex FL dan Area Quantification dipertahankan konstan untuk setiap bagian otak/ROI yang dianalisis dalam penelitian.
Analisis Area Lesi
Gambar yang diperoleh setelah pewarnaan imunohistokimia digunakan untuk menentukan area rongga lesi pada setiap bagian dengan menelusuri lesi secara manual menggunakan FIJI/ImageJ. Area lesi rata-rata untuk lima bagian per otak, berpusat pada bregma − 1,4 mm dengan dua bagian sebelumnya dan dua bagian berikutnya, dihitung.
Analisis Gen Nanostring pada Jaringan Otak
Pada kelompok tambahan, tikus ( n = 4 per kelompok) mengikuti rejimen injeksi dan CCI. Kemudian pada hari ke-7 pasca cedera, tikus disuntik mati dan diperfusi dengan 4% paraformaldehida dan otak diisolasi untuk imunohistokimia (IHC) atau tikus diperfusi dengan garam, dan otak diisolasi untuk analisis proteomik NanoString.
Otak yang ditujukan untuk analisis NanoString disuspensikan dalam senyawa suhu pemotongan optimal (OCT), dibekukan dengan cepat pada es kering, dan disimpan pada suhu -80° C hingga dilakukan kriosiseksi. Otak dikriosiseksi menjadi beberapa bagian berukuran 5 µm, diletakkan pada slide kaca, dan dikembalikan ke freezer -80° C. Slide kemudian diproses menggunakan Manual Pengguna Persiapan Slide NanoString GeoMx DSP (Bagian Persiapan Slide Protein FFPE, beserta Lampiran II: Modifikasi untuk Sampel Beku Segar).
Pertama, slide dikeluarkan dari freezer dan difiksasi semalam dalam 10% neutral-buffered formalin (NBF) pada suhu 4° C. Setelah fiksasi, slide dicuci tiga kali dalam Tris Buffered Saline plus Tween (TBS-T) yang diencerkan 1:10 dalam air yang diolah DEPC. Pengambilan antigen dilakukan dengan menggunakan buffer sitrat yang diencerkan 1:10 dalam air yang diolah DEPC. Slide, yang terendam dalam buffer sitrat yang diencerkan, ditempatkan dalam TintoRetriever Pressure Cooker (Bio SB, Nomor Barang: BSB 7008) pada pengaturan suhu dan tekanan tinggi selama 15 menit. Slide dicuci dalam TBS-T tiga kali lagi, kemudian difiksasi dalam 10% NBF selama 30 menit. Setelah difiksasi, slide diwarnai dengan penanda fluoresensi imunohistokimia dan panel proteomik NanoString, semuanya diencerkan dalam Buffer W (NanoString Technologies, Nomor Barang: 100474). Penanda morfologi imunohistokimia terdiri dari anti-GFAP (pengenceran 1:40, Novus Biologicals, NBP2-33184), anti-NeuN (pengenceran 1:100, Abcam, AB190565). Panel proteomik yang digunakan dalam penelitian ini adalah Neural Cell Profiling Panel (25 protein, Nomor Barang: 121300120) beserta Glial Cell Typing Module (10 protein, Nomor Barang: 121300125), dan Autophagy Module (10 protein, Nomor Barang: 121300124). Antibodi yang digunakan dalam panel proteomik dikonjugasikan melalui penghubung yang dapat dibelah UV dengan urutan DNA komplementer (cDNA) yang unik untuk setiap protein. Semua panel proteomik diencerkan menjadi 1:25 menggunakan Buffer W. Kaca objek diinkubasi semalaman pada suhu 4° C, kemudian dicuci tiga kali dalam TBS-T. Tahap pasca-fiksasi dilakukan dengan memfiksasi slide dalam formalin buffer netral 10% selama 30 menit. Tahap pencucian terakhir dalam TBS-T dilakukan, dan akhirnya slide dimasukkan ke dalam NanoString GeoMx Digital Spatial Profiler (DSP) (NanoString Technologies, Seattle, WA) untuk pengumpulan proteomik.
GeoMx DSP digunakan untuk pertama-tama mengambil gambar irisan jaringan dan memilih daerah melingkar yang diminati (ROI) berdiameter 500 µm. Setelah pemilihan ROI, GeoMx secara berurutan menyinari setiap ROI dengan sinar UV, membelah urutan oligonukleotida yang terkait dengan setiap protein yang sedang diukur. Urutan cDNA dari setiap ROI dikumpulkan dalam satu sumur dari pelat 96 sumur. Pelat dibiarkan mengering semalaman dan dihidrasi ulang keesokan harinya dengan air bebas nuklease. Larutan yang mengandung Probe U, Probe R, dan Hybridization Buffer dibuat dan ditambahkan ke masing-masing dari delapan tabung GeoMx Hyb Code (Hyb AH) (NanoString Technologies, Nomor Barang: 121300401). Probe U dan Probe R mengikat urutan cDNA yang dikumpulkan dan menempelkan pengenal fluoresensi unik atau “barcode” ke setiap untai cDNA unik yang kemudian dipindai untuk mengidentifikasi jumlah protein dalam setiap ROI. Setiap larutan GeoMx Hyb Code ditambahkan ke baris terpisah dari pelat 96-sumur baru bersama dengan 7 µL dari setiap sampel yang dikumpulkan. Pelat baru disegel dan diinkubasi dalam thermal cycler selama 18 jam pada suhu 67° C, kemudian disimpan pada suhu 4° C. Sampel dalam setiap kolom pelat digabungkan dan ditambahkan ke sumur terpisah dari tabung strip 12-sumur. Sampel yang dikumpulkan dimuat ke dalam nCounter MAX/FLEX (NanoString Technologies, Seattle, WA) yang mentransfer sampel ke dalam kartrid bening tempat kode batang dipindai untuk menghasilkan informasi tentang ekspresi protein dalam setiap ROI.
Analisis ekspresi diferensial proteomik (DE) dilakukan pada GeoMx DSP Data Analysis Suite. Semua koleksi dinormalisasi ke jumlah protein housekeeping (GAPDH, Histone H3, dan S6) yang disertakan dalam panel protein. Untuk analisis, jumlah protein untuk kelompok PBS yang terluka dan kelompok paKG(PFK15+PLP) yang terluka dibandingkan dengan tikus kontrol naif yang utuh. Kelompok perlakuan dibandingkan langsung dengan kontrol naif untuk menunjukkan perubahan proteom dibandingkan dengan garis dasar yang sehat. Untuk setiap perbandingan, log 2 (perubahan lipat) (log 2 (fc)) untuk setiap protein dihitung, di mana perubahan lipat adalah nilai protein eksperimen rata-rata di atas nilai protein kontrol naif rata-rata. Uji-t varians sama dua sisi Student kemudian dilakukan untuk setiap protein, dan ambang signifikansi ditetapkan ke p < 0,05. Plot gunung berapi dibuat dalam GraphPad Prism 10 (GraphPad Software, Boston, Massachusetts USA).
Analisis Statistik
Data dinyatakan sebagai mean ± standard error mean (SEM). Perbandingan antara beberapa kelompok perlakuan dilakukan dengan menggunakan ANOVA satu arah, diikuti oleh uji Fisher’s LSD atau perbandingan ganda Bonferroni, dan nilai- p sebesar 0,05 dianggap signifikan secara statistik (GraphPad Prism Software 6.0, San Diego, CA). Untuk analisis perilaku, perbandingan antara beberapa kelompok perlakuan dan titik waktu dilakukan dengan menggunakan pengukuran berulang ANOVA dua arah yang sesuai atau ANOVA satu arah, diikuti oleh analisis berpasangan post-hoc Fisher’s LSD.
