Evaluasi Farmakokinetik dan Keamanan Sitafloxacin Generik Baru: Studi Bioekivalensi Fase I pada Peserta Sehat Tiongkok
Abstrak
Sitafloxacin adalah obat antibiotik baru yang termasuk dalam antibiotik kuinolon generasi keempat. Tujuan dari penelitian ini adalah untuk mengevaluasi farmakokinetik (PK), profil keamanan, dan bioekivalensi tablet sitafloxacin 50 mg uji dan referensi dalam kondisi puasa dan makan. Parameter PK, yang dihitung dengan model nonkompartemen, meliputi konsentrasi maksimum, area di bawah kurva konsentrasi-waktu (AUC) dari waktu 0 hingga konsentrasi terakhir yang dapat diukur, dan AUC dari waktu 0 hingga tak terbatas. Bioekivalensi dinilai berdasarkan apakah interval kepercayaan 90% dari rasio rata-rata geometrik untuk obat uji/referensi berada dalam kisaran yang diterima yaitu 80%-125%. Kejadian buruk dipantau untuk menilai keamanan. Akhirnya, 80 peserta Tiongkok yang sehat didaftarkan, yang mana 40 di antaranya didaftarkan dalam studi puasa dan 40 lainnya didaftarkan dalam studi makan. Ada 1 peserta dalam uji coba makan yang mengundurkan diri dari studi karena gagal menghabiskan makanan berlemak tinggi. Rasio rata-rata geometrik dan interval kepercayaan 90% untuk konsentrasi maksimum, AUC dari waktu 0 hingga konsentrasi terukur terakhir, AUC dari waktu 0 hingga tak terhingga antara sitafloxacin bermerek dan generik, baik dalam kondisi puasa maupun makan, mematuhi kriteria bioekivalensi yang telah ditetapkan sebelumnya sebesar 80%-125%. Tidak ada efek samping serius yang diamati dalam penelitian ini. Oleh karena itu, temuan menunjukkan bahwa tablet sitafloxacin generik dan asli memiliki profil bioekivalensi dan keamanan yang sebanding.
Resistensi antimikroba merupakan krisis kesehatan global yang terus meningkat, dengan infeksi bakteri gram negatif yang menimbulkan ancaman signifikan akibat meningkatnya resistensi obat. 1 Menurut Jaringan Pengawasan Antimikroba Tiongkok, dari tahun 2005 hingga 2023, isolat bakteri gram negatif menyumbang hingga 70% kasus, yang menyoroti urgensi antibiotik baru untuk memerangi resistensi antimikroba, terutama untuk bakteri gram negatif. Pengembangan obat antimikroba baru sangat penting untuk mengatasi masalah yang terus berkembang ini dan melindungi kesehatan masyarakat.
Sitafloxacin adalah antibiotik fluoroquinolone generasi keempat. Obat ini menunjukkan aktivitas yang kuat terhadap berbagai bakteri gram positif dan negatif, dan antibiotik baru ini menawarkan keuntungan yang signifikan dalam memerangi resistensi bakteri. 2 – 4 Penyerapan oral sitafloxacin cepat dan lengkap, dengan bioavailabilitas absolut setinggi 89%. 5 Selain itu, sitafloxacin menunjukkan sekitar 50% pengikatan protein serum dan memiliki t 1/2 yang pendek (sekitar 5 jam), dan area di bawah kurva konsentrasi-waktu (AUC) meningkat sebanding dengan dosisnya. Selain itu, sitafloxacin terutama dieliminasi oleh ginjal melalui urin sebagai prototipe. 6 Jalur metabolisme utamanya melibatkan konjugasi glukuronida, dan dapat menghambat enzim sitokrom P450 1A secara moderat tanpa mempengaruhi enzim sitokrom 450 lainnya. Seperti fluoroquinolone lainnya, sitafloxacin juga dapat berinteraksi dengan obat yang mengandung ion logam. 7 Variasi genetik pada ABCB1 (rs1045642), UGT1A1 (rs2741049), dan UGT1A9 (rs3832043) diduga memengaruhi konsentrasi maksimum (Cmax ) atau t 1/2 sitafloxacin. 8
Meskipun sitafloksasin bermerek telah digunakan di Cina selama bertahun-tahun, sebagian besar pasien tidak mampu membelinya. Oleh karena itu, diperlukan obat generik yang lebih terjangkau untuk memenuhi permintaan klinis yang sebenarnya. Di sini, untuk mengevaluasi bioekivalensi dan keamanan sitafloksasin bermerek dan generik baik dalam keadaan puasa maupun pasca makan, uji klinis Fase I dilakukan pada peserta Cina yang sehat.
Bahan dan Metode
Formulasi
Obat uji sitafloksasin (nomor batch: 19090641) diproduksi oleh Yangtze River Pharmaceutical Group Co., Ltd. (Jiangsu, Tiongkok). Obat referensi sitafloksasin (GRACEVIT) (Nomor Batch: ZAB0146) diproduksi oleh Daiichi Sankyo Company Limited (Tokyo, Jepang).
Peserta
Peserta yang memenuhi syarat harus memenuhi kriteria berikut untuk diikutsertakan: (1) pemahaman dan kemauan untuk menandatangani dokumen persetujuan; (2) peserta laki-laki dan perempuan berusia 18-65 tahun, dengan berat 50,0 kg atau lebih untuk laki-laki dan 45,0 kg atau lebih untuk perempuan, dengan indeks massa tubuh dalam kisaran 19,0-26,0 kg/m 2 ; dan (3) peserta dalam kondisi sehat.
Peserta tidak diikutsertakan jika mereka memiliki salah satu kondisi berikut: (1) kelainan yang signifikan secara klinis dalam pemeriksaan atau tes; (2) riwayat penyakit serius dalam sistem apa pun; (3) situasi apa pun yang dianggap tidak pantas oleh penyelidik; (4) partisipasi baru-baru ini dalam uji klinis lain atau penggunaan obat investigasi; (5) penggunaan obat resep atau obat bebas, suplemen, vitamin, atau obat Cina dalam 30 hari terakhir; (6) wanita hamil atau menyusui; dan (7) penyakit akut dari penyaringan hingga pra-pemberian.
Etika
Studi bioekivalensi (BES) ini terdaftar di Chinese Clinical Trial Registry ( http://www.chictr.org.cn/ ; CTR2400091798) dan telah disetujui oleh Komite Etik Uji Klinis Universitas Sains dan Teknologi Huazhong (Dokumen Tinjauan Etik No. 89 [2019]). Semua partisipan menandatangani formulir persetujuan tertulis sebelum mengambil bagian dalam studi ini.
Desain Studi
Penelitian ini merupakan rancangan acak, label terbuka, 2 periode, 2 urutan silang, yang menilai bioekivalensi pada peserta Tiongkok yang sehat dalam keadaan puasa dan makan. Dalam penelitian ini, peserta yang memenuhi syarat dialokasikan secara acak ke salah satu dari 2 urutan pengobatan (kelompok uji-referensi atau kelompok referensi-uji) dalam rasio 1:1. Mereka menerima obat penelitian sekali per periode pengobatan, dipisahkan oleh periode pencucian 7 hari.
Dalam studi puasa, peserta yang memenuhi syarat menerima satu dosis oral 50 mg tablet uji atau referensi setelah berpuasa semalaman, dengan 240 mL air. Dalam studi makan, prosedurnya mirip dengan keadaan puasa, kecuali bahwa peserta mengonsumsi sarapan tinggi lemak (800-1000 kkal) 30 menit sebelum pemberian obat.
Pengambilan Sampel Darah dan Metode Bioanalisis
Dalam studi puasa, sampel darah (4 mL per sampel) dikumpulkan 1 jam sebelum pemberian dosis dan 0,17, 0,33, 0,5, 0,67, 0,83, 1, 1,25, 1,5, 2, 3, 4, 6, 8, 12, 24, dan 36 jam setelah pemberian dosis, yang ditempatkan dalam tabung antikoagulasi penangas es dengan asam dipotassium etilendiamintetraasetat. Dalam studi puasa, titik waktu pengambilan darah bervariasi sebagai 0, 0,17, 0,33, 0,5, 0,75, 1, 1,25, 1,5, 2, 2,5, 3, 4, 6, 8, 12, 24, dan 36 jam, dengan item pemeriksaan lainnya seperti dalam studi puasa. Sampel darah disentrifugasi pada kecepatan 2000 g selama 10 menit (pada suhu 4°C) untuk memperoleh plasma, yang kemudian dibagi menjadi 2 bagian (sampel uji dan sampel cadangan). Semua sampel disimpan pada suhu -70±10°C dalam waktu 4 jam setelah pengambilan darah.
Metode deteksi sitafloksasin divalidasi oleh Nanjing KeliTai Pharmaceutical Technology Co., Ltd., menggunakan metode kromatografi cair kinerja tinggi-spektrometri massa tandem yang tervalidasi dengan sitafloksasin-d4 sebagai standar internal. Sistem ini mencakup pompa kromatografi cair Shimadzu, kolom Ultimate XB-C18 (3 µm, 2,1 × 50 mm; Welch), dan spektrometer massa Triple Quad 6500+ (Applied Biosystems/Sciex). Suhu kolom kromatografi adalah 40°C. Fase gerak A adalah air dengan 10,0 mmol/L NH4Ac dan 0,1% asam format, dan fase gerak B adalah metanol dengan 0,1% asam format. Laju alir dijalankan pada 0,5 mL/menit. Deteksi dilakukan dalam mode pemantauan reaksi ganda dengan ionisasi elektrospray ion positif. Pasangan ion transisi 410,1/392,2 dipilih untuk sitafloksasin, dan 416,2/398,2 dipilih untuk sitafloksasin-d4. Metode ini selektif, tanpa gangguan plasma. Akuisisi data dilakukan dengan perangkat lunak Analyst versi 1.6.3 (Applied Biosystems/Sciex). Setelah itu, metode praperlakuan sampel adalah presipitasi protein dan efisiensi ekstraksi sitafloksasin dan standar internal berada di antara 87,1% dan 95,4%. Presisi intra-pengujian berkisar antara 2,9% hingga 3,7%, dan presisi interpengujian berkisar antara 3,4% hingga 5,6%. Kurva standar sitafloksasin bersifat linier dari 2,0 hingga 1000 ng/mL, dengan batas kuantifikasi 2,0 ng/mL.
Penilaian Keamanan
Keselamatan partisipan setelah pemberian tablet sitafloxacin dinilai melalui pemantauan observasi klinis, investigasi laboratorium, elektrokardiogram 12 sadapan, dan evaluasi efek samping (AE) serta frekuensinya.
AE dikategorikan menggunakan Kamus Medis untuk Aktivitas Regulasi Versi 23.0, dengan analisis utamanya menggunakan teknik statistik deskriptif. Kejadian AE dan reaksi obat yang merugikan digabungkan berdasarkan kelas organ sistem dan istilah yang disukai, yang merinci frekuensi kasus dan frekuensi kejadian.
Farmakokinetik dan Analisis Statistik
Parameter farmakokinetik (PK) diturunkan menggunakan perangkat lunak Phoenix WinNonlin Versi 8.1 (Certara). Untuk analisis statistik lainnya, perangkat lunak SAS Versi 9.4 (SAS Institute) digunakan. Parameter PK dihitung dengan model nonkompartemen, yang terdiri dari konsentrasi maksimum (Cmax ) , area di bawah kurva (AUC) dari waktu 0 hingga konsentrasi terakhir yang dapat diukur (AUC 0-t ), dan AUC dari waktu 0 hingga tak terbatas (AUC 0-∞ ). Bioekivalensi sitafloksasin uji dan referensi dinilai berdasarkan apakah interval kepercayaan 90% dari rasio rata-rata geometrik untuk AUC 0-t , AUC 0-∞ , dan Cmax berada dalam kisaran yang diterima sebesar 80%-125%.
Hasil
Karakteristik Umum Peserta
Dalam uji coba puasa, 150 peserta Tiongkok yang sehat disaring antara 19 November 2019 dan 24 November 2019. Empat puluh peserta didaftarkan, dan 37 menyelesaikan 2 siklus dengan mematuhi protokol.
Dalam uji klinis awal, 167 peserta Tiongkok yang sehat disaring antara 27 Desember 2019 dan 1 Januari 2020. Sebanyak empat puluh peserta didaftarkan, dan 36 peserta menyelesaikan 2 siklus dengan mematuhi protokol.
Karakteristik umum terperinci dari peserta terdaftar ditunjukkan pada Tabel 1S .
Parameter Farmakokinetik
Dalam uji coba puasa, 2 peserta secara sukarela mengundurkan diri dari penelitian sebelum pemberian obat pada siklus kedua, dan hanya data PK dari siklus pertama yang disertakan dalam analisis PK dan BES. Satu peserta tidak dapat ditindaklanjuti selama fase tindak lanjut AE, tetapi kedua siklus sampel darah PK dikumpulkan secara lengkap sesuai dengan protokol, sehingga data PK disertakan dalam analisis PK dan BES.
Dalam uji coba fed, 4 peserta tidak menyelesaikan uji coba. Satu peserta mengundurkan diri dari uji coba sebelum siklus pengobatan kedua, dan dengan demikian hanya data PK siklus pertama yang disertakan dalam analisis PK dan BES. Satu peserta secara sukarela mengundurkan diri dari penelitian setelah pengambilan sampel darah 24 jam setelah siklus pengobatan pertama. Meskipun sampel darah 36 jam tidak ada, data PK siklus pertama disertakan dalam analisis PK dan BES. Peserta lain hilang dari tindak lanjut selama fase AE setelah menyelesaikan 2 siklus pengobatan dan pengambilan darah, sehingga data PK disertakan dalam analisis PK dan BES. Namun, 1 peserta tidak menerima pengobatan dan hanya memiliki sampel darah premedikasi yang diambil pada jam ke-0, dan tidak disertakan dalam set analisis apa pun.
Profil konsentrasi plasma rata-rata-waktu sitafloxacin pada percobaan puasa dan makan ditunjukkan pada Gambar 1 dan 2 , masing-masing.
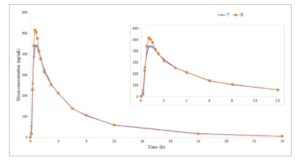
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Kurva rata-rata konsentrasi plasma-waktu dalam kondisi puasa. R, sediaan referensi; T, sediaan uji.
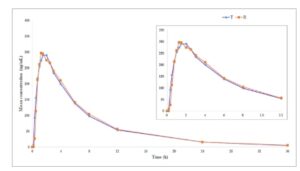
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Kurva rata-rata konsentrasi plasma-waktu dalam kondisi pemberian pakan. R, sediaan referensi; T, sediaan uji.
Parameter PK tablet sitafloxacin pada kondisi puasa dan makan ditunjukkan pada Tabel 1 .
Tabel 1. Parameter PK Sitafloxacin pada Kondisi Puasa dan Makan
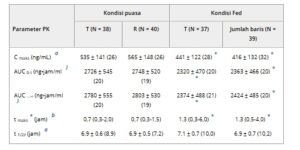
AUC 0-∞ , area di bawah kurva konsentrasi-waktu dari waktu 0 hingga tak terhingga; AUC 0-t , area di bawah kurva konsentrasi-waktu dari waktu 0 hingga konsentrasi terukur terakhir; PK, farmakokinetik; R, sediaan acuan; t 1/2z , waktu paruh; SD, deviasi standar; T, sediaan uji; t maks , waktu hingga mencapai konsentrasi maksimum.
a Nilai disajikan sebagai mean ± SD (koefisien variasi).
b Nilai disajikan sebagai median (minimum-maksimum).
* P <.001 dibandingkan dengan kondisi puasa.
C max , AUC 0-t, dan AUC 0-∞ pada kelompok yang diberi makan berkurang secara signifikan dibandingkan dengan kelompok puasa.
Sebanyak 40 peserta terdaftar dalam BES puasa, dan 39 dalam BES setelah makan, sebagaimana diuraikan dalam Tabel 2. Hasil untuk kedua kelompok menunjukkan bahwa rasio rata-rata geometrik Cmax , AUC0 -t , dan AUC0 -∞ , beserta interval kepercayaan 90%, berada dalam kisaran bioekivalensi 80%-125%. Konsistensi ini pada kondisi puasa dan makan menunjukkan bahwa kedua formulasi tersebut bersifat bioekivalen.
Tabel 2. Statistik Bioekivalensi Parameter PK Sitafloxacin
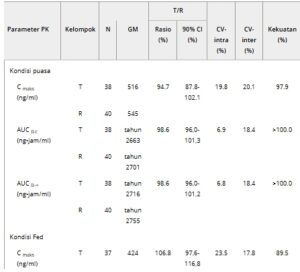
AUC 0-∞ , area di bawah kurva konsentrasi-waktu dari waktu 0 hingga tak terhingga; AUC 0-t , area di bawah kurva konsentrasi-waktu dari waktu 0 hingga konsentrasi terukur terakhir; GM, rata-rata geometrik; CV, koefisien variasi; PK, farmakokinetik; R, sediaan referensi; T, sediaan uji.
Keamanan
AE yang diamati dalam studi ini dirinci dalam Tabel 2S . Sebanyak 25 AE tercatat pada 16 partisipan (40%) dalam studi puasa; di antara mereka, 1 partisipan mengalami 1 episode penurunan tekanan darah setelah mengonsumsi produk referensi, dan potensi hubungan dengan obat studi dinilai mungkin tidak berhubungan. Potensi hubungan semua AE yang muncul akibat pengobatan lainnya dinilai mungkin berhubungan dengan obat studi. Selain itu, sebanyak 22 AE tercatat pada 16 partisipan (41%) dalam studi fed; di antara mereka, 1 partisipan mengalami 1 episode bradikardia (denyut nadi melambat) sebelum mengonsumsi produk referensi, dan potensi hubungan dengan obat studi dinilai mungkin tidak berhubungan. Potensi hubungan semua AE yang muncul akibat pengobatan lainnya dengan obat studi dinilai mungkin berhubungan.
Sepanjang penelitian ini, semua AE berperingkat I. Pada akhir uji klinis, semua AE pada peserta telah ditindaklanjuti hingga sembuh atau pulih, kecuali peserta yang tidak ditindaklanjuti dan tidak memiliki hasil yang terdokumentasi. Tidak ada AE serius atau AE yang menyebabkan peserta mengundurkan diri.
Diskusi
Penelitian ini bertujuan untuk mengevaluasi karakteristik PK, bioekivalensi, dan keamanan pemberian tunggal tablet sitafloksasin 50 mg secara oral dari sediaan uji dan sediaan referensi pada peserta sehat dalam kondisi puasa atau makan. Tidak ada perbedaan signifikan dalam karakteristik demografi peserta antara kelompok (uji dan referensi). Analisis parameter PK menunjukkan bahwa karakteristik PK sediaan uji dan sediaan referensi serupa.
Parameter PK dari penelitian ini pada dasarnya konsisten dengan data dalam literatur. 9 Yaitu, studi PK dosis tunggal dan keamanan pada manusia yang melibatkan 12 relawan Tiongkok yang sehat yang secara acak dimasukkan ke dalam 3 kelompok dosis 50, 100, dan 200 mg (semuanya dalam kondisi puasa). Waktu hingga Cmax kira -kira antara 0,85 dan 1,21 jam, dan t 1/2 kira-kira antara 5,19 dan 6,28 jam.
Namun, penelitian kami menunjukkan bahwa makanan menurunkan AUC 0-t , AUC 0-∞ , dan Cmax sitafloxacin . Temuan ini tidak konsisten dengan penelitian sebelumnya, yang mengidentifikasi bahwa paparan sitafloxacin sebanding dalam keadaan makan dan puasa. 6 Khususnya, ada juga penelitian yang menunjukkan bahwa diet tinggi lemak dapat menyebabkan penurunan Cmax yang signifikan , meskipun tidak ada perubahan signifikan dalam AUC yang diamati. 8 Sebenarnya, sitafloxacin akan rentan terhadap interaksi dengan ion logam, yang menunjukkan ada penjelasan logis untuk interaksi makanan-obat yang diamati dalam penelitian kami. Oleh karena itu, lebih baik memberikan sitafloxacin oral saat puasa. Tmax sitafloxacin diperpanjang ketika dikonsumsi dengan makanan dalam hasil kami yang kemungkinan disebabkan oleh keterlambatan pengosongan lambung. Temuan ini konsisten dengan pengamatan dari penelitian sebelumnya. 6 , 8
Hasilnya menunjukkan bahwa interval kepercayaan 90% rasio GM dari Cmax , AUC 0-t , dan AUC 0-∞ semuanya berada dalam kisaran 80%-125%, baik dalam kondisi puasa maupun makan, yang menunjukkan bahwa kedua formulasi tersebut bersifat bioekuivalen.
Dalam penelitian tersebut, semua AE bersifat ringan (Tingkat I), dan kedua formulasi obat dapat ditoleransi dengan baik tanpa SAE. Dalam uji coba puasa, AE utama adalah hipotensi (20%), aritmia supraventrikular (7,5%), proteinuria (5%), dan blok cabang berkas kanan (5%). Dalam uji coba puasa, hipotensi (15,4%) dan proteinuria (5,1%) adalah yang paling umum, dengan AE lainnya dilaporkan hanya sekali. Berdasarkan pengalaman pasca pemasaran, AE umum sitafloksasin meliputi diare, tinja encer, peningkatan alanin transaminase, peningkatan aspartat transaminase, ruam, sakit kepala, pusing, protein urin positif, dan sebagainya. Dalam uji coba ini, tidak ada peserta yang melaporkan AE seperti diare atau tinja encer. Namun, reaksi merugikan yang dinilai dalam uji coba ini, seperti penurunan tekanan darah, aritmia supraventrikular, dan blok cabang berkas kanan, belum pernah dilaporkan sebelumnya, yang tidak konsisten dengan pengalaman pasca pemasaran. Karena semua reaksi ini terjadi setelah pemberian, maka reaksi tersebut dianggap mungkin terkait. Meskipun demikian, semua AE yang kami catat bersifat ringan, jadi kedua formulasi ditoleransi dengan baik dalam penelitian kami.
