Elektroreduksi CO 2 yang Digabungkan dengan Elektrooksidasi Alkohol dan Gula Menjadi Format: Tinjauan dan Evaluasi
Abstrak Grafis
Tinjauan ini merangkum literatur terbaru tentang produksi format dengan menggabungkan elektroreduksi CO2 dengan elektrooksidasi alkohol atau gula, yang mencakup pemilihan katalis, pengoptimalan elektrolit, desain elektroliser, dan pemisahan produk. Dampak ekonomi dan lingkungan dari elektroproduksi format dianalisis, sementara prospek pengembangan sistem gabungan ini di masa mendatang disorot.
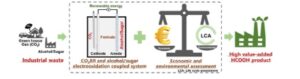
Abstrak
Format adalah bahan baku kimia penting yang banyak digunakan dalam pengobatan, pertanian, pewarna, dan penyimpanan energi. Elektroreduksi karbon dioksida (CO 2 ) menjadi format telah menjadi topik hangat dalam konteks penangkapan dan pemanfaatan CO 2 , yang relatif matang dan dapat diterapkan secara industri. Saat ini, reaksi evolusi oksigen (OER), yang merupakan proses tandingan di anoda elektroreduksi CO 2 menjadi format, merupakan penyebab tingginya permintaan energi. Sebagai alternatif, elektrooksidasi alkohol dan gula (mono- dan poliol) dapat diimplementasikan sebagai proses anoda untuk mengurangi kebutuhan energi dan memungkinkan kemungkinan menghasilkan produk bernilai tambah di kedua sisi sel elektrolisis. Artikel ini mengulas literatur tentang elektroreduksi CO 2 yang digabungkan dengan elektrooksidasi alkohol dan gula, dengan format sebagai produk target, dan menganalisis faktor-faktor yang memengaruhi efisiensinya seperti bahan katalitik, elektrolit, dan desain elektroliser dalam konfigurasi yang digabungkan. Selain itu, pemahaman terkini tentang kelayakan ekonomi dan lingkungan dari penggabungan kedua reaksi ini menuju produksi format dan peningkatan penerapan akan dianalisis. Terakhir, tantangan saat ini dan kemungkinan arah pengembangan di masa mendatang menuju penerapan dalam skala besar akan ditunjukkan.
1 Pendahuluan
Pada tahun 2024, konsentrasi karbon dioksida (CO 2 ) di atmosfer mencapai 420,9 ppm, yang ≈50% lebih tinggi dari tingkat pra-industri. [ 1 ] Mengurangi emisi CO 2 sangat penting untuk mengurangi kerusakan lingkungan (pengasaman laut, perubahan iklim, pencairan gletser, peristiwa cuaca ekstrem, dll.) dan memastikan masa depan yang berkelanjutan. Berbagai teknologi telah dikembangkan, termasuk penangkapan dan pemanfaatan CO 2 (CCU) dan penangkapan udara langsung (DAC). [ 2 – 4 ] Ini penting untuk mengurangi dampak perubahan iklim tetapi sering kali melibatkan biaya yang signifikan. Misalnya, penyerapan fisik menunjukkan biaya terendah per ton CO 2 yang ditangkap sebesar $12,38, dibandingkan dengan penyerapan kimia sebesar $48,07, pemisahan membran sebesar $36,78, dan penyerapan ayunan tekanan sebesar $33,30. [ 5 ] Selain itu, penyimpanan CO 2 yang ditangkap memerlukan pengeluaran tambahan untuk transportasi dan infrastruktur, yang meningkatkan beban keuangan dari proses penyerapan CO 2 . Oleh karena itu, konversi CO2 menjadi molekul platform yang berharga untuk produksi kimia bahan kimia dan material halus adalah kunci untuk menghasilkan pendapatan dan dengan demikian mengimbangi biaya penangkapan CO2 .
Jalur konversi CO 2 yang dilaporkan dalam literatur yang ada mencakup elektroreduksi CO 2 , proses biokimia, dan metode termokimia. [ 6 – 10 ] Reaksi elektroreduksi CO 2 (CO 2 RR) memanfaatkan energi listrik untuk menghasilkan bahan bakar dan bahan kimia, seperti format, karbon monoksida, metana, etanol, dan lainnya. Di antara berbagai kemungkinan produk CO 2 RR, format sangat relevan karena pasar globalnya diperkirakan mencapai $878,7 juta pada tahun 2027. Dibandingkan dengan metode industri tradisional untuk produksi format seperti karbonilasi metanol, yang memerlukan tekanan tinggi dan kondisi katalitik yang tepat, keuntungan dari menyiapkan format melalui CO 2 RR adalah dapat dilakukan pada suhu kamar dan tekanan sekitar dan dapat memanfaatkan listrik yang dihasilkan dari sumber energi terbarukan, seperti tenaga surya dan angin, membantu mengurangi ketergantungan pada bahan bakar fosil. Dalam hal aplikasi industri, format dapat digunakan untuk mensintesis obat-obatan, pestisida, dan pewarna. [ 11 ] Lebih jauh lagi, format memiliki fraksi massa hidrogen sebesar 4,4% dan kapasitas volume sebesar 53 g H 2 L −1 , yang dapat langsung digunakan sebagai bahan bakar bersih dalam sel bahan bakar format dan sebagai media penyimpanan hidrogen cair yang menjanjikan. [ 12 , 13 ] Singkatnya, format memiliki keuntungan dari penerapan yang luas, termasuk menjadi media yang sangat baik untuk penyimpanan hidrogen, sehingga memiliki nilai ekonomi yang tinggi. [ 14 – 16 ] Oleh karena itu, elektroreduksi CO 2 menjadi format telah menjadi fokus penelitian yang relevan.
Elektroreduksi CO2 yang dilaporkan dalam literatur yang ada biasanya digabungkan dengan reaksi evolusi oksigen (OER) sebagai proses anoda. [ 17 – 21 ] OER menunjukkan stabilitas tinggi dalam aplikasi industri, menghasilkan O2 pada kerapatan arus tinggi tanpa membentuk produk sampingan tambahan. [ 22 ] Namun, karena kinetika yang lambat dan overpotensial tinggi yang diperlukan untuk OER, biaya energi dari keseluruhan proses menjadi sangat tinggi. [ 23 ] Selain itu, tidak ada nilai ekonomi untuk oksigen yang diproduksi secara elektrokimia, yang selanjutnya membatasi aplikasi komersial teknologi elektroreduksi CO2. [ 24 , 25 ] Pengurangan biaya produksi dan penggunaan listrik yang efisien dapat diatasi dengan mempertimbangkan proses elektrolisis secara keseluruhan daripada sebagai dua setengah reaksi yang terpisah. Untuk alasan ini, para peneliti telah mulai mengeksplorasi reaksi anoda alternatif, khususnya, elektrooksidasi senyawa organik dengan potensi oksidasi yang lebih rendah daripada OER, dengan tujuan meningkatkan efisiensi energi dari keseluruhan proses. [ 26 – 29 ] Contoh reaksi anoda yang saat ini menerima perhatian signifikan adalah elektrooksidasi alkohol (seperti metanol atau gliserol), [ 30 , 31 ] gula (seperti glukosa atau xilosa), [ 32 , 33 ] dan lignin dan senyawa turunan lignin (seperti lignosulfonat dan fenol). [ 34 – 36 ] Pada tahun 2019, Na et al. [ 37 ] menunjukkan bahwa elektrooksidasi senyawa turunan biomassa dianggap sebagai alternatif yang layak untuk OER. Senyawa turunan biomassa telah menjadi bahan baku terbarukan yang penting dan pengganti sumber daya fosil yang berkelanjutan. Dengan demikian, menggabungkan elektroreduksi CO 2 (sebagai proses katode) dengan elektrooksidasi senyawa turunan biomassa (sebagai proses anoda) merupakan rute yang menarik untuk menilai CO 2dan senyawa yang berasal dari biomassa, sehingga tidak hanya meningkatkan efisiensi energi dari keseluruhan sistem elektrolisis tetapi juga potensi ekonomi karena kemungkinan memperoleh produk bernilai tambah dari oksidasi senyawa organik ini. Secara khusus, memperoleh format sebagai produk secara bersamaan di kedua sisi reaktor elektrokimia dapat menyederhanakan proses pemisahan format, sehingga membantu mengurangi biaya seluruh proses produksi dan meningkatkan efisiensi ekonomi.
Dalam tinjauan ini, kami membahas laporan literatur inovatif tentang elektroreduksi CO 2 yang digabungkan dengan elektrooksidasi alkohol dan gula (mono- dan poliol), khususnya dengan format sebagai produk utama dari kedua reaksi tersebut, yang diterbitkan dalam 5 tahun terakhir. Pemilihan bahan elektroda katode dan anoda, komposisi elektrolit, dan faktor-faktor lain yang terkait dengan elektroliser diperkenalkan secara rinci. Dengan mengoptimalkan aspek-aspek ini, laju reaksi dan selektivitas dapat ditingkatkan, sehingga mencapai proses elektrokatalitik yang lebih efisien. Selain itu, desain sistem terintegrasi juga perlu mempertimbangkan persyaratan untuk produksi industri. Ini tidak hanya mencakup kondisi pengoperasian elektroliser tetapi juga proses pemisahan dan pemurnian berikutnya, karena ini memengaruhi kinerja jangka panjang dan konsumsi energi seluruh sistem. Akhirnya, dampak ekonomi dan lingkungan dari sistem yang menggabungkan CO 2 RR dengan elektrooksidasi alkohol dan gula dibahas.
2 Menggabungkan Konversi Elektrokimia CO 2 dan Alkohol/Gula
Penggabungan CO 2 RR dengan elektrooksidasi alkohol atau gula berbasis bio (mono- dan poliol) untuk menghasilkan format memerlukan desain elektroda (anoda dan katoda), elektrolit, membran, dan elektroliser yang cermat untuk mencapai kinerja elektrokimia yang sangat baik dan keuntungan ekonomi/lingkungan. Hal ini biasanya dinilai melalui indikator kinerja dari tiga jenis: teknis, ekonomi, dan lingkungan ( Gambar 1 ). Jenis pertama, yang menyangkut evaluasi teknis sistem elektrokimia yang digabungkan, serta faktor-faktor yang memengaruhi dua konversi elektrokimia menuju produksi format, akan diperkenalkan di bagian ini.
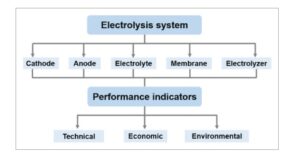
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Komponen dalam sistem elektrolisis yang memengaruhi parameter kinerja berbeda untuk elektroreduksi CO2 yang digabungkan dengan elektrooksidasi alkohol/gula.
2.1 Elektroreduksi CO 2 menjadi Format
Proses CO 2 RR menjadi format menantang secara energetik karena CO 2 adalah molekul yang sangat stabil, dan terdapat berbagai produk elektroreduksi CO 2 dengan potensi elektroreduksi yang serupa. [ 38 ] Reaksi ini melibatkan empat langkah utama: 1) CO 2 gas larut dalam elektrolit, 2) CO 2 berdifusi dan teradsorpsi ke permukaan elektroda, 3) CO 2 memperoleh elektron dan proton untuk membentuk format, dan 4) format terlepas dari situs aktif dan berdifusi ke dalam elektrolit. [ 39 ] Menurut literatur, langkah awal adalah transfer elektron ke molekul CO 2 untuk membentuk *CO 2 − (* menunjukkan situs adsorpsi). Selanjutnya, *CO 2 − yang teradsorpsi dapat bergabung dengan proton dari elektrolit untuk membentuk *OCHO atau *COOH. Jika atom C dalam *CO 2 − diadsorpsi pada situs aktif katalitik, atom O akan terprotonasi untuk membentuk *COOH, yang akhirnya dilepaskan untuk membentuk CO atau direduksi lebih lanjut untuk membentuk hidrokarbon atau alkohol yang berbeda. Jika sebaliknya atom O dalam *CO 2 − diadsorpsi pada situs aktif katalitik, atom C akan terprotonasi untuk membentuk *OCHO dan format akan diperoleh. [ 40 ]
Perlu dicatat bahwa HCOOH (asam format) dan HCOO − (format) dapat diproduksi dengan elektroreduksi CO 2 . Asam format terbentuk ketika elektrolit memiliki pH di bawah 3,75, meskipun jalur ini tidak disukai secara termodinamika. Ketika pH elektrolit di atas 3,75, format diperoleh. Penting juga untuk mempertimbangkan bahwa, ketika pH elektrolit lebih tinggi dari 7, potensi elektroreduksi CO 2 menjadi format lebih rendah daripada reaksi evolusi hidrogen (HER) yang bersaing. Dengan demikian, peningkatan alkalinitas elektrolit dapat meningkatkan elektroreduksi CO 2 menjadi format ( Gambar 2 a ). [ 41 , 42 ] Selain itu, elektrolisis dalam media alkali memungkinkan untuk menggunakan bahan-bahan yang melimpah di bumi dan berbiaya rendah sebagai elektrokatalis, berbeda dengan elektrolisis dalam media asam yang memerlukan penggunaan logam mulia karena ketahanan korosinya yang tinggi. Atas dua alasan ini, dalam tinjauan ini, kami berfokus pada elektrolisis alkali dan, khususnya, produksi format daripada asam format. Parameter yang umum digunakan untuk menilai kinerja teknis sistem elektrolisis (Gambar 1 ) terkait dengan aktivitas (overpotensial, kerapatan arus, dan konversi), selektivitas (efisiensi Faradaic (FE) dan/atau hasil terhadap produk tertentu), dan stabilitas (kinerja dari waktu ke waktu).
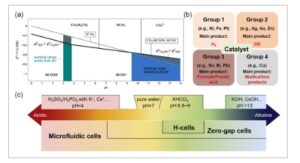
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
a) Diagram Pourbaix untuk elektroreduksi CO2 menjadi asam format/format; rentang pH kerja elektrolit asam dan basa ditunjukkan masing-masing dalam warna biru kehijauan dan biru muda; Dicetak ulang dari Ref. 42 Hak Cipta 2022, dengan izin dari Elsevier. b) Empat kelompok katalis logam untuk HER dan untuk elektroreduksi CO2 menjadi format, CO, dan hidrokarbon/oksigenat. c) Jenis elektrolit yang biasanya dilaporkan untuk elektroreduksi CO2 ; Dicetak ulang dari Ref. 59 Hak Cipta 2023, dengan izin dari Elsevier.
Selektivitas CO 2 RR bergantung pada kekuatan ikatan relatif dari zat antara reaksi (*COOH, *OCHO, *CO, dan *H) pada permukaan katalis, dan biasanya ditentukan oleh teknik analisis produk termasuk kromatografi cair kinerja tinggi (HPLC), kromatografi gas (GC), resonansi magnetik nuklir (NMR). Oleh karena itu, sifat katalis menentukan selektivitas, dan dapat dibagi menjadi empat kelompok sesuai dengan kapasitas adsorpsi yang berbeda dari zat antara pada permukaannya (Gambar 2b ). Kelompok katalis pertama meliputi Ni, Fe, dan Pt, yang menunjukkan overpotensial rendah terhadap HER dan kemampuan adsorpsi sedang untuk *H, sehingga lebih menyukai HER. Kelompok kedua, yang meliputi Ag, Pd, Au, dan Zn, lebih suka mengadsorpsi *COOH dari perspektif termodinamika, sehingga secara umum lebih menyukai pembentukan CO sebagai produk. Kelompok katalis ketiga meliputi Hg, Cd, Pb, Sn, Bi, dan In, yang secara termodinamika memfasilitasi penyerapan *OCHO, sehingga menghasilkan pembentukan terutama format. Kelompok keempat adalah Cu, yang dapat menstabilkan zat antara *CO dan *COOH, dan dengan demikian dapat mendukung pembentukan produk multikarbon. [ 43 ]
Dalam kasus konversi CO 2 menjadi format, sifat elektrokatalis juga mempengaruhi aktivasi dan efisiensi konversi molekul CO 2 . Secara khusus, katalis berbasis Bi dan Sn telah menarik perhatian luas karena biayanya yang rendah. Katalis berbasis Bi dan Sn juga memiliki afinitas oksigen yang relatif tinggi dan afinitas hidrogen yang lemah. Yang terakhir bermanfaat karena dapat membantu menekan HER yang bersaing, sementara yang pertama mendukung pembentukan perantara ikatan oksigen, seperti *OCHO, sehingga memiliki selektivitas yang lebih baik terhadap produksi format. Misalnya, Chai et al. [ 44 ] mensintesis Bi berpori, yang menunjukkan FE lebih dari 91% terhadap format dalam rentang potensial yang luas dari -0,75 hingga -1,1 V vs. elektroda hidrogen reversibel (RHE) dalam sel elektrokimia tipe-H. Selain itu, Qu et al. [ 45 ] juga melaporkan bahwa elektrokatalis Sn 3 O 4 yang didukung oleh karbon nanotube menunjukkan FE maksimum sebesar 91% terhadap format pada −0,79 V vs. RHE. Selain itu, sejumlah besar laporan literatur telah menunjukkan modifikasi katalis berbasis Bi dan Sn melalui berbagai strategi untuk meningkatkan aktivitas dan stabilitas katalitiknya. Misalnya, struktur elektronik dan sifat situs katalitiknya dapat dioptimalkan dengan paduan, doping, konstruksi heterostruktur, atau perancangan nanostruktur tertentu. [ 16 ] Beberapa artikel tinjauan secara sistematis meringkas strategi modifikasi ini dan mengeksplorasi peluang dan tantangan katalis sisi katode dalam CO 2 RR. [ 46 – 53 ]
Sebagai media pengangkut ion dalam proses elektrolisis, elektrolit juga memiliki dampak penting pada efisiensi proses CO 2 RR. [ 54 – 56 ] Pemilihan elektrolit yang cocok sering kali bergantung pada desain reaktor (Gambar 2c ). Misalnya, dalam sel elektrokimia tipe-H, elektrolit yang digunakan untuk sisi elektroreduksi CO 2 (katolit) biasanya adalah KHCO 3 berair , yang berfungsi sebagai sumber proton dan karbon pada saat yang sama. [ 57 , 58 ] Saat menggunakan elektroliser aliran, 1 M KOH sering digunakan untuk memastikan konduktivitas tinggi, sehingga mengatasi keterbatasan resistansi dalam sel elektrokimia dan mengurangi voltase sel keseluruhan. [ 59 – 62 ] Di sisi lain, pembentukan H 2 lebih disukai pada nilai pH yang lebih rendah, sementara nilai pH yang lebih tinggi dapat menekan HER dan meningkatkan selektivitas CO 2 RR terhadap format. [ 63 ] menggunakan teori fungsi kerapatan (DFT) untuk menghitung pengaruh konsentrasi KOH pada elektroreduksi CO 2 . Ditemukan bahwa peningkatan konsentrasi KOH mengurangi hambatan energi untuk elektroreduksi CO 2 dan dengan demikian meningkatkan kerapatan arus. Untuk pengaruh elektrolit pada kinerja elektroreduksi CO 2 , silakan lihat literatur berikut. [ 64 – 66 ]
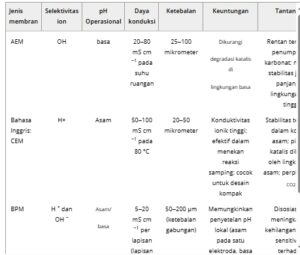
Komponen penting lainnya adalah membran pertukaran ion, yang digunakan untuk memisahkan ruang katode dan ruang anoda sambil memfasilitasi transfer ion selektif dan mencegah persilangan reagen dan produk. Jenis-jenis membran meliputi membran pertukaran anion (AEM), membran pertukaran kation (CEM), dan membran pertukaran bipolar (BPM). Sebagian besar reaktor elektrokimia skala lab yang dilaporkan menggunakan membran Nafion, di antaranya Nafion 117 adalah CEM yang paling banyak digunakan. AEM dan CEM hemat biaya, stabil, dan mudah diproduksi; namun, keduanya menghadapi tantangan seperti persilangan produk yang tinggi dan gradien pH yang tinggi melintasi membran. [ 67 – 69 ] Kerugian ini dapat diatasi dengan menggunakan BPM, yang terdiri dari struktur pertukaran ion berlapis yang terdiri dari lapisan selektif kation dan lapisan selektif anion. BPM secara efektif dapat mempertahankan tingkat pH yang stabil di seluruh strukturnya dengan memfasilitasi pergerakan anion dan kation secara selektif. [ 70 ] Namun, BPM lebih mahal, memiliki masa pakai yang lebih pendek, dan memiliki stabilitas yang lebih rendah. Masa pakai BPM yang pendek sebagian besar disebabkan oleh perpindahan ion bikarbonat, yang berubah menjadi CO 2 yang menyebabkan pembengkakan membran. [ 71 , 72 ] Untuk perbandingan terperinci dari berbagai jenis membran, lihat Tabel 1 . [ 73 , 74 ]
Tabel 1. Analisis komparatif berbagai jenis membran.
Desain elektroliser merupakan salah satu faktor kunci dalam meningkatkan efisiensi CO 2 RR. Elektroliser tipe H, yang biasanya digunakan untuk investigasi skala lab, telah secara bertahap digantikan oleh elektroliser aliran karena peningkatan efisiensi perpindahan massa yang terakhir. Misalnya, penggunaan elektroda difusi gas (GDE) dan rakitan elektroda membran (MEA) dapat secara signifikan meningkatkan efisiensi perpindahan massa CO 2 dan kerapatan arus elektroliser dengan menyediakan area kontak gas-cair yang lebih besar. [ 75 – 79 ] Meskipun tinjauan ini tidak menyelidiki kemajuan penelitian yang terkait dengan elektrokatalis, elektrolit, membran, dan elektroliser untuk proses elektroreduksi CO 2 , kami merujuk pembaca ke sejumlah penelitian yang mendokumentasikan aspek-aspek ini secara terperinci. [ 64 , 65 , 75 – 82 ]
2.2 Elektrooksidasi Alkohol dan Gula menjadi Format
Elektrooksidasi alkohol dan gula (mono- dan poliol) dianggap sebagai metode yang ramah lingkungan dan berkelanjutan untuk produksi format. [ 83 ] Untuk reaksi anoda ini, indikator kinerja serupa dengan CO 2 RR, dengan mempertimbangkan kebutuhan aktivitas tinggi (kepadatan arus tinggi pada overpotensial rendah), selektivitas tinggi (efisiensi Faradaic tinggi terhadap produk target), dan stabilitas jangka panjang yang memadai. Di bagian ini, efek elektrokatalis, elektrolit, dan desain elektroliser pada proses elektrolisis dibahas secara rinci. Lebih lanjut, kami membahas pemisahan format sebagai aspek penting yang perlu dipertimbangkan untuk kelayakan ekonomi dari keseluruhan proses.
2.2.1 Elektrooksidasi Alkohol dan Gula sebagai Reaksi Anoda Alternatif
Seperti dibahas dalam Bagian 1 , OER, yang biasanya merupakan reaksi anoda yang melawan CO 2 RR, adalah proses lambat yang memerlukan masukan energi besar. Oleh karena itu, menerapkan reaksi anoda alternatif adalah rute yang menjanjikan untuk meningkatkan efisiensi energi dari keseluruhan proses elektrolisis. [ 29 ] Ketika memilih reaksi anoda untuk menggantikan OER, sangat penting untuk memastikan bahwa potensi elektrooksidasinya lebih rendah daripada OER. [ 84 ] Selain itu, kelayakan ekonomi dari proses tersebut dapat lebih ditingkatkan jika proses elektrooksidasi secara selektif mengarah pada pembentukan bahan kimia bernilai tinggi. [ 85 – 89 ] Tabel 2 mencantumkan potensi elektrokimia dari elektrooksidasi berbagai alkohol dan gula. [ 90 ] Dapat dilihat bahwa potensi elektrokimia OER secara substansial lebih tinggi daripada senyawa organik yang terdaftar, yang menunjukkan bahwa elektrooksidasi air kurang menguntungkan secara termodinamika daripada senyawa organik. Oleh karena itu, desain sistem reaksi berpasangan yang wajar dengan konsumsi energi rendah untuk memperoleh produk bernilai tambah tinggi dapat membuat sistem dua reaksi lebih layak secara ekonomi.
Tabel 2. Potensial elektrokimia reaksi oksidasi anoda tipikal yang melibatkan alkohol dan gula. [ 37 , 118 ]
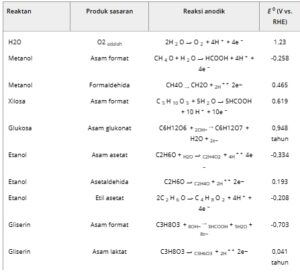
Elektrooksidasi gugus hidroksil dalam alkohol dan gula dalam media alkali menghasilkan pembentukan keton/aldehida, karboksilat, dan/atau karbonat. Dibandingkan dengan produk berharga lainnya seperti laktat dan asetat, format memiliki prospek aplikasi yang luas dalam sel bahan bakar dan sistem penyimpanan energi. Selain itu, literatur menunjukkan bahwa format dapat diperoleh dengan selektivitas yang sangat tinggi dibandingkan dengan produk lainnya. Memperoleh format sebagai satu-satunya produk dari kedua setengah reaksi sel elektrolisis dapat mengurangi kompleksitas dan biaya operasi pemrosesan selanjutnya (vide infra). Tabel 3 mencantumkan data kinerja relevan yang dilaporkan dalam literatur yang ada mengenai CO 2 RR yang digabungkan dengan elektrooksidasi alkohol atau gula untuk menghasilkan format.
Tabel 3. Tabel ringkasan elektroreduksi CO2 yang digabungkan dengan elektrooksidasi alkohol dan gula menjadi format.
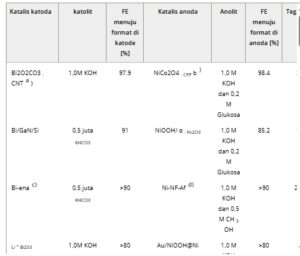
a) CNT: karbon nanotube;
b) CFP: kertas serat karbon;
c) Bi-ena: bismuten;
d) NF-Af: susunan nanosheet busa nikel;
e) Bi-ene-A/CM: Jaringan terbuka 3D dari susunan bismuthene yang saling terhubung pada jaring tembaga;
f) NF : Busa Ni;
g) LDH: hidroksida berlapis ganda;
h) mSnO2 /CC: SnO2 mesopori tumbuh pada kain karbon ;
i) CuONS/CF: lembaran nano CuO tumbuh pada busa tembaga;
j) NS: lembaran nano;
k) HOS/CP: lembaran nano hidroksisulfida pada kertas karbon;
l) HOD-Cu: Cu(OH) 2 -turunan Cu;
m) HOD-CuO: CuO yang berasal dari Cu(OH) 2 ;
n) NR: batang nano;
o) np: nanopori;
p) Vo-BOC-NS: lembaran nano Bi 2 O 2 CO 3 sangat tipis dengan kekosongan oksigen yang melimpah;
q) Ni 0,33 Co 0,67 (OH) 2 @HOS/NF: katalis nanoneedle nikel–kobalt hidroksida yang didukung pada busa Ni;
r) BOC: bismut oksida karbonat;
s) rGO: oksida grafen tereduksi;
t) CC: kain karbon;
u) Cu(F): busa Cu;
v) AEM: membran pertukaran anion;
w) BPM: membran pertukaran bipolar;
x) PEM: membran pertukaran proton;
y) CEM: membran pertukaran kation.
Kriteria penting lainnya untuk memilih senyawa elektrooksidasi adalah harga dan ketersediaan substrat. Contohnya adalah alkohol, seperti metanol (yang dapat diproduksi dari syngas melalui gasifikasi biomassa lignoselulosa atau dengan konversi biogas) dan gliserol (yang merupakan produk sampingan dari produksi biodiesel dari minyak sayur dan lemak hewani). [ 91 , 92 ] Baik alkohol, metanol maupun gliserol, dapat dielektrooksidasi untuk membentuk format, sehingga meningkatkan pemanfaatan sumber daya biomassa yang bernilai tinggi. Selain itu, harga bahan baku untuk gliserol (sekitar $170 ton −1 ) dan metanol (sekitar $300 ton −1 ) relatif rendah, sedangkan harga pasar format sekitar $600 ton −1 (perhatikan bahwa ini adalah harga grosir untuk komoditas curah, dan biaya tambahan seperti penyesuaian kemurnian dan logistik harus dipertimbangkan). [ 93 ] Ini menunjukkan bahwa penggunaan metanol dan gliserol sebagai bahan baku untuk proses elektrooksidasi dapat secara substansial meningkatkan nilai ekonomi dari keseluruhan proses. Pada saat yang sama, adalah mungkin untuk memperoleh format dari elektrooksidasi metanol dan gliserol dengan selektivitas dan rapat arus yang tinggi. [ 94 ] Misalnya, Liu et al. [ 31 ] melaporkan kinerja elektroda heterojunction Au/NiOOH@Ni sebagai elektrokatalis untuk reaksi elektrooksidasi metanol yang secara efisien digabungkan dengan elektroreduksi CO 2 menjadi format pada rapat arus tingkat ampere. Katalis anoda (Au/NiOOH@Ni) menunjukkan ≈100% FE terhadap format dalam rentang rapat arus dari 200 hingga 1200 mA cm −2 . Investigasi Raman in situ dan perhitungan teoritis mengungkapkan bahwa heterojunction Au/NiOOH meningkatkan Ni 3+/4+ OOH yang sangat aktif , yang secara terus-menerus menyediakan situs aktif yang melimpah untuk elektrooksidasi metanol.
Gula, seperti glukosa atau fruktosa, juga merupakan contoh senyawa yang layak untuk reaksi elektrooksidasi. Elektrooksidasi gula yang digabungkan dengan CO 2 RR jarang dilaporkan dalam literatur. Contohnya adalah karya Zhao et al. [ 95 ] yang menunjukkan elektroreduksi CO 2 yang digabungkan dengan reaksi elektrooksidasi glukosa (CO 2 RR//GEOR) untuk secara simultan menghasilkan format dalam dua setengah sel. Sistem CO 2 RR//GEOR menunjukkan FE tinggi terhadap format (FE CO2RR > 90%; FE GEOR > 90%) dalam rentang tegangan sel lebar dari 1,8 hingga 2,4 V, mencapai penghematan energi ≈33,3% dibandingkan dengan CO 2 RR//OER dengan hasil format tinggi sebesar 0,92 mol g −1 h −1 pada 100 mA cm −2 . Sementara itu, literatur tentang elektrooksidasi gula sebagai reaksi alternatif terhadap OER sangat luas bila digabungkan dengan HER (bukan elektroreduksi CO2 ) sebagai proses katode. [ 96 ] Misalnya, Liu et al. [ 97 ] melaporkan bahwa, untuk elektrooksidasi xilosa yang digabungkan dengan HER, potensial yang diperlukan untuk mencapai kerapatan arus 100 mA cm −2 adalah 290 mV lebih rendah daripada yang diperlukan oleh OER.
Alkohol lain seperti 5-hidrometilfurfural (5-HMF) dan alkohol furfural juga memiliki potensi aplikasi penting dalam bidang konversi elektrooksidasi, yang dapat diubah menjadi bahan kimia bernilai tambah tinggi seperti asam 2,5-furandikarboksilat (FDCA) dan asam 2-furoat. FDCA dan asam 2-furoat memiliki berbagai aplikasi dalam bioplastik, obat-obatan, wewangian, dan pestisida. [ 98 – 102 ] Secara umum, kombinasi CO 2 RR dan elektrooksidasi alkohol dan gula merupakan bidang baru yang memerlukan penyelidikan dan pengoptimalan lebih lanjut.
2.2.2 Elektrokatalis dan Elektrolit untuk Elektrooksidasi Alkohol dan Gula
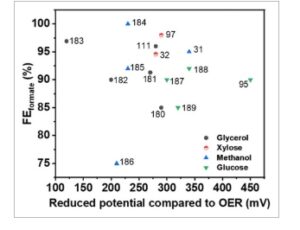
Katalis berbasis logam transisi telah menarik perhatian luas karena kelimpahannya yang tinggi di bumi, ramah lingkungan, dan biaya rendah dibandingkan dengan bahan berbasis logam mulia. Khususnya, katalis berbasis Ni dan Co telah diselidiki sebagai elektrokatalis untuk elektrooksidasi mono dan poliol dalam media alkali, melaporkan selektivitas mendekati 100% terhadap format ( Gambar 3 ), [ 95 , 103 – 106 ] sementara mereka dapat dengan mudah dimodifikasi dengan doping, paduan dan rekayasa permukaan untuk lebih meningkatkan aktivitas, selektivitas dan stabilitasnya. [ 107 – 109 ]
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
FE terhadap format (FE format ) dan penurunan potensial elektroda dibandingkan dengan OER yang diperoleh dari elektrolisis gliserol, xilosa, metanol, dan glukosa. [ 31 , 32 , 95 , 97 , 111 , 180 – 189 ]
Bahan berbasis Ni dianggap sebagai salah satu katalis yang paling menjanjikan untuk reaksi ini karena sifat elektrooksidasinya yang baik, yang juga memiliki aktivitas dan stabilitas signifikan dalam elektrolit alkali. Mengambil elektrooksidasi metanol sebagai contoh, Luo et al. [ 110 ] menyiapkan susunan oksida nikel hierarkis pada busa nikel (NiO NS@NW NF) dan mengevaluasi kinerjanya dalam elektrolit alkali yang terdiri dari 1 M KOH dan 0,5 M metanol. Hasilnya menunjukkan bahwa pada potensial 1,62 V vs. RHE, kerapatan arus 89 mA cm −2 tercapai, sedangkan dalam elektrolit bebas metanol, kerapatan arus adalah ≈15 mA cm −2 . Selain itu, elektroda berbasis NiO NS@NW NF mempertahankan stabilitas tinggi selama 1000 siklus voltametri. Dalam kasus reaksi elektrooksidasi gliserol, katalis berbasis Ni menunjukkan kinerja elektrooksidasi yang sangat baik dalam elektrolit alkali (misalnya, 1 M KOH) dibandingkan dengan logam transisi lain yang melimpah di bumi, seperti Fe, Mn, atau Co. Morales et al. [ 111 ] menemukan bahwa nanopartikel oksida Ni yang didukung oleh tabung nano karbon berdinding banyak (MWCNT) hanya memerlukan 1,31 V vs. RHE untuk mencapai kerapatan arus 10 mA cm −2 dengan adanya 1 M gliserol, sementara katalis berbasis Fe, Mn, dan Co yang analog memerlukan potensial 1,55, 1,66, dan 1,49 V vs. RHE, masing-masing, untuk mencapai kerapatan arus yang sama. Selain itu, potensial terapan yang diperlukan untuk OER untuk mencapai 10 mA cm −2 adalah 1,59 V vs. RHE. Kinerja elektrooksidasi tinggi yang ditunjukkan oleh logam berbasis Ni disebabkan oleh konversi Ni menjadi Ni 3+/4+ OOH selama elektrooksidasi, yang secara terus-menerus menyediakan banyak situs aktif. [ 31 , 112 ] Hasil-hasil ini menunjukkan bahwa katalis berbasis Ni dapat secara efektif mengkatalisis elektrooksidasi alkohol/gula pada potensial yang lebih rendah dan menunjukkan aktivitas elektrooksidasi yang lebih tinggi dibandingkan dengan logam lain, memberikan keuntungan yang signifikan sebagai alternatif OER dalam aplikasi elektrokatalitik.
Dibandingkan dengan katalis berbasis Ni monometalik, bahan yang menggabungkan Ni dan logam transisi kedua, khususnya Co, sering menunjukkan peningkatan kinerja terhadap elektrooksidasi alkohol dan gula. [ 113 – 115 ] Misalnya, Ko et al. [ 114 ] mendesain NiCo 2 O 4 seperti inti-cangkang yang ditopang pada MWCNT. Nanopartikel oksida bimetalik didistribusikan secara homogen pada permukaan MWCNT, yang menunjukkan kerapatan arus yang sangat baik sebesar 327 mA cm −2 pada potensial terapan sebesar 0,657 V vs. Ag|AgCl|KCl (jenuh), diukur dalam larutan KOH 1,0 M yang mengandung 5,0 M metanol, sedangkan kerapatan arus yang sesuai dengan OER (tanpa metanol) adalah sekitar ≈30 mA cm −2 pada potensial yang sama. Contoh lain adalah laporan oleh Braun et al. [ 116 ] pada kobalt nikel borida (CoNiB) yang tertanam dalam polibenzoksazin, sebagai elektrokatalis untuk elektrooksidasi gliserol dalam larutan alkali. Ditemukan bahwa dalam larutan KOH 1 M, arus OER CoNiB meningkat secara eksponensial pada potensial >1,5 V vs. RHE, sementara dalam elektrolit yang mengandung gliserol, peningkatan rapat arus diamati pada potensial yang jauh lebih rendah (sekitar 1,32 V vs. RHE) pada rapat arus 10 mA cm −2 . Perbedaan potensial elektroda yang diukur untuk OER dan untuk reaksi oksidasi gliserol (GOR) yang diukur pada 10 mA cm −2 (ΔE) dapat digunakan sebagai ukuran energi yang dihemat dengan mengganti OER dengan GOR. CoNiB, misalnya, memiliki nilai ΔE sebesar 224 ± 6 mV. Selain itu, Li et al. [ 117 ] melaporkan nanoplat nikel-molibdenum-nitrida yang dimuat pada kain serat karbon sebagai elektrokatalis GOR untuk menghasilkan format. Selain itu, elektrooksidasi gliserol menjadi format bernilai tambah tinggi dengan selektivitas 95% telah ditunjukkan. Karena termodinamika elektrooksidasi gliserol yang jauh lebih baik dan kinetika yang lebih baik dibandingkan dengan OER, konfigurasi dua elektroda hanya memerlukan tegangan sel rendah sebesar 1,36 V pada kerapatan arus 10 mA cm −2 , yang 260 mV lebih rendah daripada yang diperlukan oleh elektrolisis air konvensional dengan OER sebagai reaksi anoda.
Memproduksi format dengan selektivitas tinggi dan hasil tinggi adalah target penting dalam elektrooksidasi alkohol dan gula. [ 89 ] Ini menyiratkan bahwa setelah format diproduksi, oksidasi lebih lanjut harus dicegah selama proses elektrolisis. [ 70 , 95 ] Zhao et al. [ 95 ] menganalisis spektrum 13 C NMR dari sampel elektrolit yang dikumpulkan pada waktu reaksi yang berbeda dan menemukan bahwa format adalah satu-satunya produk dari elektrooksidasi glukosa selama 2 jam pertama elektrolisis. Namun, ketika glukosa hampir habis (≈10 jam), produk karbonat muncul, yang menunjukkan bahwa format teroksidasi lebih lanjut. Saat waktu reaksi meningkat (≈25 jam), karbonat adalah satu-satunya produk. Ini juga diamati selama elektrooksidasi gliserol pada katalis berbasis oksida Ni, terutama ketika potensial elektroda ditingkatkan. [ 111 ] Oleh karena itu, penting bahwa katalis anoda dirancang dengan hati-hati dan kondisi elektrolisis dioptimalkan untuk mencegah oksidasi penuh alkohol dan gula menjadi karbonat. Strategi desain katalis yang relevan dapat dirujuk pada literatur berikut. [ 26 , 90 , 118 ]
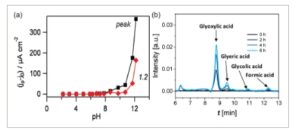
Selain elektroda (yang terdiri dari material elektrokatalitik dan penyangga katalis), komposisi elektrolit juga memainkan peran penting dalam kinerja sistem elektrolisis. KOH 1 M biasanya digunakan sebagai anolit dalam kombinasi dengan alkohol atau gula terkait yang akan dioksidasi, [ 119 – 125 ] dan penggunaan elektrolit yang berbeda sering kali menghasilkan kinerja yang sangat berbeda. Misalnya, Ruiz-Camacho et al. [ 126 ] mengevaluasi kinerja katalis Pt-Ag/C terhadap elektrooksidasi metanol dalam dua elektrolit (0,5 MH 2 SO 4 dan KOH 0,5 M) dengan adanya metanol 0,5 M. Hasilnya menunjukkan bahwa rapat arus maksimum dalam larutan KOH 0,5 M adalah 164,6 mA cm −2 pada 0,03 V vs. RHE, yang lebih tinggi daripada rapat arus maksimum yang diukur dalam larutan MH 2 SO 4 0,5 (17,5 mA cm −2 pada 0,86 V vs. RHE). Selain itu, pengukuran kronoamperometrik juga menunjukkan bahwa selama elektrooksidasi metanol dalam elektrolit alkali, rapat arus yang lebih tinggi dicapai dibandingkan dengan elektrolit asam. Kwon et al. [ 127 ] mengusulkan bahwa langkah deprotonasi awal (transfer proton “alfa”) dalam elektrooksidasi alkohol dikatalisis oleh basa, dengan katalis tidak memainkan peran penting. Aktivitas menuju elektrooksidasi alkohol bervariasi dalam cara yang sangat nonlinier dengan pH, mencapai nilai optimal ketika pH larutan kira-kira dekat dengan pKa alkohol ( Gambar 4 a ). [ 128 ] Gula juga dapat terdisosiasi sendiri dalam media alkali (misalnya, dalam 0,1 M NaOH). [ 129 ] Misalnya, Rafaïdeen et al. [ 130 ] menemukan bahwa glukosa 0,1 M disimpan selama 6 jam dalam 0,1 M NaOH tanpa adanya katalis, sehingga menghasilkan glioksilat, gliserat, dan glikolat (Gambar 4b ), yang menunjukkan bahwa hidroksida yang ada dalam larutan dapat meningkatkan deprotonasi awal melalui keseimbangan asam-basa.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
a) Kepadatan arus j P untuk elektrooksidasi etanol 0,5 M pada elektrode emas pada potensial puncak (kurva hitam) atau pada 1,2 V vs. RHE (kurva merah) yang diplot terhadap pH elektrolit menggunakan larutan penyangga fosfat 0,1 M; Dicetak ulang dengan izin dari Ref. 127 Hak Cipta 2011, American Chemical Society. b) Kromatogram HPLC yang direkam sebagai fungsi waktu yang sesuai dengan penuaan 6 jam glukosa 0,1 M dalam NaOH 0,1 M. Dicetak ulang dengan izin dari Ref. [ 130 ] di bawah lisensi CC BY 4.0.
2.3 Konfigurasi Reaktor Elektrokimia
Sel elektrolit untuk CO 2 RR yang digabungkan dengan elektrooksidasi alkohol atau gula yang dilaporkan dalam literatur yang ada biasanya adalah sel tipe H dan sel aliran. Sel elektrolit tipe H yang umum terdiri dari ruang katode dan ruang anoda. Dalam sebuah laporan oleh Liu et al. [ 105 ] CO 2 RR dan reaksi oksidasi metanol (MOR) dievaluasi sebagai reaksi katode dan anoda, masing-masing, dalam sel tipe H dengan BiO 2 dan CuS sebagai bahan elektroda, masing-masing. Selama proses elektrolisis, hasil dari voltametri sapuan linier menunjukkan bahwa penggabungan kedua reaksi tersebut menyebabkan pengurangan tegangan sel dibandingkan dengan penggabungan OER sebagai reaksi anoda. Secara khusus, tegangan sel dalam konfigurasi terintegrasi MOR dikurangi sebesar 272 mV pada kerapatan arus 10 mA cm − 2 dibandingkan dengan kasus di mana OER adalah proses anoda ( Gambar 5 a,b ).
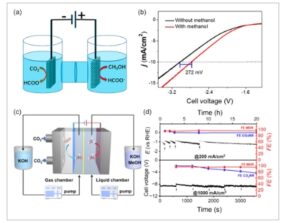
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
a) Ilustrasi elektroreduksi CO 2 yang digabungkan dengan reaksi elektrooksidasi metanol untuk menghasilkan format dalam sel elektrolisis tipe-H. b) Voltamogram sapuan linear dari sel elektrolisis menggunakan BiO 2 sebagai anoda dan CuS sebagai katoda, dengan dan tanpa penambahan 1,0 M metanol, dalam 1 M KOH; Dicetak ulang dengan izin dari Ref. 105 Hak Cipta 2022, American Chemical Society. c) Ilustrasi skematis elektroreduksi CO 2 yang digabungkan dengan reaksi elektrooksidasi metanol untuk menghasilkan format dalam sel aliran, dan d) yang sesuai (FE) terhadap format yang diukur pada rapat arus 200 mA cm −2 selama 20 jam, dan 1 A cm −2 selama 3600 detik. Dicetak ulang dengan izin dari Ref. [ 31 ] Hak Cipta 2024, American Chemical Society.
Karena kelarutan CO 2 yang rendah dalam elektrolit berbasis air dan lintasan difusi yang panjang (≈50 μm) dalam sel elektrolit tipe H, reaksi sangat dipengaruhi oleh keterbatasan perpindahan massa, dan sulit untuk mencapai kerapatan arus yang relevan dengan industri (>200 mA cm −2 ). Jarak yang relatif jauh antara anoda dan katoda menyebabkan kerugian ohmik yang besar, sehingga menghasilkan konsumsi energi yang besar untuk mengatasi keterbatasan konduktivitas. [ 131 ]
Oleh karena itu, sementara sel elektrolit tipe-H cocok untuk menyaring katalis dan elektrolit pada skala laboratorium, para peneliti telah merancang dan mengembangkan sel elektrolit aliran dengan tujuan mengatasi keterbatasan perpindahan massa. Sel aliran yang khas mencapai hal ini dengan menggunakan pompa sirkulasi untuk mengangkut reaktan ke kompartemen katode dan secara efisien mengeluarkan produk dari ruang reaksi. Desain ini tidak hanya mengurangi resistansi ohmik dan meningkatkan efisiensi energi tetapi juga memungkinkan operasi yang terus menerus dan stabil. Misalnya, Liu et al. [ 31 ] mengevaluasi kinerja sel aliran elektrokimia yang terdiri dari reaksi CO 2 RR//MOR yang digabungkan, yang mencapai kerapatan arus relevan industri sebesar 1,2 A cm −2 . Yang penting, kinerja yang diamati, dalam hal kerapatan arus dan selektivitas, dipertahankan pada 200 mA cm −2 selama periode operasi 20 jam (Gambar 5c,d ).
Penting untuk dicatat bahwa, dibandingkan dengan CO 2 RR yang dioperasikan secara independen atau reaksi elektrooksidasi alkohol/gula, sistem yang digabungkan sering kali menghadapi lingkungan reaksi yang lebih kompleks. Proses katode dan anoda mungkin memiliki efek silang, misalnya, produk katode dan anoda dapat bermigrasi melalui membran pertukaran ion ke kompartemen yang berlawanan, mengganggu operasi stabil reaksi balik. Selain itu, fluktuasi pH selama proses reduksi katode dapat mengubah keadaan antarmuka reaksi anoda, dan sebaliknya. Dengan demikian, penelitian sistematis tentang pengoptimalan elektrolit dan penonaktifan katalis dalam sistem elektrolisis yang digabungkan diperlukan untuk lebih memajukan elektrolisis CO 2 yang digabungkan dengan elektrooksidasi alkohol dan gula. Lebih jauh, untuk mencapai skalabilitas, pengembangan desain reaktor aliran khusus diperlukan, yang mengatasi masalah saat ini seperti stabilitas mekanis dan kimia yang tidak memadai tidak hanya pada elektroda tetapi juga membran, manajemen aliran gas-cair, dan keterbatasan migrasi ion, antara lain.
2.4 Pemisahan dan Pemurnian Format
Pembentukan format melalui CO 2 RR yang digabungkan dan elektrooksidasi alkohol atau gula cukup menjanjikan dalam hal kerapatan arus, overpotensial, dan FE. Meskipun demikian, satu kelemahan penting adalah bahwa produk yang diperoleh, yaitu format, diencerkan dalam elektrolit, yang membuatnya perlu menggunakan proses pemisahan yang membutuhkan banyak energi untuk mengekstraknya dari larutan elektrolit. Diperkirakan bahwa biaya pemisahan dan pemurnian format dari elektrolit mencapai lebih dari 70% dari total biaya produksi. [ 48 , 132 ] Oleh karena itu, berbagai pendekatan telah dieksplorasi untuk mengurangi konsumsi energi pemisahan hilir. [ 133 ] Pendekatan yang relevan dirangkum dalam bagian ini.
Pendekatan yang menjanjikan untuk memperoleh asam format secara langsung di laboratorium adalah dengan menyisipkan kompartemen elektrolit padat tambahan antara anoda dan katoda. Dalam desain elektroliser ini, katoda dan anoda bersentuhan langsung dengan AEM dan CEM, berturut-turut. Ion-ion yang dihasilkan di katoda dan anoda (HCOO − dan H + ) bermigrasi melalui AEM dan CEM ke kompartemen pusat, tempat molekul asam format murni terbentuk dan dipulihkan tanpa pemisahan dan pemurnian lebih lanjut. [ 134 – 136 ] Contoh lain ditemukan dalam karya Fan et al. [ 137 ] yang menggunakan sistem CO 2 RR elektrokimia keadaan padat (dengan luas geometri elektroda 1 cm 2 ) untuk pembangkitan berkelanjutan larutan asam format dengan kemurnian tinggi dan konsentrasi tinggi. Asam format yang dihasilkan dapat dihilangkan secara efektif dalam bentuk uap dengan mengalirkan gas inert melalui lapisan elektrolit padat. Selain itu, hasil eksperimen menunjukkan bahwa sistem elektroreduksi CO 2 yang sangat aktif (densitas arus ≈450 mA cm −2 ), sangat selektif (FE maksimum ≈97% terhadap format), dan sangat stabil (100 jam) dapat diperoleh menggunakan katalis Bi yang diperkaya batas butir. Konsentrasi larutan asam format yang sangat tinggi (hingga hampir 100 wt.%) dapat dikondensasikan dari uap yang dihasilkan dengan menyesuaikan aliran gas pembawa. Demikian pula, Zeng et al. [ 138 ] menyiapkan elektrolit padat penghantar proton 3 cm 2 untuk menghindari pencampuran larutan format dan elektrolit. Ion format yang dihasilkan di katode (dari elektroreduksi CO 2 ) mencapai ruang antara di bawah aksi medan listrik, sementara proton hidrogen yang dihasilkan di anoda bermigrasi ke ruang antara untuk membentuk asam format dan berdifusi melalui air. Bila laju alir air deionisasi adalah 45 mL h −1 , selektivitas terhadap asam format dapat dipertahankan di atas 90%. Bila tegangan yang diberikan adalah −3,86 V, FE terhadap asam format mencapai 94% pada kerapatan arus 375 mA cm −2 , menghasilkan larutan asam format 0,16 M. Selain itu, sistem elektrolisis yang digabungkan dapat beroperasi secara stabil selama 180 jam pada tegangan sel yang diberikan sebesar −3,45 V.
Meskipun penggunaan elektrolit padat telah dilaporkan sebagai metode untuk memisahkan produk (asam format atau format), penerapan teknologi ini pada skala industri masih menghadapi beberapa tantangan, seperti kebutuhan untuk lebih meningkatkan luas elektroda dan untuk meningkatkan stabilitas jangka panjang. Oleh karena itu, proses pemisahan lainnya sering diperlukan untuk mengekstraksi produk dari elektrolit. Metode yang umum digunakan untuk memisahkan campuran asam format dan air secara industri adalah distilasi. Distilasi atmosferik biasa tidak memungkinkan untuk memisahkan asam format dari larutan berair karena perbedaan kecil dalam titik didihnya (masing-masing 100,8 dan 100 °C). Karena air dan asam format membentuk azeotrop, distilasi azeotropik ekstraktif, distilasi ayunan tekanan, dan teknologi distilasi penambahan garam dapat dipilih. Di antara semuanya, proses distilasi ayunan tekanan digunakan secara luas karena sangat cocok untuk pemisahan sistem azeotropik dan tidak memerlukan penambahan komponen ketiga dalam campuran. Selain itu, dapat dikombinasikan dengan elektrolisis dengan integrasi panas. Proses distilasi ayunan tekanan memanfaatkan karakteristik bahwa komposisi dan titik didih asam format dan air akan berubah dalam kondisi tekanan yang berbeda, sehingga dapat melakukan distilasi dalam kondisi tekanan tinggi dan tekanan rendah untuk memisahkan asam format dan air. Meskipun demikian, pendekatan ini membutuhkan banyak energi dan karenanya mahal, dengan konsumsi energi pemisahan asam format pada skala komersial sekitar 35 MJ kg −1 asam format. [ 139 , 140 ]
Elektrodialisis dapat digunakan dalam desalinasi air, pemulihan asam, dan pengolahan air limbah dan saat ini diteliti sebagai alternatif yang efisien untuk mengekstraksi asam format dari larutan elektrolit. [ 141 – 145 ] Misalnya, Wu et al. [ 146 ] mengusulkan untuk melakukan elektrodialisis menggunakan dua membran penukar anion yang berbeda (3362 W dan AM-203). Elektrodialiser memiliki ruang anoda dan ruang katoda, yang dipisahkan oleh AEM, dan konsentrasi asam format awal di kedua ruang adalah 30 wt%. Anion format memasuki kompartemen anoda melalui AEM dan bergabung dengan proton di kompartemen anoda untuk membentuk asam format; di kompartemen katoda, H + tertahan dan bereaksi dengan ion hidroksida untuk membentuk air. Konsentrasi asam format di kompartemen anoda secara bertahap meningkat, sedangkan asam format di kompartemen katoda secara bertahap menurun. Pada saat yang sama, elektrolit katoda dapat didaur ulang lebih lanjut. Dalam laporan lain, Kaur et al. [ 144 ] menyajikan elektroliser tiga kompartemen yang dapat diskalakan untuk elektroreduksi CO 2 menjadi format dan ekstraksi format sebagai asam format murni dengan elektrodialisis. Hasil penelitian menunjukkan bahwa laju pemulihan asam format adalah 88% menggunakan elektrodialisis konvensional (CED) dan 46% menggunakan elektrodialisis membran bipolar (BMED). Selain itu, BMED dapat memulihkan >95% K + sebagai basa dan 12 L CO 2 murni . Pemulihan asam format yang rendah menggunakan BEMD mungkin disebabkan oleh alkalinitas yang tinggi dan komposisi kimia yang kompleks dari larutan elektrolit (KOH, KHCO 3 dan K 2 CO 3 ). Selain itu, CO 2 dihasilkan karena ion CO 3 2− atau HCO 3 − terbentuk selama proses konversi elektrokimia dalam media alkali, yang akan diubah menjadi CO 2 murni ketika dikombinasikan dengan H + selama proses pemisahan produk BEMD, yang mengakibatkan kebocoran produk, sehingga mengurangi pemulihan dan meningkatkan proses ekstraksi dan konsumsi daya. Mengingat rendahnya laju pemulihan asam format dan tingginya laju pemulihan KOH pada metode BEMD, disarankan untuk menggabungkan BMED dengan CED sehingga keseluruhan proses elektrodialisis memiliki potensi industri tertentu, tetapi penelitian lebih lanjut diperlukan untuk mengoptimalkan sistem elektrodialisis dan kondisi operasinya guna mencapai produksi asam format dan kinerja ekstraksi berskala besar, serta meningkatkan laju pemulihan.
Dalam kasus sistem elektrolisis berpasangan yang terdiri dari elektroreduksi CO 2 dan elektrooksidasi alkohol/gula, tujuannya adalah untuk mencapai kerapatan arus tinggi dan FE tinggi terhadap format pada tegangan sel rendah, serta mencapai stabilitas jangka panjang. Katalis anoda dan katoda yang sangat efisien serta elektrolit, membran pertukaran ion, dan proses pemisahan yang sesuai harus dikembangkan lebih lanjut untuk mengoptimalkan proses elektrolisis secara keseluruhan.
3 Penilaian Kinerja
Pada bagian ini, kelayakan ekonomi dan dampak lingkungan dari CO 2 RR yang digabungkan dengan elektrooksidasi alkohol/gula dievaluasi secara sistematis, yang penting untuk menilai proses elektrolisis berpasangan dalam hal keberlanjutan. Pertama, kami merangkum dan membandingkan dampak parameter utama, seperti kerapatan arus, voltase, dan harga listrik, terhadap efisiensi proses elektrolisis, biaya produksi, dan konsumsi energi, dan mengevaluasi secara kuantitatif kelayakan ekonomi dari berbagai reaksi anoda. Secara khusus, biaya produksi asam format melalui CO 2 RR dievaluasi, dan dampak dari berbagai faktor, seperti kerapatan arus, jenis elektrolit, dan bahan elektroda, terhadap biaya produksi asam format dibahas. Kami selanjutnya mengeksplorasi potensi pengurangan emisi karbon dalam berbagai kondisi pasokan energi (seperti energi fosil vs. energi terbarukan) untuk mengevaluasi secara komprehensif keuntungan lingkungan dari sistem yang digabungkan sebagai indikator kinerja untuk mengukur tingkat peningkatan dampak lingkungan secara keseluruhan. Akhirnya, kami merangkum dampak dampak pemanasan global (GWI) ketika elektrooksidasi alkohol/gula menggantikan OER sebagai reaksi anoda.
3.1 Penilaian Kinerja Ekonomi
Analisis teknoekonomi (TEA) adalah metode untuk mengevaluasi kinerja teknis dan kelayakan ekonomi dari solusi teknologi. Hingga saat ini, banyak penelitian telah menerapkan TEA pada CO, format, dan etena sebagai produk dari elektroreduksi CO 2 . [ 147 – 151 ] Misalnya, Jiao et al. [ 152 ] menghitung nilai sekarang bersih (NPV) dari berbagai produk elektroreduksi CO 2 untuk produksi 100 t hari −1 . NPV menunjukkan perbedaan antara nilai sekarang dari arus kas masuk dan nilai sekarang dari arus kas keluar selama periode waktu tertentu. NPV yang lebih besar dari 0 menunjukkan bahwa proyek tersebut menguntungkan. Hasilnya menunjukkan bahwa dalam kondisi teknis dan ekonomi saat ini, asam format adalah produk yang layak secara ekonomi, dengan NPV sebesar $39,4 juta ( Gambar 6 a ), yang memposisikan senyawa ini sebagai salah satu produk target RR CO 2 utama. [ 153 ] menggunakan estimasi kebutuhan energi untuk mengevaluasi proses elektroreduksi CO 2 menuju produksi delapan senyawa berbeda. Dapat dilihat dari laporan bahwa energi per kilogram yang dibutuhkan untuk memproduksi berbagai produk bervariasi, dengan format (26,36 kWh kg −1 ) membutuhkan lebih sedikit energi daripada metana (44,63 kWh kg −1 ) dan metanol (44,96 kWh kg −1 ) (Gambar 6b ). Selain mengevaluasi RR CO 2 menggunakan kebutuhan energi, laporan literatur lain mengevaluasi biaya produksi 1 kg format. Gambar 6c menunjukkan biaya elektroreduksi CO 2 menuju produksi format sebagaimana dihitung dari TEA dalam literatur. [ 152 , 154 – 162 ] Harga format saat ini yang dilaporkan dalam literatur yang ada adalah 0,5–1,0 $ kg −1 . [ 41 , 161 ] Seperti yang dapat dilihat dari Gambar 6c , format merupakan produk yang kompetitif dari segi biaya. Biaya produksi format menurut literatur mendekati harga global, dan, dalam kondisi elektrolisis yang optimal, biayanya bahkan bisa lebih rendah dari harga global. [ 152 , 154 – 162 ]

Gambar 6
Buka di penampil gambar
Kekuatan Gambar
a) Nilai sekarang bersih (NPV) untuk produksi berbagai bahan kimia; Dicetak ulang dengan izin dari Ref. [ 152 ] Hak cipta 2018, American Chemical Society. b) Penilaian energetik elektroreduksi CO 2 terhadap berbagai produk; digunakan dengan izin dari Royal Society of Chemistry dari izin Ref. 153 yang disampaikan melalui Copyright Clearance Center, Inc. c) Tinjauan umum biaya elektroreduksi CO 2 terhadap format dari analisis teknoekonomi dalam literatur; [ 152 , 154 – 162 ] area yang diarsir pada gambar menunjukkan harga global.
Penting untuk dicatat bahwa biaya produksi format yang dihitung oleh berbagai laporan literatur sangat bervariasi, yang memerlukan analisis dan evaluasi lebih lanjut dari hasil proses penilaian teknis dan ekonomi. Secara umum, biaya elektrolisis rata-rata produksi format sekitar 1,5 kali harga pasar rata-rata format. Total biaya produksi format biasanya dihitung berdasarkan biaya modal (CapEx) dan biaya operasi (OpEx). CapEx berisi total biaya langsung, total biaya tidak langsung, dan biaya modal tetap, sedangkan OpEx mencakup biaya utilitas, gaji, pemeliharaan, biaya laboratorium, asuransi, dan biaya pakan ( Gambar 7 a,b ). [ 161 ] Dengan menganalisis berbagai biaya investasi dan operasi format menurut laporan literatur yang disebutkan di atas, ditemukan bahwa biaya operasi secara umum lebih tinggi daripada biaya modal. Hal ini terutama disebabkan oleh konsumsi listrik yang diperlukan untuk konversi dan biaya pemisahan format. [ 152 ] De Lunna dkk. [ 155 ] menemukan bahwa harga listrik dan proses pemisahan masing-masing mencakup 65,8% dan 15,9% dari total biaya produksi. Sementara itu, Orella et al. [ 154 ] melaporkan bahwa biaya pemisahan format mencakup sekitar 70% dari total biaya produksi format, sedangkan konsumsi listrik mencakup sekitar 8% dari total biaya produksi format. Alasan untuk perbedaan besar ini dapat dikaitkan dengan penggunaan model perhitungan yang berbeda serta perbedaan dalam parameter lain, misalnya, harga listrik. Meskipun demikian, dapat disimpulkan bahwa konsumsi listrik dan biaya pemisahan asam format merupakan penggerak biaya utama dari biaya operasi (Gambar 7c ).
Gambar 7
Buka di penampil gambar
Kekuatan Gambar
a,b) Rincian biaya modal dan operasional untuk pengurangan CO 2 menjadi format dalam tiga metode berbeda; Dicetak ulang dari Ref. 161 Hak Cipta 2024, dengan izin dari Elsevier. c) Rincian biaya untuk biaya produksi format dengan data dari lima TEA yang dianalisis. [ 152 , 154 – 156 , 161 ]
Perlu dicatat bahwa, dalam kondisi industri, parameter operasi, seperti kerapatan arus, selektivitas, dan voltase, terus berubah, sehingga perlu untuk menganalisis lebih lanjut dampak dari berbagai indikator teknis terhadap biaya format dan mencari tahu apa saja parameter operasi yang bervariasi yang memiliki dampak terbesar pada biaya produksi format. Dengan mengidentifikasi parameter-parameter utama ini, pengendalian biaya dan optimalisasi proses produksi dapat dilakukan dengan lebih akurat, sehingga meningkatkan seluruh efisiensi biaya dari proses elektrolisis. Dalam kasus elektroreduksi CO2 , parameter yang memengaruhi biaya produksi format meliputi laju reaksi (kerapatan arus, CD), konversi single-pass (SP), selektivitas (FE), voltase yang diberikan, biaya dan masa pakai katalis, harga listrik, biaya dan masa pakai elektroliser, dan pajak karbon ( Gambar 8 a,b ). Diamati bahwa mengurangi kerapatan arus menyebabkan peningkatan biaya produksi format, terutama karena kerapatan arus yang rendah memerlukan elektroliser dengan area elektrolisis yang lebih besar, sehingga meningkatkan biaya modal dan operasi. Misalnya, berdasarkan kerapatan arus 140 mA cm −2 , peningkatan kerapatan arus sebesar 50% menyebabkan pengurangan biaya produksi format sebesar 0,28 $ kg −1 , sedangkan penurunan kerapatan arus sebesar 50% menyebabkan peningkatan biaya produksi format yang signifikan sebesar 0,84 $ kg −1 . [ 158 ] Selain itu, selektivitas format yang lebih tinggi (>95%) yang diproduksi melalui elektroreduksi CO 2 mengurangi kerapatan arus total yang dibutuhkan karena HER dihambat. Namun, jika FE dikurangi dari 94 menjadi 75%, biaya produksi format akan meningkat dari 1,16 $ kg −1 menjadi sekitar 1,4 $ kg −1 . Mengurangi tegangan elektroliser dapat menurunkan konsumsi listrik. Misalnya, penurunan tegangan sebesar 0,5 V (dari 3,5 menjadi 3,0 V) mengurangi konsumsi listrik total sebesar 13%. Selain itu, konversi yang lebih tinggi menghasilkan biaya pemisahan yang lebih rendah karena berkurangnya jumlah CO 2 yang tidak terkonversi dalam loop pemisahan, dan akibatnya, mengurangi ukuran perangkat pemisahan. [ 158 ] Fluktuasi harga listrik juga memiliki dampak yang signifikan terhadap biaya produksi, karena proses elektrolisis dan proses non-elektrolisis lainnya (adsorpsi CO 2 , pemisahan produk, dll.) mengonsumsi sejumlah besar listrik, dan peningkatan harga listrik akan secara langsung meningkatkan biaya produksi format. Ketika harga listrik turun dari 0,06 menjadi 0,03 $ kWh −1 , biaya produksi asam format turun dari 1,16 $ kg−1 hingga sekitar 1,04 $ kg −1 . Pada saat yang sama, CapEx dari elektroliser juga merupakan faktor kunci dalam keseluruhan proses. Elektroliser yang efisien dan tahan lama (termasuk bahan elektroda dan membran) dapat mengurangi frekuensi penggantian dan biaya perawatan, sehingga menghemat biaya dalam operasi jangka panjang. Pengurangan langsung dalam biaya per unit area elektroda memiliki efek besar pada total biaya, yang menyoroti pentingnya menggunakan bahan elektroda berbiaya rendah. Misalnya, pengurangan 50% dalam biaya ini dapat mengurangi biaya produksi format dari 1,16 menjadi 0,6 $ kg −1 . [ 158 ] Jouny dan Mustafa et al. [ 152 , 162 ] juga mempelajari dampak indikator teknis seperti rapat arus, laju konversi single-pass, dan FE terhadap format pada biaya produksi format dan menemukan bahwa indikator teknis ini memiliki dampak yang serupa (Gambar 8c ). Kesimpulannya, dengan mempertimbangkan semua parameter operasi ini, strategi produksi aktual pada skala percontohan dan industri dapat dioptimalkan untuk memaksimalkan efektivitas biaya.

Gambar 8
Buka di penampil gambar
Kekuatan Gambar
a) Analisis sensitivitas NPV akhir masa pakai untuk elektroreduksi CO 2 menjadi format. Dicetak ulang dengan izin dari Ref. 152 Hak Cipta 2018, American Chemical Society. b) Penilaian sensitivitas elektroreduksi CO 2 menjadi format (CCM: pengganda biaya modal; FE: efisiensi Faradaic; SP: lintasan tunggal; CD: rapat arus; EC: elektrokimia). Dicetak ulang dengan izin dari Ref. 162 di bawah Lisensi CC BY-NC 4.0. c) Analisis sensitivitas berbagai parameter elektroreduksi CO 2 terhadap biaya produksi format. Dicetak ulang dari Ref. [ 161 ] Hak Cipta 2024, dengan izin dari Elsevier.
Konsumsi listrik merupakan faktor penting yang mendominasi harga produksi format dari proses elektrolisis. Total energi yang diperlukan untuk proses elektrolisis ditentukan oleh jumlah energi katoda dan anoda (yaitu, overpotensial) yang diperlukan untuk setiap setengah reaksi. Dalam konteks ini, penerapan reaksi anoda dengan kebutuhan energi yang lebih rendah daripada OER diharapkan memiliki dampak yang kuat pada keseluruhan kebutuhan energi dari keseluruhan proses elektrolisis. [ 163 , 164 ] Oleh karena itu, alat TEA telah digunakan untuk mengeksplorasi penggabungan elektroreduksi CO 2 dengan reaksi anoda alternatif. [ 165 – 167 ] Lebih jauh lagi, menggabungkan elektroreduksi CO 2 khususnya dengan elektrooksidasi alkohol dan gula dapat membawa manfaat ekonomi yang cukup besar. Misalnya, Verma et al. [ 24 ] menemukan elektroreduksi CO 2 dan elektrooksidasi gliserol menjadi sistem gabungan yang menjanjikan, mengurangi konsumsi listrik hingga 53% dibandingkan dengan menggunakan OER sebagai reaksi anoda. Pada saat yang sama, format diperoleh sebagai produk dari elektrooksidasi gliserol, yang selanjutnya meningkatkan efisiensi ekonomi dari keseluruhan proses. Demikian pula, Junqueira et al. [ 168 ] menunjukkan bahwa kombinasi CO 2 RR dengan elektrooksidasi gliserol meningkatkan efisiensi energi. Dibandingkan dengan sistem CO 2 RR//OER, efisiensi energi CO 2 RR//GOR 41% lebih tinggi. Selain itu, Xie et al. [ 166 ] melaporkan sistem elektrolisis berpasangan yang melibatkan elektroreduksi CO 2 dan elektrooksidasi glukosa. Dalam studi ini, ditemukan bahwa, dibandingkan dengan laporan literatur terkini yang menggunakan OER sebagai reaksi anoda, kerapatan energi sistem berpasangan CO 2 RR dan elektrooksidasi glukosa berkurang dari 485 menjadi 262 GJ ton −1 , penurunan sekitar 46%. Elektron digunakan dalam reaksi katode dan anoda, yang memungkinkan pembentukan dua produk bernilai tambah dengan konsumsi energi yang sama, sehingga meningkatkan nilai produk per kilowatt-jam hampir 4 kali lipat. [ 167 ] Berdasarkan penilaian awal di atas, dapat dilihat bahwa elektroreduksi CO 2 yang digabungkan dengan proses elektrooksidasi alkohol/gula masih menarik secara ekonomi dalam hal pengurangan biaya berdasarkan data eksperimen yang ada, dan strategi ini kompatibel dengan elektroliser dan katalis yang paling efisien saat ini. Na et al. [ 37] menggunakan kerangka kerja sintesis proses yang sepenuhnya otomatis untuk menghitung ekonomi dari 16 reaksi katoda (elektroreduksi CO 2 terhadap berbagai produk, dan HER) dan 18 reaksi anoda (elektrooksidasi senyawa organik, dan OER) yang digabungkan satu sama lain. Hasilnya menunjukkan bahwa indeks profitabilitas bergantung pada jenis reaksi elektrooksidasi dan bukan pada jenis elektroreduksi CO 2 .
Laporan yang ada menekankan bahwa elektrooksidasi alkohol dan gula, menggantikan OER, dapat mengurangi potensi proses reaksi elektrokimia dan meningkatkan efisiensi energi. Pada saat yang sama, beberapa literatur telah melaporkan elektrooksidasi alkohol/gula yang digabungkan dengan HER untuk mengeksplorasi efek parameter operasi yang berbeda pada proses anodik. [ 169 – 172 ] Misalnya, Mitsos et al. [ 173 ] menunjukkan bahwa, karena potensi termodinamika elektrooksidasi gliserol lebih rendah daripada OER, melakukan GOR sebagai pengganti OER dapat mengurangi hingga 50% konsumsi energi dari proses elektrolisis untuk menghasilkan hidrogen. Selain itu, dari GOR, produk lain yang mahal secara komersial (seperti asam gliserat dan dihidroksiaseton) dapat diperoleh, yang membuatnya lebih menguntungkan secara ekonomi daripada menghasilkan O 2 . Pada tahun 2024, Khan et al. [ 172 ] menghitung ekonomi dari proses produksi asam format dari elektrooksidasi gliserol yang digabungkan dengan HER dalam lingkungan alkali. Hasil penelitian menunjukkan bahwa dalam elektrolit alkali, langkah pengasaman asam sulfat lebih lanjut diperlukan untuk mendapatkan produk asam format murni selama GOR. Jika K 2 SO 4 yang diperoleh dalam proses pengasaman dijual sebagai produk sampingan, biaya produksi asam format adalah 1,57 $ kg −1 , yang secara signifikan lebih tinggi dari harga pasar 1,0 $ kg −1 . Biaya tinggi terutama dikaitkan dengan biaya pemisahan asam format, yang mencakup sekitar 66% dari total biaya modal. Selain itu, konsumsi listrik dari pemisahan produk asam format juga mencakup 68% dari total konsumsi listrik. Untuk mengurangi biaya produksi asam format, analisis sensitivitas digunakan untuk mengeksplorasi dampak dari berbagai parameter operasi pada biaya produk elektrooksidasi gliserol menjadi format. Hasil penelitian menunjukkan bahwa pengurangan tegangan, peningkatan selektivitas, peningkatan rapat arus, pengurangan biaya KOH, dan peningkatan biaya K2SO4 dapat secara efektif mengurangi biaya produksi asam format . Misalnya, ketika selektivitas asam format meningkat dari 50 menjadi 75%, output produk K2SO4 dan asam format akan meningkat sesuai dengan itu , yang pada akhirnya mengurangi biaya produksi asam format dari 1,57 menjadi 1,2 $kg − 1 . Lebih jauh, biaya produksi asam format dari GOR mirip dengan CO2 .RR menjadi asam format. Keduanya dipengaruhi oleh interaksi berbagai parameter seperti kondisi operasi, konsumsi listrik, harga bahan baku, dan nilai produk sampingan. Singkatnya, dengan memasangkan dua reaksi elektrokatalitik, produk format bernilai tambah dapat diproduksi di kedua sisi dan sistem keseluruhan memerlukan potensi yang lebih rendah, yang dapat secara signifikan mengurangi konsumsi energi dan akhirnya menjadi sistem yang layak secara ekonomi, asalkan kepadatan arus, konversi tinggi, dan selektivitas tinggi tercapai.
3.2 Penilaian Kinerja Lingkungan
CO 2 RR berkontribusi untuk mengekang kenaikan konsentrasi CO 2 di atmosfer, baik dengan memanfaatkan CO 2 yang sudah ada di atmosfer atau dengan mencegah emisi CO 2 lebih lanjut dari proses industri. Oleh karena itu penting untuk mempertimbangkan dampak lingkungan dari proses yang digabungkan di samping penilaian ekonomis. Penilaian siklus hidup (LCA) adalah pendekatan sistematis yang memungkinkan penilaian dampak lingkungan dari produk format sepanjang seluruh siklus hidupnya, dari sumber bahan baku dan produksi, hingga penggunaan dan pembuangan akhir. Oleh karena itu, studi LCA dari proses elektroreduksi CO 2 sering kali mencakup kategori dampak lingkungan yang terkait dengan pemanasan global. [ 174 – 176 ] Meskipun emisi gas rumah kaca dari elektroreduksi CO 2 menjadi produk format yang dilaporkan dalam literatur yang ada sangat bervariasi, dari 32 hingga 519 kg CO 2 per kg format, nilai-nilai tersebut umumnya jauh lebih tinggi daripada yang ditemukan untuk proses produksi format komersial (3,1 kg CO 2 per kg format). [ 140 ] Salah satu faktor penting yang memengaruhi hal ini adalah asal listrik yang digunakan untuk proses elektrolisis, yang sangat berbeda jika didasarkan pada bahan bakar fosil atau sumber energi terbarukan. Misalnya, De Luna et al. [ 155 ] melaporkan bahwa GWI dari CO 2 RR untuk memproduksi format yang ditenagai dengan energi terbarukan hanya 2,0 CO 2 per kg format pada kapasitas pembangkit listrik 500 MW. Sementara itu, Thonemann et al. [ 177 ] menemukan bahwa, dibandingkan dengan produksi format tradisional, proses yang sama dalam kondisi skala industri yang optimal memiliki dampak lingkungan yang lebih kecil sekitar −0,4 kg CO 2 per kg format ( Gambar 9 a ).
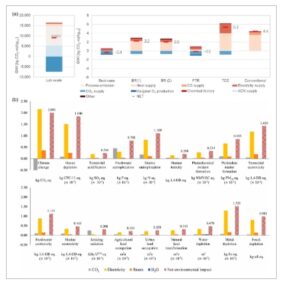
Gambar 9
Buka di penampil gambar
Kekuatan Gambar
a) Analisis dampak pemanasan global (GWI) dari proses skala lab, upscaled, dan konvensional untuk produksi 1 kg format (85 wt%); BR(1): reaktor batch menggunakan rektifikasi konvensional; BR(2): reaktor batch menggunakan rektifikasi ekstraktif dengan benzyl format; FTR: reaktor aliran-melalui; TCC: sel tiga kompartemen. Dicetak ulang dengan izin dari Ref. 177 Hak Cipta 2019, American Chemical Society. b) Dampak lingkungan dari elektroreduksi CO 2 menjadi format. Dicetak ulang dari Ref. 178 Hak Cipta 2021, dengan izin dari Elsevier.
Selain mempertimbangkan dampak pada perubahan iklim, Kang et al. [ 178 ] juga mempertimbangkan evaluasi 18 indikator lingkungan selama elektroreduksi CO 2 menjadi format. Hasil evaluasi menunjukkan bahwa proses ini memiliki dampak kecil pada semua faktor dampak lingkungan (seperti, pengasaman terestrial, eutropikasi air tawar, eutropikasi laut, dll.), kecuali ekotoksisitas terestrial (Gambar 9b ). Listrik menyumbang 83% dari total ekotoksisitas terestrial dalam proses elektrokimia CO 2 RR menjadi format. Oleh karena itu, sumber listrik dapat menjadi hambatan untuk dampak lingkungan, yang akan sangat dikurangi dengan menggunakan sumber listrik terbarukan. Dampak lingkungan dari listrik yang digunakan dalam produksi elektrokimia format dari CO 2 ditentukan dengan memilih sumber listrik yang berbeda (misalnya, minyak, gas alam atau tenaga air). Dibandingkan dengan gas alam, minyak sebagai sumber listrik menunjukkan tingkat pertumbuhan tertinggi di sebagian besar kategori dampak (minimum: 27,8% dalam penipisan logam, dan maksimum: 954,4% dalam pengasaman terestrial), sementara tenaga air menunjukkan tingkat pertumbuhan terendah (minimum: -14,1% dalam radiasi pengion, dan maksimum: -107,1% dalam perubahan iklim). Lebih jauh, Paulillo et al. [ 149 ] melakukan LCA dari elektroreduksi CO2 menjadi format dalam elektrolit cairan ionik. Hasilnya menunjukkan bahwa laju pemulihan elektrolit (cairan ionik, asetonitril dan air) sangat mempengaruhi dampak lingkungan dari keseluruhan proses. Ketika laju pemulihan elektrolit adalah 95%, dampak lingkungan dari proses elektroreduksi adalah 2,5 hingga 50 kali lipat dari proses tradisional. Namun, ketika laju pemulihan ditingkatkan, kinerja lingkungan meningkat secara signifikan. Ketika laju pemulihan proses ditingkatkan menjadi 99%, proses menjadi kompetitif secara lingkungan dibandingkan dengan rute tradisional.
Ada laporan tentang penilaian lingkungan dari elektrooksidasi alkohol dan gula. Misalnya, Regalado-Méndez et al. [ 179 ] menggunakan energi fosil sebagai sumber daya dan membandingkan OER dengan elektrooksidasi gliserol. Dalam kasus yang pertama, GWI terkait adalah 29,54 kg CO 2 per kg H 2 , sementara mengintegrasikan elektrooksidasi gliserol sebagai proses anoda mengurangi nilai ini menjadi 23,04 kg CO 2 per kg H 2 . GWI dari GOR menggunakan bahan bakar fosil dan fotovoltaik surya sebagai sumber daya juga dibandingkan. Jika energi surya digunakan sebagai sumber daya, GWI hanya 1,81 kg CO 2 per kg H 2 , penurunan 92,1%. Ditemukan juga bahwa proses elektrooksidasi gliserol memengaruhi MAE (ekotoksisitas perairan laut) dan ADP (bahan bakar fosil), terutama karena konsumsi energi fosil sebagai listrik. Oleh karena itu, dapat disimpulkan bahwa untuk mengurangi dampak terhadap lingkungan, penggunaan energi tak terbarukan harus dihindari sebisa mungkin. Dampak lingkungan dari elektrooksidasi alkohol dan gula serta CO 2 RR harus dipertimbangkan dalam penelitian mendatang, yang juga dapat membantu meningkatkan dampak lingkungan lebih lanjut.
4 Ringkasan dan Prospek
Elektroreduksi CO2 yang layak menjadi produk bernilai tambah, termasuk format/asam format, sangat dibutuhkan untuk mengatasi masalah pemanasan global, sehingga mencari rute alternatif yang ramah lingkungan untuk memanfaatkan senyawa ini. Pada saat yang sama, untuk meningkatkan efisiensi energi dari proses elektrolisis ini, menggabungkan elektroreduksi CO2 dengan reaksi elektrooksidasi alternatif untuk OER konvensional, khususnya elektrooksidasi alkohol dan gula, yang dapat berasal dari biomassa, memungkinkan produksi format di katode dan anoda dengan persyaratan dan biaya masukan energi yang berkurang. Dalam tinjauan ini, kami memberikan tinjauan sistematis tentang kemajuan terkini elektroreduksi CO2 yang digabungkan dengan elektrooksidasi alkohol dan gula menuju produksi format dan mengevaluasi literatur yang ada tentang aspek teknis, ekonomi, dan lingkungan dari proses (yang digabungkan). Meskipun sistem elektroreduksi CO2 konvensional ( dengan OER sebagai proses anoda) telah dipelajari secara luas selama bertahun-tahun, sistem elektrolisis yang digabungkan merupakan area penelitian baru yang sedang berkembang, dan masih banyak tantangan yang harus diatasi. Beberapa tantangan yang harus dipecahkan di masa depan dirangkum sebagai berikut.
4.1 Desain Elektrokatalis yang Efisien.
Katalis memainkan peran penting dalam kinerja sistem elektrokimia, yang secara langsung memengaruhi efisiensi reaksi, stabilitas, dan selektivitas produk. Kepadatan dan stabilitas situs aktif dapat ditingkatkan dengan merancang katalis multimetalik berstruktur nano atau paduan. Secara khusus, katoda berbasis Bi dan Sn serta anoda berbasis Ni dan Co dapat dioptimalkan lebih lanjut untuk meningkatkan kinerja dua reaksi setengah (CO 2 RR dan elektrooksidasi alkohol/gula, masing-masing), yang menargetkan selektivitas format di atas 90%, kerapatan arus lebih tinggi dari 200 mA cm −2 , dan konversi CO 2 single-pass lebih tinggi dari 50%. Kami merekomendasikan kombinasi analisis in-situ/online, khususnya spektroelektrokimia, dengan simulasi komputasional, yang dapat menjadi alat yang berguna untuk memantau dan menjelaskan perubahan yang dialami katalis selama reaksi, dan selanjutnya dapat mengungkapkan mekanisme reaksi, serta evolusi katalis dan kinerjanya dalam operasi. Pada saat yang sama, desain katalis yang secara khusus cocok untuk sistem yang digabungkan sangat penting untuk memastikan bahwa kedua elektroda dapat beroperasi dalam kondisi yang kompatibel (misalnya, pH, laju aliran, tegangan, geometri sel, dll.) dengan stabilitas jangka panjang yang memadai. Selain itu, penerapan skala industri juga perlu mempertimbangkan desain katalis yang sangat aktif dan berbiaya rendah berdasarkan bahan yang melimpah, mudah diakses, dan dapat ditingkatkan.
4.2 Konfigurasi Elektroliser dan Integrasi Sistem untuk Sistem Elektrokimia Kopel.
Mengoptimalkan konfigurasi sel aliran untuk memastikan stabilitas proses elektrolisis berpasangan merupakan masalah yang mendesak dan menantang yang perlu ditangani dalam pekerjaan mendatang. Penggunaan membran harus dipertimbangkan secara komprehensif berdasarkan persyaratan produksi format tertentu. Kami mengidentifikasi area peluang, termasuk mengeksplorasi efek sinergis dari lingkungan pH yang berbeda pada reduksi CO2 dan oksidasi alkohol/gula, dan mempelajari peran membran bipolar atau membran pertukaran ion selektif dalam mengurangi migrasi produk sampingan antara anoda dan katoda. Selain itu, sementara stabilitas sistem berpasangan yang ada telah dilaporkan untuk periode hingga 100 jam, pengoptimalan lebih lanjut diperlukan untuk mencapai stabilitas reaksi untuk periode yang lebih lama, yang pada gilirannya memerlukan pemahaman mendalam tentang mekanisme penonaktifan seperti keracunan, korosi, penggumpalan partikel, dan perubahan morfologi. Lebih jauh, penting untuk mempertimbangkan bahwa pemisahan produk format memiliki dampak substansial pada kelayakan ekonomi proses elektrolisis, dan dengan demikian desain dan pengembangan lebih lanjut dari metode pemisahan yang efisien dan berenergi rendah sangat dibutuhkan. Pada saat yang sama, interaksi antara teknologi elektrolisis berpasangan dan pasokan energi terbarukan harus dieksplorasi secara mendalam. Mempertimbangkan peningkatan proporsi energi terbarukan seperti energi surya dan angin dalam pasokan energi secara keseluruhan, jika biaya listrik dari energi terbarukan kurang dari 0,04 $ kW h −1 dan efisiensi konversi energi mencapai 70%, biaya produksi asam format dapat kurang dari 0,1 $ kg −1 . Terakhir, sistem elektrolisis berpasangan mungkin perlu memiliki fleksibilitas operasional yang lebih tinggi untuk beradaptasi dengan perubahan dinamis dalam harga listrik dan secara efektif mengelola biaya yang berubah seiring waktu.
4.3 Mengoptimalkan Aspek Ekonomi dan Lingkungan dari Sistem Kopel.
Karena efisiensi katalitik yang tidak memadai, efisiensi konversi energi yang tidak memadai, tingkat pemanfaatan CO 2 yang rendah , dan biaya operasional yang tinggi, biaya teknis sistem elektrolisis berpasangan saat ini masih sangat tinggi. Elektroreduksi CO 2 menjadi format tidak dapat mencapai manfaat lingkungan di luar proses konvensional di bawah struktur energi yang ada dan belum mencapai industrialisasi skala besar. Para peneliti harus menggunakan metode TEA untuk mengoptimalkan proses reaksi dan proses pemisahan produk, sehingga memungkinkan untuk mengidentifikasi rute potensial untuk mengurangi biaya. Disarankan juga untuk melakukan analisis biaya-manfaat terperinci dari sistem berpasangan untuk mengoptimalkan aliran proses dan selanjutnya mengurangi biaya produksi dan pemisahan. Analisis tersebut harus mencakup perbandingan dengan standar industri saat ini sebagai tolok ukur untuk penilaian yang lebih memadai terhadap daya saing proses dan teknologi yang baru muncul ini. Akhirnya, mengembangkan bahan kimia dan material yang lebih ramah lingkungan dan dapat didaur ulang untuk mengurangi dampak terhadap lingkungan, melakukan penilaian siklus hidup yang komprehensif untuk mengevaluasi dampak lingkungan dari proses berpasangan, dan mengoptimalkan seluruh sistem elektrolisis berpasangan juga direkomendasikan.
Secara keseluruhan, sistem elektrolisis yang terdiri dari elektroreduksi CO2 dan elektrooksidasi alkohol dan gula berbasis bio untuk menghasilkan format memiliki potensi besar untuk aplikasi industri. Namun, untuk mencapai implementasi sistem ini dalam skala besar, masih perlu mengatasi tantangan yang disebutkan di atas dalam pengembangan katalis dan desain sel elektrolit serta mengembangkan pemahaman tentang mekanisme reaksi. Lebih jauh, keramahan lingkungan dan integrasi sistem juga harus dipertimbangkan disertai dengan biaya-manfaat dan TEA. Dengan kemajuan teknologi yang berkelanjutan dan pengurangan biaya, sistem elektrokatalitik terintegrasi diharapkan dapat dikomersialkan di masa mendatang dan berkontribusi pada pengembangan energi hijau yang berkelanjutan.
