Perancangan dan Validasi Nanopartikel Polimer-Lipid Hibrida sebagai Vektor Transfeksi Baru untuk Pengiriman MikroRNA ke Fibroblas Jantung Manusia
Abstrak
Nanopartikel polimer-lipid hibrida (NP hibrida) dikembangkan sebagai vektor transfeksi in vitro baru untuk pengiriman mikroRNA (miRNA) guna mengatasi stabilitas yang buruk, efisiensi pemuatan yang tidak lengkap, dan kinetika pelepasan yang cepat dari agen transfeksi komersial. NP hibrida dengan ukuran nanometrik disiapkan dengan metode nanopresipitasi hasil tinggi yang dapat diskalakan. Mereka terdiri dari inti lipoplex, yang terdiri dari lipid kationik [2-(2,3-didodecyloxypropyl)-hydroxyethyl] ammonium bromide (DE) dan lipid pembantu dioleoyl phosphatidylethanolamine (DOPE), yang menyediakan pemuatan miRNA sebesar 99%, dan cangkang poli(asam laktat- ko- asam glikolat) (PLGA), yang memastikan stabilitas koloid NP dan kinetika pelepasan miRNA yang terkendali. Fibroblas jantung manusia dewasa (AHCF), yang ditransfeksi sementara dengan NP hibrida yang dimuat miR-1 versus RNAiMAX menunjukkan viabilitas yang lebih unggul dan kandungan miRNA yang lebih tinggi selama 48 jam. NP hibrida dapat disimpan hingga 14 hari pada suhu -20 °C, setelah dikeringkan beku dengan krioprotektan trehalosa (12% b/v), mendapatkan kembali sifat fisikokimia dan biologisnya saat didispersikan kembali. NP hibrida dinilai dalam model miRcombo dari pemrograman ulang fibroblas menjadi kardiomiosit. Pada 15 hari pascatransfeksi dengan miRNA pemrograman ulang (miRcombo: miRs-1, 133, 208 dan 499), ekspresi penanda troponin T jantung meningkat secara signifikan pada tingkat gen dan protein. Hasil ini membuka jalan bagi penggunaan NP hibrida sebagai vektor transfeksi untuk pengujian miRNA in vitro yang menargetkan AHCF.
1 Pendahuluan
MikroRNA (miRNA) adalah RNA non-coding kecil (panjangnya 21–24 nukleotida) yang mengatur ekspresi gen pada tingkat pasca-transkripsi, [ 1 ] dalam beberapa proses fisiologis dan patologis, termasuk perkembangan kanker dan regenerasi jaringan. [ 2 – 10 ] Ekspresi miRNA endogen dapat ditingkatkan oleh mimik miRNA untai ganda, atau dihambat oleh oligonukleotida anti-miRNA untai tunggal (AMO). [ 4 ] Studi praklinis in vitro dan in vivo pada terapi berbasis miRNA baru sebagian besar dilakukan dengan menggunakan vektor virus, seperti vektor adeno-associated (AAV), retroviral (RV), dan lentiviral (LV). [ 8 , 11 – 14 ] Meskipun efisiensi transfeksinya tinggi, vektor virus dibatasi oleh masalah keamanan dan biaya tinggi. Penelitian praklinis mengenai terapi miRNA baru dapat memperoleh manfaat dari nanocarrier bermuatan miRNA yang aman dan efisien, yang mampu melindungi miRNA dari degradasi dan meningkatkan penyerapannya oleh sel. [ 8 , 15 , 16 ] Sejauh ini, sebagian besar reagen transfeksi didasarkan pada lipid atau polimer kationik, yang mampu merakit diri menjadi nanokompleks dalam kehadiran miRNA bermuatan negatif, membentuk lipoplex atau poliplex, masing-masing. [ 17 – 25 ] Berbagai macam lipid kationik, seperti [2-(2,3-didodecyloxypropyl)-hydroxyethyl] ammonium bromide (DE), [ 5 , 26 – 30 ] N-[1-(2,3-dioleyloxy) propyl-N,N,N-trimethylammonium chloride (DOTMA) dan 1,2-dioleoyl-3-trimethylammonium-propane (DOTAP) telah digunakan untuk membentuk lipoplex. [ 31 , 32 ] Muatan positif dari gugus amino kuartener dari lipid kationik bertanggung jawab atas interaksi elektrostatiknya dengan asam nukleat bermuatan negatif, yang mengarah pada pembentukan lipoplex dengan efisiensi pemuatan yang tinggi. [ 31 ] Contohnya termasuk lipoplex yang terbentuk dari Lipofectamine komersial dan turunannya (misalnya, Lipofectamine 3000, Lipofectamine 2000, Lipofectamine RNAiMAX, dan Lipofectin). [ 17 – 21 , 23 , 25 , 33 ] Di antara ini, Lipofectamine RNAiMAX banyak digunakan untuk pengiriman miRNA dan small interfering RNA (siRNA) ke sel yang berbeda, termasuk kardiomiosit (CM). [ 13 , 20 , 21 , 23] Reagen lain yang tersedia secara komersial berdasarkan lipid kationik untuk pengiriman miRNA in vitro, termasuk DharmaFECT (Dharmacon), [ 2 , 5 , 7 , 34 , 35 ] SiPORT (Invitrogen), [ 36 ] SilentFect (Bio-Rad) [ 37 ] dan INTERFERin (Polyplus). [ 38 – 42 ] Reagen transfeksi komersial ini telah menunjukkan efisiensi pemuatan dan transfeksi yang tinggi yang bervariasi tergantung pada jenis sel. Namun, lipoplex kationik dibatasi oleh ukuran rata-rata yang tinggi (seringkali > 1 µm) dan distribusi ukuran yang luas, sitotoksisitas, dan stabilitas rendah dalam media fisiologis, yang berpotensi menyebabkan pelepasan miRNA sebelum internalisasi sel. [ 13 , 17 , 19 ] Reagen transfeksi berdasarkan polimer kationik, seperti poli(etilenaimina) (PEI) dan kitosan, telah diusulkan sebagai alternatif lipid kationik untuk menghasilkan polipleks. [ 24 , 25 , 31 , 43 ] Polipleks PEI telah terbukti mampu membungkus oligonukleotida secara efisien dan melepaskannya secara efisien dalam sitoplasma sel melalui pelepasan endosomal yang dimediasi oleh efek spons proton. [ 31 ] Salah satu contoh reagen transfeksi PEI yang tersedia secara komersial adalah jetPEI dari Polyplus. [ 24 ] Namun, polipleks PEI dibatasi oleh sifat tidak terdegradasi dan sitotoksisitas. [ 32 ] Kitosan juga telah digunakan untuk menyiapkan nanopartikel (NP) bermuatan miRNA, karena muatan positifnya pada pH sedikit asam (< pKa ≈6,3), biokompatibilitas, dan biodegradabilitas. [ 31 , 43 , 44 ] Namun, preparasi polipleks kitosan pada pH asam dapat menyebabkan degradasi miRNA parsial dan mengurangi stabilitas polipleks dalam darah. Selain polimer kationik hidrofilik, poli(asam laktat- ko- asam glikolat) (PLGA) telah digunakan secara luas untuk penghantaran obat karena stabilitasnya dalam media fisiologis, biodegradabilitas, biokompatibilitas, dan kemampuan lolos endosomal. [ 45 , 46 ] Namun, NP PLGA mengalami pemuatan molekul hidrofilik yang buruk, seperti oligonukleotida (misalnya, miRNA dan siRNA). [ 47 ] Untuk meningkatkan pemuatan oligonukleotida, NP hibrida berdasarkan PLGA dan polimer kationik atau lipid telah diusulkan.[ 43 , 48 – 54 ] PLGA NP yang dilapisi dengan polimer kationik (misalnya, PEI atau kitosan), [ 44 , 48 – 50 , 52 , 53 ] atau lipid (misalnya, DOTAP atau DOTMA) [ 44 , 55 ] telah disiapkan dengan metode emulsi tunggal minyak dalam air (o/w) atau dengan nanopresipitasi. Reagen transfeksi berdasarkan PLGA NP berlapis PEI juga tersedia secara komersial (DiagPoly PEI PLGA), siap untuk dikomplekskan dengan oligonukleotida oleh pengguna. Namun, PLGA NP yang dilapisi dengan polimer kationik atau lipid mengalami keterbatasan stabilitas dalam kondisi fisiologis dan masalah sitotoksisitas, karena muatan permukaannya yang positif. [ 46 ] Sebagai alternatif, NP PLGA yang membungkus lipoplex atau poliplex telah disiapkan dengan metode emulsi ganda air dalam minyak dalam air (w/o/w). [ 46 ] Partikel-partikel ini memiliki inti lipoplex atau poliplex, yang memberikan efisiensi pemuatan miRNA yang tinggi, sementara cangkang PLGA memberikan stabilitas dalam kondisi fisiologis, dan pelepasan muatan yang terkontrol dan berkelanjutan. [ 45 ] Sayangnya, keterbatasan inheren dari metode emulsi ganda, termasuk kompleksitas, permintaan waktu, hasil rendah, penggunaan surfaktan yang berpotensi beracun, dan efisiensi enkapsulasi yang buruk, telah membatasi penerapan NP ini sebagai reagen transfeksi untuk aplikasi penelitian yang luas. [ 55 ] Untuk mengatasi keterbatasan tersebut, kami merancang NP hibrida baru dengan inti lipoplex dan cangkang PLGA, dengan metode nanopresipitasi yang sederhana, mudah digunakan, hasil tinggi, dan dapat diskalakan, mengusulkan penggunaannya sebagai vektor transfeksi miRNA baru untuk penggunaan penelitian, dengan fokus pada aplikasinya untuk pengobatan regeneratif jantung. [ 45 ] Lipoplex yang dimuat miRNA berdasarkan lipid kationik (DE) dan lipid pembantu (dioleoyl phosphatidylethanolamine, DOPE) pertama kali disiapkan dengan interaksi elektrostatik sederhana dalam air. Dalam pekerjaan kami sebelumnya, lipoplex DE-DOPE/miRNA ditemukan memiliki efisiensi pemuatan miRNA (LE) ≈100%, pelepasan miRNA yang cepat dan lengkap dalam waktu 24 jam, kemampuan transfeksi yang tinggi, dan biokompatibilitas, dan untuk memicu pemrograman ulang fibroblas jantung manusia dewasa (AHCF) yang efisien menjadi CM yang diinduksi saat memberikan miRcombo (iCM). [ 5 , 10 ] Di sini, larutan PLGA diendapkan secara nano pada dispersi lipoplex DE-DOPE/miRNA, [ 45 ]memperoleh NP hibrida NP hibrida yang dihasilkan menggabungkan pemuatan miRNA tinggi dari lipoplex DE-DOPE/miRNA dengan stabilitas struktural dan kemampuan pelepasan terkendali dari NP PLGA. [ 5 – 10 , 15 , 16 , 45 ] NP hibrida dikarakterisasi secara menyeluruh untuk sifat fisikokimia dan biologinya untuk pengiriman miRNA ke AHCF, dibandingkan dengan Lipofectamine RNAiMAX (RNAiMAX), salah satu agen transfeksi lipid komersial miRNA dan siRNA yang paling relevan. Bukti konsep aplikasi NP hibrida untuk transfeksi AHCF ditunjukkan dengan menggunakan miRNA tunggal (miR-1) dan kombinasi miRNA pemrograman ulang (miRcombo: miR-1-3p, miR-133a-3p, miR-208a-3p, miR-499a-5p). Hasilnya menunjukkan pemrograman ulang langsung AHCF yang dimediasi miRcombo yang efisien menuju iCM memberikan bukti konsep yang andal untuk penerapan NP hibrida sebagai reagen transfeksi untuk penggunaan penelitian. 2 Hasil 2.1 Sifat Fisikokimia NP Hibrida NP hibrida yang dimuat MiRNA disiapkan dengan pendekatan nanopresipitasi satu langkah, yang diadaptasi dari protokol yang dilaporkan sebelumnya. [ 52 ] Seperti yang diilustrasikan secara skematis pada Gambar 1a dan dilaporkan pada Gambar S1 ( Informasi Pendukung), berbagai jumlah larutan PLGA dalam aseton (kisaran 16–127 µg) diteteskan ke dalam fase air yang terdiri dari dispersi lipoplex DE-DOPE/miRNA yang dioptimalkan sebelumnya [ 5 ] (rasio amino terhadap fosfat – N/P – 3). Dengan meningkatkan kandungan PLGA (% b/b) dalam NP hibrida dari 70 menjadi 95% b/b, diameter hidrodinamik rata-rata, potensial Z, dan indeks polidispersitas (PDI) dari NP hibrida yang dihasilkan menurun (Gambar S1 dan Tabel S1 , Informasi pendukung). Khususnya, hanya NP hibrida dengan kandungan PLGA > 80% yang menunjukkan ukuran hidrodinamik < 200 nm yang merupakan nilai ambang batas yang memungkinkan sterilisasi dengan filtrasi mekanis. Dalam kisaran komposisi ini, NP hibrida dengan kandungan PLGA 95% b/b dalam NP hibrida yang dihasilkan dipilih untuk karakterisasi lebih lanjut, dengan mempertimbangkan ukuran hidrodinamik terendah (160 ± 36 nm), dikombinasikan dengan potensial Z negatif (−28 ± 2 mV), PDI yang relatif rendah (0,27 ± 0,05) (Gambar S1 dan Tabel S1 , Informasi Pendukung) dan persentase efisiensi pemuatan (LE) yang tinggi (99 ± 0,01%). Berbagai jenis oligonukleotida (kontrol negmiR, miR-1, miRcombo, Cy5-siRNA) dimuat ke dalam NP hibrida untuk tujuan karakterisasi.
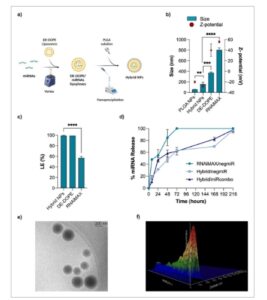
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Sifat fisikokimia NP hibrida: a) Ilustrasi skema protokol nanopresipitasi untuk persiapan NP hibrida. Dibuat dengan Biorender. b) Ukuran dan potensi Z dari NP PLGA kontrol (NP PLGA), NP hibrida, dan RNAiMAX, diukur dengan DLS. NegmiR dimuat sebagai miRNA model. c) Efisiensi pemuatan NegmiR (LE) diukur dengan uji kuantifikasi fluorometrik Qubit untuk NP hibrida dibandingkan dengan RNAiMAX. d) Profil pelepasan negmiR dan miRcombo dari NP hibrida dan negmiR dari NP RNAiMAX sebagai fungsi waktu inkubasinya (24, 48, 72, dan 168 jam) dalam PBS pada suhu 37 °C dalam kondisi dinamis. Data dinyatakan sebagai mean ± SD. NegmiR dimuat sebagai miRNA model. Analisis statistik dilakukan dengan ANOVA 1 arah. e) Gambar Cryo-TEM representatif dari NP hibrida. f) Gambar topografi 3D NP hibrida melalui analisis NTA. Data dinyatakan sebagai mean ± SD. Analisis statistik dilakukan dengan uji- t dua sisi .
Sifat fisikokimia NP hibrida dianalisis dan dibandingkan dengan lipoplex DE-DOPE/miRNA kontrol [ 5 ] dan NP RNAiMAX yang dimuat dengan NP negmiR dan PLGA, miRNA non-enkapsulasi (Gambar 1b ; Tabel S2 , Informasi Pendukung). Diameter hidrodinamik NP hibrida yang dimuat negmiR lebih tinggi daripada NP PLGA (160 ± 36 nm vs 59 ± 1 nm, p = 0,0083), sementara lebih rendah daripada lipoplex DE-DOPE/miRNA (372 ± 18 nm), [ 5 ] yang dikaitkan dengan komposisi hibrida lipid polimer (Gambar 1b ; Tabel S1 dan S2 , Informasi Pendukung). Nilai potensial Z negatif serupa diukur untuk PLGA NP dan NP hibrida (masing-masing -28 ± 2 dan -20 ± 2 mV), sementara lipoplex DE-DOPE/miRNA menunjukkan potensial Z positif (40 ± 12 mV; Gambar 1b ; Tabel S1 dan S2 , Informasi Pendukung). [ 5 ] NP hibrida menunjukkan distribusi ukuran monodispersi (Tabel S1 dan S2 , Informasi Pendukung) dengan PDI 0,27 ± 0,05, lebih tinggi daripada NP PLGA (0,11 ± 0,02). [ 5 ] Dibandingkan dengan NP hibrida, NP RNAiMAX komersial menunjukkan diameter hidrodinamik yang lebih tinggi sebesar 806 ± 37 nm (nilai-p < 0,0001), PDI yang lebih tinggi sebesar 0,34 ± 0,02, dan potensi-Z positif sebesar 56 ± 2 mV (Gambar 1b ; Tabel S2 , Informasi Pendukung). LE NP hibrida yang dimuat negmiR adalah 99% ± 1, secara signifikan lebih tinggi dibandingkan dengan NP RNAiMAX (57% ± 3, p < 0,0001) (Gambar 1c ). NP PLGA kontrol tidak memuat negmiR (data tidak dilaporkan dalam Gambar 1c ).
Hibrida NP yang dimuat NegmiR dan miRcombo menunjukkan kinetika pelepasan terkendali dan berkelanjutan yang serupa dalam larutan garam penyangga fosfat (PBS) pada suhu 37 °C dalam kondisi dinamis, mencapai pelepasan miRNA sekitar 50% setelah 48 jam dan 100% setelah 9 hari (Gambar 1d ). Sebaliknya, RNAiMAX NP yang dimuat negmiR menunjukkan kinetika pelepasan yang lebih cepat dalam kondisi yang sama, mencapai pelepasan miRNA 85% pada 48 jam dan pelepasan miRNA lengkap pada 72 jam.
Selain itu, analisis morfologi NP hibrida, yang dilakukan dengan Cryogenic Transmission Electron Microscopy (Cryo-TEM), menunjukkan bahwa NP hibrida memiliki bentuk bulat dan ukuran rata-rata yang sesuai dengan data dari analisis Dynamic Light Scattering (DLS), tidak membentuk agregat dan menampilkan inti yang lebih padat elektron dan kulit luar yang kurang padat, yang menunjukkan adanya struktur inti-kulit (Gambar 1e ). Nanoparticle Tracking Analysis (NTA) mengonfirmasi ukuran NP hibrida (Gambar 1f ) dan memungkinkan pengukuran konsentrasi suspensi NP hibrida, yang menghasilkan 2,14 × 10 11 partikel/mL. Hasil produksi NP hibrida, dihitung sebagai berat NP yang diproduksi yang dirujuk atas berat bahan awal, menunjukkan nilai tinggi 97 ± 1%.
Metode formulasi yang sama digunakan untuk menyiapkan NP hibrida yang dimuat dengan Cy5-siRNA, miR-1, dan miRcombo. NP hibrida yang dihasilkan menunjukkan diameter hidrodinamik, PDI, dan potensi Z yang serupa dibandingkan dengan NP hibrida yang dimuat negmiR yang dikarakterisasi sebelumnya ( Gambar 2a ; Tabel S3 , Informasi Pendukung).
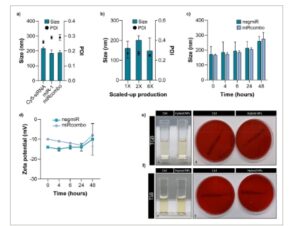
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Sifat fisikokimia NP hibrida yang diinkubasi dalam media berbeda, skalabilitas proses produksi, dan sterilitas NP hibrida. a) Diameter hidrodinamik dan PDI NP hibrida yang dimuat dengan oligonukleotida berbeda (Cy5-siRNA, miR-1, dan miRcombo) diukur dengan DLS. b) Diameter hidrodinamik dan PDI NP hibrida yang disiapkan menggunakan volume 1, 2, dan 8X dan diukur dengan DLS. c,d) Studi stabilitas pada suhu fisiologis dalam DMEM+FBS dengan mengukur: ukuran hidrodinamik (c) dan potensial Z (d) NP hibrida sebagai fungsi waktu inkubasinya (0, 4, 6, 24, dan 48 jam). e,f) Analisis kontaminasi mikroba NP hibrida yang baru disiapkan yang dimuat negmiR yang disimpan dalam TBG pada suhu 37 °C (e) dan TSB pada suhu 25 °C (f) selama 14 hari. Pada kedua gambar f,g) gambar di sebelah kiri menunjukkan penilaian kekeruhan melalui inspeksi visual (yaitu, kuvet dengan kaldu bening yang menunjukkan tidak adanya kontaminasi mikroba), sedangkan gambar di sebelah kanan menunjukkan tidak adanya CFU pada pelat padat agar. Sampel kontrol (Ctrl) adalah TGB dan TSB tanpa NP hibrida. Data dinyatakan sebagai mean ± SD. Analisis statistik dilakukan dengan uji- t dua sisi .
Skalabilitas proses produksi NP hibrida menggunakan volume hingga 8 kali lipat (8X) lebih tinggi kemudian ditunjukkan berdasarkan sifat DLS dan nilai LE yang serupa (Gambar 2b ; Tabel S4 , Informasi Pendukung).
2.2 Karakterisasi Fisikokimia NP Hibrida yang Diinkubasi dalam Media Berbeda pada Suhu Fisiologis
Stabilitas NP hibrida yang dimuat negmiR dan miRcombo dievaluasi lembur hingga 48 jam pada 37 °C, menggunakan media yang berbeda (yaitu, air Milli-Q dan PBS pada pH 7,4 Gambar S2 dan Tabel S5 (Informasi Pendukung) dan Dulbecco Modified Eagle Medium yang disuplemen dengan 10% Fetal Bovine Serum, DMEM+FBS Gambar 2c,d ). NP hibrida yang diinkubasi dalam air Milli-Q menunjukkan diameter hidrodinamik, potensial Z, dan PDI yang stabil. Perilaku serupa diamati untuk NP hibrida yang diinkubasi dalam PBS, dengan sedikit peningkatan yang tidak signifikan pada diameter hidrodinamik, PDI, dan potensial Z setelah 48 jam (Gambar S2 dan Tabel S5 , Informasi Pendukung). Inkubasi dalam DMEM+FBS tidak menyebabkan perubahan signifikan dalam ukuran, diameter hidrodinamik, dan PDI dari NP hibrida yang dimuat negmiR dan miRcombo hingga 24 jam (Gambar 2c,d ; Tabel S5 , Informasi Pendukung). Khususnya, potensi Z dari NP hibrida dalam DMEM+FBS sedikit lebih tinggi daripada dalam air Milli-Q (yaitu, masing-masing ≈−14 vs −24 mV), mungkin karena pembentukan korona protein. Peningkatan yang sedikit tetapi tidak signifikan dalam ukuran hidrodinamik rata-rata dan potensi Z dari NP hibrida yang dimuat negmiR dan miRcombo diamati setelah inkubasi 48 jam dalam DMEM+FBS (Gambar 2c,d ; Tabel S5 , Informasi Pendukung), dikaitkan dengan penyerapan protein serum. Nilai PDI tidak berubah secara signifikan selama inkubasi dalam DMEM+FBS hingga 48 jam (0,25–0,26) yang menunjukkan stabilitas koloid yang baik untuk NP hibrida yang dimuat negmiR dan miRcombo, yang penting untuk penggunaannya sebagai reagen transfeksi in vitro.
Berikutnya, kami menyelidiki apakah metode penyiapan NP hibrida dapat menjaga sterilitas NP. Tidak adanya kontaminasi mikroba pada NP hibrida yang dimuat negmiR diselidiki melalui metode inokulasi langsung dengan mengkultur sampel dalam Kaldu Triptik-Kedelai (TSB, untuk bakteri aerobik) pada suhu 25 °C dan Kaldu Tioglikolat (TGB, untuk bakteri anaerobik) pada suhu 37 °C selama 14 hari. Setelah 1, 7, dan 14 hari inkubasi, tidak ada pertumbuhan bakteri yang terdeteksi pada kedua kaldu melalui analisis kekeruhan, melalui inspeksi visual dan evaluasi kurangnya absorbansi pada 457, 490, dan 600 nm (data tidak dilaporkan), dan melalui analisis Unit Pembentuk Koloni (CFU) (Gambar 2e,f ), yang menunjukkan sterilitas NP hibrida.
2.3 Karakterisasi Sel In Vitro dari NP Hibrida yang Dimuat miRNA: Penyerapan In Vitro, Efisiensi Transfeksi dan Bukti Konsep Pemrograman Ulang Langsung AHCF
Uji sel in vitro dilakukan menggunakan AHCF. AHCF diinkubasi dengan NP hibrida yang dimuat Cy5-siRNA dan NP RNAiMAX selama 24 jam, untuk mengevaluasi penyerapan sel. Analisis flow cytometry, yang dilakukan pada 24 dan 48 jam mengungkapkan bahwa 100% AHCF positif untuk Cy5-siRNA (% dari sel Cy5-siRNA + ) ( Gambar 3 a, b ). Intensitas fluoresensi rata-rata (MFI) Cy5-siRNA dalam sel serupa untuk AHCF yang diobati dengan NP hibrida atau RNAiMAX setelah 24 jam, sementara MFI yang secara signifikan lebih rendah tercatat untuk AHCF yang diobati dengan NP RNAiMAX setelah 48 jam ( nilai- p = 0,003, Gambar 3c ). Penyerapan NP hibrida yang dimuat Cy5-siRNA yang efisien juga dikonfirmasi oleh analisis mikroskopi konfokal, yang menunjukkan sinyal Cy5-siRNA fluoresensi di dalam sitoplasma sel setelah 24 jam (Gambar 3d ). Kemampuan NP hibrida untuk memastikan pelepasan endosom/lisosom Cy5-siRNA juga ditentukan. AHCF diinkubasi dengan Cy5-siRNA yang dimuat dalam NP hibrida dan NP RNAiMAX selama 24 jam. Gambar konfokal mengungkapkan bahwa sinyal fluoresensi miRNA yang tersebar dalam sitoplasma pada 24 jam diamati, dengan sedikit kolokalisasi endosom/lisosom (Gambar S3.1 , Informasi Pendukung). Koefisien korelasi Pearson (PCC) dilakukan untuk menilai tingkat kolokalisasi antara lisosom dan NP yang dimuat Cy5-siRNA. Hasilnya menunjukkan kolokalisasi rendah untuk NP RNAiMAX (0,35 ± 0,13) dan NP hibrida (0,39 ± 0,03) pada 24 jam pasca-transfeksi, yang menunjukkan bahwa kedua formulasi menunjukkan pelepasan lisosom yang efisien (Gambar S3.1 , Informasi Pendukung). Tidak ada penurunan signifikan dalam viabilitas sel yang diamati setelah 24 jam pengobatan AHCF dengan berbagai konsentrasi NP hibrida ( Tabel 1 ), sementara sel yang ditransfeksi dengan NP RNAiMAX yang disiapkan mengikuti petunjuk pabrik, menunjukkan penurunan viabilitas sebesar 70% ( nilai- p <0,0001, Gambar 3e ). Hasil menunjukkan biokompatibilitas yang lebih unggul dan kemampuan penyerapan sel dari NP hibrida yang dimuat miRNA, dibandingkan dengan transfektan komersial RNAiMAX. Untuk mempelajari apakah NP hibrida dapat menginduksi ekspresi sitokin pro-inflamasi, kami menganalisis ekspresi Interleukin-6 (IL-6) pada 24 jam pasca-transfeksi. Meskipun transfeksi DE-DOPE/negmiR secara signifikan meningkatkan ekspresi IL-6 dibandingkan dengan sel kontrol, cangkang PLGA yang ada dalam NP hibrida mampu memulihkan tingkat ekspresi IL-6 seperti pada sel kontrol dan sel yang ditransfeksi dengan RNAiMAX (Gambar S3.2 , Informasi Pendukung). Efisiensi transfeksi NP hibrida yang dimuat dengan miR-1 dan negmiR dipelajari dengan mengukur ekspresi mRNA Twinfilin-1 (TWF-1) (yang mewakili target mRNA untuk miR-1) di AHCF dengan PCR digital tetesan (ddPCR). [ 5 – 10 ]AHCF yang diobati dengan NP hibrida yang dimuat dengan miR-1 secara efisien menginduksi penurunan regulasi TWF-1 (p = 0,0006), menunjukkan hampir 25% ekspresi mRNA dibandingkan dengan NP hibrida yang dimuat negmiR (Gambar 3f ). AHCF juga diobati dengan NP hibrida yang dimuat dengan miRcombo (kombinasi empat miRNA), yang mampu langsung memprogram ulang AHCF menjadi kardiomiosit yang diinduksi (iCM). [ 2 , 3 , 5 , 7 , 10 ] Ekspresi tinggi mRNA TNT2 diukur untuk AHCF yang diobati dengan miRcombo dibandingkan dengan NP hibrida yang dimuat negmiR ( nilai- p = 0,0001, Gambar 3g ). Analisis flow cytometry dilakukan untuk mengukur sel cTnT+ sebagai indeks efisiensi reprograming langsung AHCF menjadi iCM. Persentase ≈11% sel cTnT+ diukur untuk sel yang diobati dengan NP hibrida yang dimuat miRcombo, sedangkan sel tidak mengekspresikan cTnT saat diobati dengan NP hibrida yang dimuat negmiR ( nilai- p < 0,0001, Gambar 3h,i ).
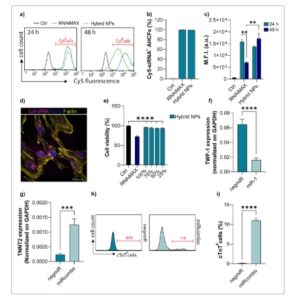
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
NP hibrida menunjukkan penyerapan yang efisien, pelepasan miRNA, dan regulasi ekspresi gen dalam AHCF. a) Analisis flow cytometry representatif yang menunjukkan penyerapan seluler NP hibrida dan RNAiMAX yang dimuat dengan Cy5-siRNA dalam AHCF setelah 24 dan 48 jam pengobatan. b) Grafik batang yang menunjukkan persentase sel positif Cy5-siRNA (sel Cy5-siRNA + ) setelah 24 jam pengobatan dengan NP hibrida dan RNAiMAX. c) MFI setelah 24 jam dan 48 jam pengobatan dengan NP hibrida dan RNAiMAX. Sel yang tidak diobati digunakan sebagai kontrol untuk semua percobaan. d) Gambar mikroskop fluoresensi representatif yang menunjukkan penyerapan Cy5-siRNA (magenta) oleh AHCF, dimediasi oleh NP hibrida setelah 24 jam pengobatan. Nukleus diwarnai tandingan dengan DAPI (biru) dan F-actin dengan Phalloidin (kuning). Skala batang = 50 µm. e) Viabilitas AHCF yang diobati dengan NP hibrida yang dimuat negmiR dan NP RNAiMAX pada 24 jam. NP hibrida diuji pada empat konsentrasi: 100, 75, 50, dan 25 (%) (Tabel 1 ). Viabilitas sel dianalisis dengan uji resazurin. Viabilitas AHCF yang ditransfeksi dinormalisasi dengan AHCF yang tidak ditransfeksi. f) Ekspresi gen target mRNA TWF-1 dalam AHCF yang diobati dengan NP hibrida yang dimuat negmiR atau miR-1 pada 48 jam, dianalisis dengan ddPCR. g) Ekspresi gen mRNA TNNT2 dalam AHCF yang diobati dengan NP hibrida yang dimuat negmiR atau miRcombo setelah 15 hari kultur pasca-perlakuan, dianalisis dengan ddPCR. h,i) Plot aliran representatif (h) dan persentase (i) sel cTnT+ untuk AHCF yang diobati dengan negmiR atau miRcombo menggunakan NP hibrida setelah 15 hari kultur. Data yang dilaporkan adalah nilai rata-rata ± SEM dari tiga eksperimen independen. Perbedaan statistik antara kelompok ditentukan oleh uji-t dua sisi .
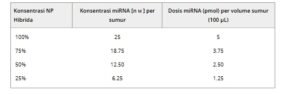
Tabel 1. Dosis miRNA yang diberikan melalui NP hibrida pada pengenceran berbeda untuk studi sitokompatibilitas dan sitotoksisitas in vitro.
2.4 Penyimpanan Jangka Panjang NP Hibrida Tanpa Perubahan Sifat Fisikokimia, Fungsional dan Sterilitas
Stabilitas fisik jangka panjang NP hibrida yang dimuat dengan negmiR dan miRcombo dipelajari dengan mengukur diameter hidrodinamik, PDI, dan potensi Z setelah inkubasinya dalam air bebas RNase pada suhu 4 °C selama 0, 7, 14, 21, dan 28 hari ( Gambar 4 a,b ; Tabel S6 , Informasi Pendukung). Diameter hidrodinamik stabil dari waktu ke waktu untuk NP hibrida yang dimuat negmiR (136–166 nm) dan miRcombo (171–185 nm). Nilai potensi Z dan PDI negatif (Tabel S6 , Informasi Pendukung) tidak bervariasi selama 4 minggu untuk NP hibrida yang dimuat negmiR dan miRcombo. Kemudian, efisiensi transfeksi NP hibrida yang dimuat miR-1 setelah penyimpanannya pada suhu 4 °C pada titik waktu yang berbeda (0 jam, 48 jam, 7, dan 14 hari) dievaluasi dalam AHCF dengan menganalisis ekspresi TWF-1 dengan ddPCR. Penurunan regulasi TWF-1 diukur dalam semua kondisi yang diuji (Gambar S3.3 , Informasi Pendukung) dibandingkan dengan NP hibrida yang dimuat negmiR, yang mengonfirmasi kemampuan NP hibrida untuk mempertahankan aktivitas biologis miRNA hingga 14 hari inkubasi dalam air bebas RNase pada suhu 4 ° C. Namun, NP hibrida yang baru disiapkan menunjukkan penurunan regulasi mRNA TWF-1 yang lebih tinggi dibandingkan dengan NP hibrida yang disimpan selama 7 dan 14 hari pada suhu 4 °C ( nilai p = 0,0002 dan 0,0015, berturut-turut). Oleh karena itu, menyimpan NP hibrida dalam suspensi pada suhu 4 °C ternyata bukan metode yang cocok untuk penyimpanan jangka panjangnya. Untuk alasan ini, metode pembekuan dan pengeringan beku dipelajari sebagai metode jangka panjang alternatif dengan tujuan untuk mengawetkan karakteristik fisikokimia dan aktivitas miRNA dari NP hibrida. [ 56 ] NP hibrida, awalnya dibekukan pada −80 °C, kemudian dicairkan dan disuspensikan kembali, menunjukkan peningkatan ukuran yang signifikan, mencapai 811 nm (Gambar 4c ), tanpa perubahan pada potensial Z (Gambar 4c ) dan PDI (Tabel S7 , Informasi Pendukung). Untuk meningkatkan stabilitas dan mengurangi pertambahan ukuran selama proses pembekuan, trehalosa ditambahkan sebagai krioprotektan. [ 57 – 60 ] Karena proses pengeringan menyebabkan destabilisasi tambahan, metode pengeringan beku pertama-tama dievaluasi sebagai metode penyimpanan jangka panjang dengan mengoptimalkan konsentrasi trehalosa dan kemudian, pembekuan dinilai sebagai pendekatan pengawetan lainnya. [ 56 , 61 ]
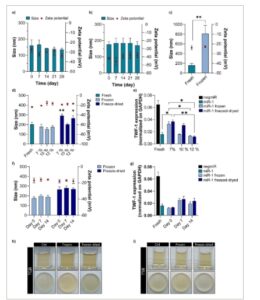
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Analisis stabilitas dan kontaminasi mikroba dari NP hibrida dalam kondisi penyimpanan. a,b) Diameter hidrodinamik dan potensi Z dari NP hibrida yang disimpan dalam suspensi air bebas RNase pada suhu 4 °C yang membungkus (a) negmiR dan (b) miRcombo yang dievaluasi dari waktu ke waktu (0, 7, 14, 21, dan 28 hari). c) Diameter hidrodinamik dan potensi Z dari NP hibrida beku yang dimuat dengan negmiR dibandingkan dengan NP hibrida segar. Analisis statistik dilakukan dengan uji- t dua sisi . d) Diameter hidrodinamik dan potensi Z dari NP hibrida beku dan kering beku dengan konsentrasi trehalosa yang berbeda (7, 10, dan 12% b/v) dibandingkan dengan NP hibrida segar. e) Ekspresi gen target mRNA TWF-1 (dinormalkan pada GAPDH) dalam AHCF yang ditransfeksi dengan negmiR atau miR-1 menggunakan NP hibrida segar, beku, dan beku-kering dengan berbagai konsentrasi trehalosa (7, 10, dan 12% b/v). Ekspresi gen dianalisis pada 48 jam pasca-transfeksi dengan ddPCR. f) Diameter hidrodinamik dan potensi Z NP hibrida beku dan beku-kering dengan 12% b/v trehalosa dievaluasi dari waktu ke waktu (0, 7, dan 14 hari). g) Ekspresi gen target mRNA TWF-1 dalam AHCF yang ditransfeksi dengan negmiR atau miR-1 menggunakan NP hibrida beku dan beku-kering dengan 12% b/v trehalosa setelah 0, 7, dan 14 hari penyimpanan dibandingkan dengan NP hibrida segar. Ekspresi gen dianalisis pada 48 jam pasca-transfeksi dengan ddPCR. h,i) Analisis kontaminasi mikroba pada hibrida negmiR beku dan kering yang disimpan selama 14 hari yang dikultur dalam TBG pada suhu 37 °C (h) dan TSB pada suhu 25 °C (i) selama 14 hari. Pada kedua gambar, gambar di atas menunjukkan penilaian kekeruhan (yaitu, kuvet dengan kaldu bening yang menunjukkan tidak adanya kontaminasi mikroba), sedangkan gambar di bawah menunjukkan tidak adanya CFU pada pelat padat agar. Sampel Ctrl adalah TGB dan TSB tanpa hibrida NP, masing-masing. Untuk karakterisasi hibrida fisikokimia, data dinyatakan sebagai mean ± SD dari tiga eksperimen independen. Analisis statistik dilakukan dengan ANOVA 1 arah, kecuali dinyatakan lain dalam teks. Untuk studi sel in vitro, data dinyatakan sebagai mean ± SEM dari tiga eksperimen independen. Analisis statistik dilakukan dengan uji-t dua sisi.
NP hibrida yang dimuat NegmiR dikeringkan beku dengan adanya berbagai konsentrasi trehalosa (2,5, 5, 7, 10, 12, 13, 15, dan 18% b/v) didispersikan kembali dalam air bebas RNase dan dikarakterisasi berdasarkan ukuran hidrodinamik dan potensi Z-nya (Gambar S4 , Informasi Pendukung). Diameter hidrodinamik NP hibrida yang direhidrasi setelah pengeringan beku dengan trehalosa 0% dan 10% b/v, dibandingkan dengan NP yang baru disiapkan, ditemukan bergantung pada jumlah krioprotektan. Memang, konsentrasi trehalosa yang terbatas (yaitu, hingga 7% b/v) atau berlebihan (yaitu, > 12% b/v) tidak dapat mempertahankan ukuran hidrodinamik NP hibrida yang direhidrasi (Gambar S4 , Informasi Pendukung). Peningkatan jumlah krioprotektan juga meningkatkan nilai Z-potensial, karena muatan positif trehalosa yang menutupi permukaan NP hibrida (Gambar S4 , Informasi Pendukung). Tidak ada variasi dalam nilai PDI yang diamati sebagai fungsi dosis krioprotektan (Tabel S8 , Informasi Pendukung). Berdasarkan data ini, konsentrasi trehalosa dari 7 hingga 12% b/v dipilih untuk metode pembekuan dan studi in vitro.
NP hibrida dengan 7, 10, dan 12% b/v trehalosa mempertahankan sifat fisikokimianya setelah proses pembekuan dan pengeringan beku diikuti dengan rekonstitusi suspensi NP dibandingkan dengan NP yang baru disiapkan (Gambar 4d ; Tabel S8 dan S9 , Informasi Pendukung). AHCF menunjukkan sitokompatibilitas tinggi setelah pengobatan dengan NP hibrida, yang sebelumnya dibekukan atau dikeringkan beku selama 24 jam dengan adanya 7, 10, dan 12% b/v trehalosa (Gambar S5a , Informasi Pendukung). Di sisi lain, konsentrasi trehalosa dan adopsi pengobatan pembekuan atau pengeringan beku ditemukan memengaruhi aktivitas miR-1 dan penurunan regulasi TWF-1. Secara khusus, AHCF diinkubasi selama 24 jam dengan NP hibrida yang dimuat miR-1, dilarutkan setelah pembekuan atau pengeringan beku dengan 12% b/v trehalosa, menunjukkan tingkat penurunan regulasi TWF-1 yang serupa dengan yang dicapai dengan pengobatan dengan NP hibrida segar (Gambar 4e ). Pengobatan AHCF dengan NP hibrida, dilarutkan setelah pembekuan atau pengeringan beku dengan 7 dan 10% b/v trehalosa, menurunkan ekspresi mRNA TWF-1 dibandingkan dengan NP hibrida yang dimuat negmiR ( nilai p = 0,002 dan 0,0001, masing-masing). Namun, tingkat ekspresi mRNA TWF-1 dalam AHCF secara signifikan lebih tinggi setelah perlakuan dengan NP dengan 7% b/v trehalosa ( nilai p = 0,0194) dan sedikit lebih tinggi (meskipun tidak signifikan) setelah perlakuan dengan NP dengan 10% b/v trehalosa, dibandingkan dengan NP yang baru disiapkan dan NP hibrida yang sebelumnya dibekukan atau dikeringkan beku dengan 12% b/v trehalosa. Oleh karena itu, 12% b/v trehalosa dipilih sebagai konsentrasi krioprotektan yang optimal untuk mempertahankan sifat fisikokimia dan aktivitas miRNA NP hibrida selama pembekuan dan pengeringan beku.
Untuk mempelajari apakah penyimpanan jangka panjang dapat memengaruhi sifat-sifat NP, NP hibrida beku dan beku-kering dengan 12% b/v trehalosa disimpan masing-masing pada suhu -80 dan -20 °C selama 7 dan 14 hari. Setelah rekonstitusi suspensi setelah penyimpanan, NP hibrida menunjukkan ukuran hidrodinamik, potensial Z, dan PDI yang tidak berubah (Gambar 4f ; Tabel S10 , Informasi Pendukung), yang menunjukkan pemeliharaan sifat fisikokimia mereka selama penyimpanan. Lebih jauh, AHCF yang diolah dengan NP hibrida beku atau beku-kering, yang direkonstitusi setelah penyimpanan selama 7 dan 14 hari, menunjukkan viabilitas sel 100% (Gambar S5b , Informasi Pendukung). Selain itu, AHCF yang diobati dengan NP hibrida yang dimuat dengan miR-1, direkonstitusi setelah penyimpanan selama 0, 7, dan 14 hari, menunjukkan ekspresi mRNA TWF-1 yang lebih rendah (Gambar 4g ) dibandingkan dengan NP hibrida yang baru disiapkan yang dimuat dengan negmiR ( nilai p = 0,0001) dan ekspresi mRNA TWF-1 yang serupa dibandingkan dengan NP hibrida yang baru disiapkan yang dimuat miR-1.
Akhirnya, sterilitas NP hibrida yang dimuat negmiR juga diselidiki setelah penyimpanan selama 0, 7, dan 14 hari, baik dalam bentuk beku maupun kering beku, dengan mengevaluasi keberadaan kontaminasi mikroba. Pertumbuhan bakteri dipelajari dalam TSB pada suhu 25 °C dan dalam TGB pada suhu 37 °C selama 14 hari dengan pengamatan kekeruhan dan analisis CFU, seperti yang dilakukan sebelumnya untuk NP yang baru disiapkan tanpa krioprotektan (Gambar 2f,g ). Setelah penyimpanan selama 0, 7, dan 14 hari, baik NP hibrida beku maupun beku-kering dengan 12% b/v trehalosa tidak menunjukkan tanda-tanda kontaminasi bakteri setelah inkubasi dalam TSB dan TGB, seperti yang ditunjukkan oleh tidak adanya CFU pada pelat agar dan pengukuran kekeruhan melalui inspeksi visual serta tidak adanya pita absorbansi pada 457, 490, dan 600 nm (data tidak dilaporkan), yang menunjukkan pemeliharaan sterilitasnya selama penyimpanan (Gambar 4h,i ).
3 Diskusi
Dalam karya ini, NP hibrida berbasis lipid (DE-DOPE) dan polimer sintetis (PLGA) dirancang untuk pengiriman miRNA (Gambar 1a ), sebagai vektor transfeksi baru untuk penggunaan penelitian, dengan sifat yang ditingkatkan dibandingkan dengan transfektan lipidik, seperti NP RNAiMAX komersial [ 16 , 32 ] dan DharmaFECT1 [ 2 , 6 , 34 , 35 ] dan lipoplex DE-DOPE yang dioptimalkan sebelumnya. [ 5 ] Memang, dalam karya sebelumnya, kami merumuskan lipoplex DE-DOPE/miRNA (dengan rasio DE:DOPE 50:50 w:w; rasio gugus amino terhadap fosfat – N/P – 3) untuk pengiriman miRNA, menunjukkan diameter hidrodinamik 372 ± 18 nm, potensial Z positif 40 ± 12 mV, PDI 0,29 ± 0,08 dan LE 99%. [ 5 ] Meskipun sangat biokompatibel dan efisien dalam transfeksi sel, lipoplex DE-DOPE/miRNA memiliki stabilitas yang buruk dalam media fisiologis, melepaskan muatannya sepenuhnya dalam inkubasi 24 jam dalam PBS. [ 5 ] Karena stabilitas koloidnya yang terbatas, lipoplex DE-DOPE/miRNA tidak dapat disimpan dalam suspensi setelah persiapan dan memerlukan penggunaan segera yang mirip dengan agen transfeksi komersial berbasis lipid utama. Lebih jauh lagi, mereka tidak dapat dimuat ke dalam hidrogel untuk pelepasan yang terkontrol dan berkelanjutan, karena keruntuhannya yang cepat saat kontak dengan molekul hidrogel (data tidak dilaporkan). Untuk mengatasi keterbatasan tersebut, dalam penelitian ini NP hibrida dengan stabilitas yang ditingkatkan dirancang dengan metode nanopresipitasi sederhana (Gambar 1a ). Sifat kationik lipoplex DE-DOPE (potensial Z 40 ± 12 mV) dan sifat amfifiliknya memungkinkan interaksi yang efisien dengan PLGA. [ 5 , 10 , 50 , 62 ] Memang, PLGA (Resomer RG 752 H), kopolimer biokompatibel dan biodegradabel yang disetujui oleh FDA AS (Food & Drugs Administration), tersusun oleh unit monomer hidrofilik (asam glikolat, 25%) dan hidrofobik (asam laktat, 75%) dan, karena berujung asam karboksil, bermuatan negatif. Karakteristik tersebut mendukung interaksi elektrostatik PLGA dengan lipoplex DE-DOPE. Kandungan PLGA sebesar 95% b/b dipilih untuk preparasi NP hibrida, untuk mendapatkan distribusi permukaan PLGA, seperti yang disarankan oleh potensial Z negatif (−28 ± 2 mV) dibandingkan dengan NP PLGA (miRNA non-enkapsulasi) (Tabel S2 , Informasi Pendukung; Gambar 1b ). Sebaliknya, NP hibrida dengan kandungan PLGA sebesar 70, 75, dan 78% menunjukkan diameter hidrodinamik yang lebih besar yaitu ≈400 nm dan potensi Z netral, yang menunjukkan lapisan PLGA yang tidak lengkap (Gambar S1 dan Tabel 1).S1 , Informasi Pendukung). Analisis krio-TEM dari NP hibrida dengan komposisi terpilih (Gambar 1e ) menunjukkan bentuk bulatnya, tidak adanya agregat, dan keberadaan inti yang lebih padat elektron dibandingkan dengan cangkang luar yang mungkin mendukung hipotesis struktur cangkang PLGA inti lipoplex. Konsentrasi NP hibrida yang dihasilkan yang diukur dengan NTA adalah 2,14 × 10 11 partikel/mL. Sebelumnya, NP hibrida dengan inti lipoplex atau poliplex dan cangkang PLGA hanya diproduksi dengan metode penguapan pelarut emulsi ganda yang rumit dan memakan waktu. [ 44 , 48 – 50 , 53 , 55 , 63 ] Dalam karya ini, nanopresipitasi diusulkan sebagai pendekatan yang sederhana, terukur, mudah digunakan, dan lebih ramah lingkungan, menghindari penggunaan surfaktan yang berpotensi sitotoksik. [ 45 ] Nanopresipitasi adalah proses sederhana, kompatibel untuk persiapan vektor transfeksi untuk penggunaan penelitian. Karakterisasi fisikokimia mendalam dari NP hibrida dilakukan versus Lipofectamine RNAiMAX, agen transfeksi lipid komersial yang banyak digunakan. NP hibrida menunjukkan ukuran yang secara signifikan lebih rendah daripada NP RNAiMAX (160 ± 36 nm vs. 806 ± 37 nm, berturut-turut; Gambar 1b ; Tabel S2 dan S3 , Informasi Pendukung) dan potensial Z negatif versus positif (-28 ± 2 mV vs 56 ± 2 mV, berturut-turut; Gambar 1b ; Tabel S2 dan S3 , Informasi Pendukung). NP hibrida menunjukkan LE yang secara signifikan lebih tinggi daripada NP RNAiMAX (99% ± 1 vs 57% ± 3, Gambar 1c ), yang dikaitkan dengan penggabungan lengkap lipoplex DE-DOPE yang menunjukkan kemampuan pemuatan miRNA yang efisien. [ 5 ] LE dari RNAiMAX NP lebih rendah dan mendekati LE dari NP DharmaFECT komersial (65% ± 1) yang dilaporkan dalam penelitian kami sebelumnya. [ 5 ] Dibandingkan dengan agen transfeksi komersial, pemuatan miRNA yang lebih tinggi dalam NP hibrida dapat mengurangi dosis nanocarrier untuk mendapatkan efek biologis tertentu. Pemuatan miRNA yang lengkap juga menghindari pemborosan molekul miRNA. Selain itu, hasil produksi NP hibrida tinggi (97% ± 1) yang meminimalkan pemborosan miRNA, polimer, dan DE-DOPE, sesuai dengan prinsip keberlanjutan lingkungan. NP hibrida memungkinkan pemuatan miRNA tunggal (seperti miR-1 dan negmiR), oligonukleotida berlabel fluoresensi (Cy5-siRNA), dan kombinasi miRNA (miRcombo) yang mempertahankan sifat fisikokimianya (Gambar 2a ; Tabel S3, Informasi Pendukung). Metode untuk persiapan NP hibrida dapat ditingkatkan hingga 8X untuk eksperimen laboratorium intensif, tanpa perubahan apa pun pada sifat fisikokimia NP hibrida dan LE (Gambar 2b ; Tabel S4 , Informasi Pendukung). Berkat komposisi dan distribusi relatif komponennya, NP hibrida menunjukkan stabilitas tinggi di berbagai media, seperti air Milli-Q, PBS, dan DMEM+FBS, pada suhu 37 °C selama 48 jam (Gambar 2c,d ; Gambar S2 dan Tabel S5 , Informasi Pendukung). Hanya peningkatan yang sedikit tetapi tidak signifikan dalam diameter hidrodinamik rata-rata dan potensi Z dari NP hibrida yang dimuat negmiR dan miRcombo diukur setelah inkubasi dalam PBS (Gambar S2 dan Tabel S5 , Informasi Pendukung) dan DMEM+FBS (Gambar 2c,d ; Tabel S5 , Informasi Pendukung) setelah 48 jam, dikaitkan dengan interaksi dengan spesies ionik dan protein serum, masing-masing. Nilai PDI (0,25–0,26) tidak berubah selama inkubasi dalam DMEM+FBS hingga 48 jam, menunjukkan stabilitas koloid yang baik untuk NP hibrida, penting untuk penggunaannya sebagai vektor transfeksi in vitro. Sebaliknya, percobaan sebelumnya telah menunjukkan bahwa lipoplexes DE-DOPE/miRNA dan DharmaFECT NP mempertahankan ukuran stabil dan potensi Z hanya hingga inkubasi 6 dan 24 jam dalam air Milli-Q pada 37 °C, [ 5 ] pembongkaran dalam inkubasi 6–24 dan 24–48 jam dalam air Milli-Q, masing-masing. Stabilitas superior NP hibrida dalam media sederhana (air Milli-Q) dan media kompleks (PBS dan DMEM+FBS) dibandingkan dengan lipoplexes diharapkan untuk membatasi pelepasan miRNA dalam waktu sebelum NP diinternalisasi oleh sel dan menghasilkan pelepasan miRNA intraseluler yang lebih efisien. Hipotesis ini didukung oleh percobaan kinetika pelepasan miRNA in vitro. Memang pengiriman miRNA in vitro dari NP hibrida dikontrol dan dipertahankan hingga 9 hari inkubasi dalam PBS dalam kondisi dinamis (Gambar 1d ). Sebaliknya, RNAiMAX NP dikarakterisasi oleh kinetika pelepasan miRNA yang lebih cepat dalam kondisi dinamis, mencapai 85% pelepasan miRNA setelah 48 jam dan pelepasan miRNA lengkap pada 72 jam.
Kondisi penyimpanan optimal NP hibrida diteliti untuk mendukung penggunaannya dalam studi penelitian praklinis. Karena stabilitas koloidnya yang buruk, NP lipid tidak dapat disimpan dalam suspensi air pada suhu rendah karena cenderung cepat hancur atau teragregasi. [ 56 , 64 ] Sebaliknya, NP hibrida dapat disimpan dalam suspensi air pada suhu 4 °C hingga 4 minggu dengan tetap menjaga sifat fisikokimianya (Gambar 4a,b ). Namun, efisiensi transfeksinya hanya dipertahankan untuk waktu inkubasi yang singkat, hingga 48 jam (Gambar S3.3 , Informasi Pendukung). Temuan ini menunjukkan bahwa NP hibrida dapat disimpan dalam suspensi berbasis air pada suhu 4 °C dalam jangka pendek (< 48 jam) setelah persiapannya (Gambar S3.3 , Informasi Pendukung). Untuk penyimpanan NP hibrida jangka panjang, metode pembekuan dan pengeringan beku diteliti sebagai pilihan yang lebih baik. [ 56 , 61 , 64 ] Untuk menghindari kemungkinan fenomena penggumpalan NP selama pembekuan (Gambar 4c ) dan pengeringan beku, krioprotektan dan lioprotektan telah dimanfaatkan. [ 64 – 66 ] Beberapa penelitian telah menunjukkan bahwa trehalosa adalah krioprotektan yang optimal, mampu menstabilkan berbagai jenis nanopartikel secara efisien, termasuk yang berbasis PLGA. [ 57 – 60 ] Konsentrasi krioprotektan adalah parameter penting untuk stabilisasi NP: konsentrasi minimum diperlukan untuk menstabilkan sifat fisikokimia NP, [ 60 , 67 , 68 ] sementara konsentrasi yang melebihi ambang batas dapat mengganggu kestabilan NP. [ 58 , 60 ] Dalam penelitian ini, konsentrasi trehalosa ≤ 7% b/v tidak dapat menstabilkan NP hibrida yang dikeringkan beku (Gambar S4 , Informasi Pendukung; Gambar 4d ). Sebaliknya, pada konsentrasi trehalosa > 12% b/v, NP hibrida yang dikeringkan beku menunjukkan peningkatan ukuran yang signifikan secara statistik (Gambar S4 , Informasi Pendukung; Gambar 4d ). Kehadiran trehalosa tidak mengubah sitokompatibilitas NP hibrida (Gambar S5 , Informasi Pendukung), sementara itu memengaruhi efisiensi transfeksi in vitro tergantung pada metode pembekuan atau pengeringan beku yang diterapkan (Gambar 4e ). Karena proses pengeringan menyebabkan destabilisasi tambahan, [ 56 , 61 ]Konsentrasi krioprotektan minimal yang optimal lebih tinggi untuk NP hibrida yang dikeringkan beku (12% b/v) dibandingkan dengan NP hibrida yang dibekukan (10% b/v) (Gambar 4f ). Dengan demikian, konsentrasi trehalosa sebesar 12% b/v dipilih untuk kedua perlakuan dan eksperimen penyimpanan dilakukan. Sifat fisikokimia (Gambar 4f ), biokompatibilitas (Gambar S5 , Informasi Pendukung), efisiensi transfeksi untuk AHCF (Gambar 4g ), dan sterilitas (Gambar 4h,i ) dipertahankan untuk NP hibrida yang direkonstitusi setelah penyimpanan hingga 14 hari. Meskipun metode pembekuan dan pengeringan beku sama-sama cocok untuk penyimpanan NP hibrida jangka panjang, pengeringan beku lebih menguntungkan karena mengurangi volume dan berat sampel dan memungkinkan modulasi mudah konsentrasi suspensi NP yang direkonstitusi setelah penyimpanan. [ 64 , 67 , 69 ]
Akhirnya, NP hibrida dipelajari secara menyeluruh untuk digunakan sebagai vektor transfeksi in vitro untuk pengiriman miRNA ke AHCF dibandingkan dengan NP RNAiMAX. Vektor transfeksi untuk AHCF dibutuhkan dalam beberapa studi praklinis, seperti modulasi fenotipe sel fibrotik yang dimediasi miRNA atau pemrograman ulang sel, misalnya, pemrograman ulang langsung fibroblas menjadi CM. Dikaitkan dengan potensi Z negatifnya, NP hibrida menunjukkan biokompatibilitas yang lebih unggul dibandingkan dengan NP RNAiMAX bermuatan positif (Gambar 3e ) dan NP DharmaFECT yang dilaporkan sebelumnya. [ 5 ] Setelah pengobatan AHCF selama 24 jam dengan NP hibrida atau NP RNAiMAX yang dimuat dengan Cy5-siRNA, 100% sel menginternalisasi oligonukleotida fluoresen dalam sitoplasma sel (Gambar 3a–d ). Namun, intensitas fluoresensi sel yang diobati dengan NP hibrida lebih lanjut sedikit meningkat pada 48 jam, sementara itu menurun secara signifikan setelah pengobatan NP RNAiMAX (Gambar 3c ), yang menunjukkan pengiriman miRNA intraseluler yang berkelanjutan dan terkendali versus burst, masing-masing. Efisiensi transfeksi NP hibrida untuk AHCF ditunjukkan dengan memberikan miR-1, melalui penurunan ekspresi target mRNA TWF-1 (Gambar 3f ) dalam AHCF. Kemanjuran NP hibrida lebih lanjut dinilai dalam model miRcombo dari pemrograman ulang fibroblas menjadi kardiomiosit. Uji bukti konsep pemrograman ulang langsung AHCF menggunakan NP hibrida yang dimuat miRcombo versus yang dimuat negmiR menunjukkan bahwa pengobatan miRcombo menginduksi ekspresi cTnT yang secara signifikan lebih tinggi pada gen ( nilai p = 0,0001, Gambar 3g ) dan tingkat protein (Gambar 3h,i ), setelah kultur 15 hari, menghasilkan efisiensi pemrograman ulang sebesar 11%. Sebagai perspektif masa depan, mencapai pematangan fungsional penuh dari iCM masih merupakan tantangan yang signifikan. [ 15 ] Pendekatan multifaktorial, seperti rekayasa perancah, stimulasi listrik, dan isyarat mekanis anisotropik, akan diperlukan untuk meningkatkan organisasi dan kontraktilitas sarkomer. [ 70 ] Strategi ini dapat membantu mengatasi hambatan yang membatasi pemrograman ulang jantung yang lengkap.
Hasil keseluruhan dari penelitian ini menunjukkan potensi NP hibrida untuk eksploitasi lebih lanjut pada skala industri sebagai vektor transfeksi in vitro baru untuk penggunaan penelitian, dengan hasil bukti konsep untuk transfeksi miRNA AHCF yang efisien. Sebagai perspektif masa depan, NP hibrida dapat mewakili platform yang menjanjikan untuk aplikasi terapi in vivo, dengan meningkatkan stabilitasnya, berkat penambahan polimer anti-fouling seperti PEG, [ 71 ] dan kemampuan penargetan sel dengan melakukan fungsionalisasi permukaan dengan molekul penargetan, seperti menggunakan antibodi atau peptida spesifik organ dan sel. [ 72 ] Tujuannya adalah untuk mengembangkan sistem pengiriman bertarget yang efektif dan aman untuk terapi tingkat lanjut, khususnya di bidang jantung.
4 Kesimpulan
NP hibrida, yang disiapkan dengan metode nanopresipitasi yang baru, mudah digunakan, hasil tinggi, dan dapat diskalakan, dengan ini ditunjukkan sebagai vektor transfeksi yang optimal untuk pengiriman miRNA in vitro, yang menggabungkan miRNA LE lengkap dari lipoplex DE-DOPE dengan stabilitas koloid dan kemampuan pelepasan miRNA yang bertahap dan berkelanjutan dari NP PLGA. NP hibrida mengatasi keterbatasan utama NP lipid kationik, menunjukkan pengiriman miRNA in vitro yang terkendali dan berkelanjutan serta kemampuan penyimpanan jangka panjang setelah pengeringan beku, dengan adanya trehalosa, diikuti oleh pemeliharaan pada suhu -20 °C, memulihkan sifat fisikokimia dan kemampuan transfeksi setelah rehidrasi. AHCF yang diobati dengan NP hibrida, yang dimuat dengan miRNA atau siRNA fluoresen model, menunjukkan viabilitas sel yang lebih tinggi dan internalisasi NP yang efisien dengan tingkat miRNA intraseluler yang tinggi pada 48 jam, dibandingkan dengan transfektan lipidik komersial RNAiMAX. Percobaan pembuktian konsep menunjukkan bahwa NP hibrida mampu mentransfeksi AHCF secara efisien dengan miRNA tunggal dan kombinasi miRNA, seperti miRcombo, yang menginduksi reprograming langsung in vitro awal ke dalam iCM. Fleksibilitas NP hibrida memungkinkan pemanfaatannya untuk transfeksi sel yang berbeda dengan miRNA atau siRNA lain, untuk mempelajari efek terapeutik oligonukleotida pada tingkat praklinis. Skalabilitas, hasil tinggi, ramah lingkungan, dan kesederhanaan metode persiapan, stabilitas koloid suspensi NP hibrida, dan kemampuan penyimpanannya merupakan sifat yang menjanjikan untuk penerapan NP hibrida sebagai vektor transfeksi in vitro baru yang dapat dimanfaatkan pada skala industri.
5 Bagian Eksperimen
Persiapan NP Hibrida dan Kontrol
Liposom DE/DOPE (([2-(2,3-didodecyloxypropyl)-hydroxyethyl] ammonium bromide, DE [ 73 ] dan L-alpha-dioleoyl phosphatidylethanolamine, DOPE, Merck), dalam rasio 1:1 w/w disiapkan menurut metode hidrasi lapisan lipid tipis. [ 5 , 10 ] Secara singkat, lipid kationik DE dan lipid pembantu DOPE dilarutkan secara terpisah dalam kloroform dan dikeringkan di bawah tekanan rendah dalam evaporator putar. Lapisan lipid kering dilarutkan dalam air bebas RNase (Fisher Bioreagents) hingga konsentrasi akhir 1 mg mL −1 dari suspensi liposomal. Lipopleks DE-DOPE/miRNA disiapkan pada rasio molar gugus amino terhadap fosfat (N/P) sama dengan 3, menurut protokol yang dioptimalkan sebelumnya. [ 5 , 10 ] Secara khusus, 10 µL Larutan miRNA (5 µ m ) dan suspensi DE-DOPE 6 µL diinkubasi selama 20 menit pada suhu ruangan, diaduk, lalu diinkubasi pada suhu ruangan selama 20 menit tambahan. Kemudian, lipoplex diencerkan dalam air bebas RNase hingga volume akhir 1 mL. Lipoplex DE-DOPE/miRNA dimuat dengan berbagai oligonukleotida, seperti negmiR (mirVana miRNA Mimic, Kontrol Negatif #1, Life Technologies), miR-1, miRcombo (miR-1-3p, miR-133a-3p, miR-208a-3p, dan miR-499a-5p, mirVana miRNA mimic, Life Technologies) atau Cy5-siRNA (MISSION siRNA Fluorescent Universal Negative Control #1, Cyanine 5, Sigma Aldrich).
NP hibrida yang dimuat dengan oligonukleotida diperoleh melalui nanopresipitasi dengan mengadaptasi protokol yang dilaporkan sebelumnya. [ 52 ] Larutan stok PLGA (Resomer RG 752 H, Poli(D,L-laktida- ko- glikolida) dalam aseton dengan konsentrasi 1 mg mL −1 disiapkan. Kemudian, volume larutan PLGA terpilih sebanyak 127 µL (seperti yang dirinci dalam Gambar S1 , Informasi Pendukung) diteteskan ke dalam 1 mL suspensi lipoplex DE-DOPE/miRNA, di bawah pengadukan magnetik selama 30 menit untuk mendapatkan NP hibrida dengan kandungan PLGA 95% b/b. Setelah penghilangan pelarut di bawah penguapan putar, diperoleh 1 mL suspensi NP hibrida. NP PLGA kontrol, yang tidak membungkus lipoplex yang dimuat miRNA, diperoleh melalui nanopresipitasi larutan PLGA 127 µL dengan konsentrasi 1 mg mL −1 dalam 1 mL air.
Skalabilitas proses penyiapan NP hibrida dinilai dengan menggunakan volume larutan PLGA dan suspensi lipoplex DE-DOPE/miRNA yang 2 dan 8 kali lebih tinggi untuk nanopresipitasi. Setelah aseton dihilangkan dengan penguapan, air bebas RNase ditambahkan untuk mencapai volume akhir konstan 1 mL. NP hibrida dengan konsentrasi 2 dan 8X terhadap formulasi awal (1X) diperoleh (Tabel S4 , Informasi Pendukung).
Lipofectamine RNAiMAX (RNAiMAX, Invitrogen – Life Technologies) disiapkan mengikuti petunjuk pabrik dengan mengencerkan reagen transfeksi dan miRNA (3 µL 10 µ m negmiR, miR-1, miRcombo) atau Cy5-siRNA dalam air bebas RNAse atau media kultur tergantung pada pengujian berikut. Reagen transfeksi dan oligonukleotida dicampur dan diinkubasi selama 5 menit pada suhu ruangan.
Karakterisasi Fisikokimia NP Hibrida—Karakterisasi NP Hibrida dan RNAiMAX
Diameter hidrodinamik, indeks polidispersitas (PDI), dan potensi Z dari NP hibrida yang dimuat dengan berbagai oligonukleotida dan kontrol RNAiMAX dianalisis dengan hamburan cahaya dinamis (DLS) menggunakan Litesizer 500 (Anton Paar). Potensi Z dari NP hibrida dan RNAiMAX dievaluasi menggunakan sel kapiler lipatan berbentuk U (Anton Paar).
Ukuran NP hibrida dan konsentrasi partikel/mL diukur melalui analisis pelacakan nanopartikel (NTA) menggunakan NanoSight LM20 (NanoSight, Amesbury, Inggris). Sampel diencerkan dengan tepat dan dimasukkan ke dalam ruang sampel menggunakan jarum suntik steril. Semua pengukuran dilakukan pada suhu ruangan sebanyak tiga kali.
Efisiensi pemuatan oligonukleotida (LE) dari NP hibrida dan RNAiMAX dievaluasi dengan metode tidak langsung melalui pengukuran konsentrasi oligonukleotida bebas dalam air setelah persiapan NP. LE dari RNAiMAX yang dimuat dengan negmiR dan NP hibrida yang dimuat dengan negmiR, miR-1, Cy5-siRNA, dan miRcombo dianalisis. Secara singkat, NP hibrida dan RNAiMAX disentrifugasi (15000 rpm, 15 menit pada suhu 4 °C) menggunakan sentrifus meja Allegra X 30 (Beckman Coulter). Supernatan dikumpulkan dan dianalisis dengan uji Fluorometer Qubit 4 meja sesuai dengan petunjuk pabrik (MAN0009427-Life Technologies). LE dihitung dengan menggunakan persamaan berikut, Persamaan ( 1 ), sebagai persentase rasio antara perbedaan jumlah awal miRNA yang digunakan untuk persiapan NP dan jumlah miRNA bebas/tidak terbungkus dalam supernatan setelah persiapan NP, dan miRNA awal yang digunakan untuk persiapan NP:
![]()
Karakterisasi Fisikokimia NP Hibrida—Morfologi
Morfologi NP hibrida yang dimuat negmiR dianalisis dengan mikroskop elektron transmisi kriogenik (cryo-TEM), menggunakan mikroskop Philips CM120 di “Centre Technologique des Microstructures” (CTµ) di Université Claude Bernard Lyon 1 (Villeurbanne, Prancis). Suspensi NP hibrida yang diencerkan diteteskan ke dalam film karbon berlubang 300 Mesh (Quantifoil R2/1) dan dibekukan dalam etana cair menggunakan stasiun kerja cryo-plunge (dibuat di Laboratoire de Physique des Solides, LPS di Orsay). Spesimen kemudian dipasang pada dudukan spesimen Gatan 62 yang didinginkan terlebih dahulu dan diamati pada tegangan percepatan 120 kV.
Karakterisasi Fisikokimia NP Hibrida—Hasil Produksi NP Hibrida
Hasil dari proses persiapan NP hibrida dihitung menggunakan Persamaan ( 2 ), sebagai rasio persentase antara berat NP hibrida, diukur setelah 24 jam pengeringan beku suspensi NP akhir, menggunakan Pengering Beku Cool Safe 4–15 L (LaboGene, Lillerød, Denmark), dan berat total komponen awal. Hasil produksi NP hibrida diukur dalam rangkap tiga.
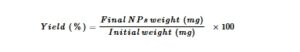
Karakterisasi Fisikokimia NP Hibrida—Studi Stabilitas dalam Berbagai Media
Stabilitas fisik NP hibrida yang dimuat dengan negmiR atau miRcombo dianalisis pada suhu 37 °C dalam air bebas RNase, larutan penyangga fosfat (PBS, Gibco) dan Dulbecco’s Modified Eagle’s Medium High Glucose (DMEM, Gibco) yang disuplemen dengan 10% serum sapi fetal (FBS, Gibco) dengan volume akhir 1 mL. Sampel dikumpulkan pada interval waktu yang telah ditentukan (segera setelah formulasi NP dan pada 4, 6, 24, dan 48 jam). Ukuran hidrodinamik, PDI, dan potensi Z diukur dengan analisis DLS. Semua pengukuran dilakukan dalam rangkap tiga.
Karakterisasi Fisikokimia NP Hibrida—Evaluasi Kinetika Pelepasan miRNA In Vitro
Kinetika pelepasan miRNA in vitro dianalisis untuk NP hibrida yang dimuat dengan negmiR atau miRcombo, diinkubasi pada suhu 37 °C dalam air bebas RNase atau 10 m m PBS dengan volume akhir 1 mL dalam kondisi dinamis pada waktu yang berbeda (24, 48, 72, 168 dan 192 jam). Pada setiap langkah waktu, sampel disentrifugasi (14000 rpm, 15 menit pada suhu 4 °C) menggunakan Fresco 21 Microcentrifuge (Life Technologies, Carlsbad, California, AS) dan 950 µL supernatan dikumpulkan. Untuk analisis, 10 µL supernatan ditambahkan ke 190 µL larutan kerja (diperoleh dengan mengencerkan reagen mikroRNA Qubit dalam buffer mikroRNA Qubit 1:200), dipusarkan dengan cepat, dan dianalisis dengan Fluorometer Qubit 4. Instrumen tersebut memberikan konsentrasi (µg/mL) miRNA bebas yang dilepaskan dalam supernatan pada setiap langkah waktu. Setelah analisis, 950 µL air segar bebas RNase atau PBS ditambahkan ke setiap sampel untuk menggantikan supernatan yang dikeluarkan. Eksperimen dilakukan dalam rangkap tiga. Studi pelepasan miRNA juga dilakukan dengan RNAiMAX sebagai pembanding.
Kultur Sel In Vitro dan Transfeksi
Fibroblas Jantung Manusia Dewasa (AHCF, CC-2903, Lonza) dipelihara dalam kultur menggunakan Cardiac Fibroblasts Growth Medium-3 (CC-4526, Lonza) yang mengandung 10% FBS, 1% insulin, 1% human basal fibroblast growth factor (hFGF-B) dan 1% gentamisin. Sel-sel diperbanyak hingga passage 4 dan kemudian digunakan untuk percobaan. Untuk semua penelitian, AHCF disemai pada 11.000 sel cm −2 dalam DMEM yang dilengkapi dengan 10% FBS dan 1% L-glutamin (Gibco). Setelah 24 jam, sel-sel ditransfeksi seperti yang dijelaskan dalam paragraf berikutnya tergantung pada metode percobaan.
Efisiensi Penyerapan NP Hibrida secara In Vitro oleh Sel
Efisiensi penyerapan NP hibrida oleh AHCF dinilai menggunakan flow cytometry dan mikroskopi fluoresensi setelah 24 jam perawatan. AHCF ditanam dalam pelat 24 sumur pada kepadatan 11.000 sel cm −2 menggunakan medium kultur lengkap 500 µL, atau dalam µ-Slide 18 sumur (Ibidi) menggunakan medium kultur lengkap 100 µL untuk analisis flow cytometry dan mikroskopi konfokal. Setelah 24 jam, sel dirawat dengan NP hibrida yang dimuat dengan Cy5-siRNA selama 24 jam tambahan (pada konsentrasi akhir 25 nm ).
Untuk flow cytometry, sel yang tidak diobati dan sel yang diobati dengan Cy5-siRNA yang dimuat RNAiMAX juga digunakan sebagai kontrol. AHCF dipanen 24 dan 48 jam pasca pengobatan, dicuci dua kali dengan PBS, dan dipisahkan dengan 0,25% b/v asam tripsin/etilendiamintetraasetat (EDTA, Gibco), disentrifugasi dan disuspensikan kembali dalam PBS. Flow cytometry dilakukan dengan menggunakan flow cytometer Guava Easy Cyte (Cytek Biosciences BV) dan dianalisis menggunakan perangkat lunak GuavaSoft 3.2 (Cytek Biosciences BV) untuk memperoleh persentase sel yang positif terhadap Cy5-siRNA (Cy5-siRNA + AHCF) dan Intensitas Fluoresensi Rata-rata (MFI). Eksperimen dilakukan dalam rangkap tiga.
Untuk analisis mikroskopi fluoresensi, 24 jam setelah perlakuan, sel dicuci dua kali dengan PBS dan difiksasi dengan paraformaldehid 4% (Alfa Aesar) selama 10 menit pada suhu ruangan. Nukleus dan sitoskeleton diwarnai dengan 4′,6-diamidino-2-fenilindol dihidroklorida (DAPI, Life Technologies) dan Alexa-555 Phalloidin (Life Technologies) selama 15 menit pada suhu ruangan. Gambar diambil menggunakan mikroskop cakram putar Nikon Eclipse Ti2 dan perangkat lunak NIS-Elements (Nikon). Penggabungan gambar untuk saluran warna yang berbeda dilakukan menggunakan perangkat lunak ImageJ (Fiji).
Uji Sitokompatibilitas dan Sitotoksisitas
AHCF disemai pada kepadatan 11.000 sel cm −2 pada pelat 96-sumur dalam 100 µL media lengkap selama 24 jam. Kemudian, AHCF diobati dengan NP hibrida atau RNAiMAX yang dimuat dengan negmiR selama 24 jam (100 µL). Dalam kasus NP hibrida, berbagai konsentrasi suspensi NP diuji dengan mengencerkan formulasi asli seperti yang dirinci dalam Tabel 1. AHCF yang tidak diobati diinkubasi dengan Lysis Solution (Promega) untuk menginduksi sitotoksisitas sel dan dianggap sebagai kontrol positif untuk analisis sitotoksisitas (toksisitas sel 100%). Media sel ditarik setelah 24 jam dan ditempatkan dalam 96-multiwell dasar bening sisi hitam (Corning). CytoTox-ONE (Promega) ditambahkan ke setiap sumur mengikuti instruksi pabrik untuk mengevaluasi sitotoksisitas.
Untuk uji sitokompatibilitas, sel yang diobati dengan NP selama 24 jam dicuci dengan PBS dan diinkubasi dengan CellTiter-Blue (Promega) dalam medium lengkap selama 3 jam pada suhu 37 °C. AHCF yang tidak diobati juga diinkubasi dengan medium yang mengandung CellTiter-Blue dan digunakan sebagai kontrol positif untuk analisis sitokompatibilitas (viabilitas sel 100%). Kemudian, medium (dari setiap sumur) diambil dan ditempatkan dalam multiwell 96-sisi hitam dengan dasar bening (Corning).
Untuk pengujian sitotoksisitas dan sitokompatibilitas, sampel dianalisis menggunakan spektrofotometer Varioskan LUX Multimode Microplate Reader (Life Technologies, Carlsbad, California, AS) dengan mengatur panjang gelombang eksitasi dan emisi masing-masing pada 560 dan 590 nm.
Perlakuan AHCF dengan NP Hibrida untuk Penilaian Efisiensi Transfeksi In Vitro dan Pemrograman Ulang Sel Langsung melalui Analisis Ekspresi Gen
Untuk mempelajari efisiensi transfeksi oleh NP yang dimuat miRNA, AHCF ditanam dalam pelat 24-well (2,2 × 104 cell well −1 ) dalam medium lengkap dan dikultur selama 24 jam. Kemudian, sel diobati dengan NP hibrida, yang dimuat dengan miR-1 atau negmiR, dalam medium kultur (volume 500 µL, konsentrasi RNA 25 nm , 25 pmol). Setelah 24 jam, sel dicuci dua kali dengan PBS dan medium lengkap baru ditambahkan. Kultur dilanjutkan selama 24 jam tambahan sebelum ekstraksi RNA untuk menganalisis ekspresi mRNA TWF-1 sebagai target miR-1.
Untuk mempelajari secara awal reprogramming AHCF menjadi iCM, AHCF diobati dengan NP hibrida yang dimuat miRcombo atau negmiR dalam volume medium lengkap (volume 500 µL, dengan konsentrasi miRNA 25 nm , 25 pmol). Setelah 24 jam, sel dicuci dua kali dengan PBS dan medium lengkap baru ditambahkan. Kultur dilanjutkan selama 15 hari tambahan, sebelum ekstraksi RNA.
Ekspresi RNA dan Analisis ddPCR
RNA diekstraksi menggunakan reagen lisis TRIzol (Invitrogen), sesuai dengan petunjuk pabrik. Kuantitas dan kualitas RNA dinilai menggunakan pembaca mikroplat Synergy HTX (Biotek). Total cDNA (200 ng) diperoleh menggunakan kit transkripsi balik cDNA berkapasitas tinggi (Applied Biosystems). Ekspresi gen dalam AHCF diperiksa dengan PCR digital droplet (ddPCR, Bio-Rad Laboratories). Pembuatan droplet dilakukan sesuai dengan petunjuk pabrik. Kondisi siklus termal adalah 95 °C selama 10 menit (1 siklus), 94 °C selama 30 detik dan 55 °C selama 30 detik (40 siklus), 98 °C selama 10 menit (1 siklus), dan penahanan tak terbatas 4 °C. Dalam semua percobaan ddPCR, plat PCR dimuat pada pembaca droplet Bio-Rad QX100 untuk kuantifikasi salinan cDNA/mL. Analisis data ddPCR dilakukan dengan perangkat lunak analisis QuantaSoft (Bio-Rad Laboratories). Tidak ada kontrol templat dengan H 2 O yang disertakan dalam setiap pengujian. Eksperimen dilakukan dalam rangkap tiga dan diulang tiga kali. Hasil dilaporkan sebagai konsentrasi (salinan cDNA/mL) gen yang diinginkan yang dihitung berdasarkan rata-rata konsentrasi (salinan cDNA/mL) GAPDH.
Penilaian Efisiensi Reprogramming Langsung In Vitro AHCFs dengan Flow Cytometry
Sitometri aliran dilakukan untuk mengevaluasi efisiensi reprograming langsung in vitro dari AHCF, yang ditransfeksi dengan negmiR atau NP hibrida yang dimuat miRcombo selama 24 jam dan kemudian dikultur dalam medium kultur lengkap selama 15 hari. Sel diperlakukan dengan 0,05% tripsin/EDTA dan dipermeabilisasi dengan 0,5% v/v Tween 20 (Sigma–Aldrich) dalam PBS selama 5 menit. PBS dingin dengan 10% FBS dan 1% natrium azida (Sigma Aldrich) digunakan untuk pencucian di antara setiap langkah. Sel diinkubasi dengan antibodi primer Cardiac Troponin T (cTnT) (cat #701620, Invitrogen) selama 1 jam pada suhu 4 °C dan antibodi sekunder terkonjugasi Alexa Fluor 488 (ab150077, Abcam) selama 1 jam pada suhu 4 °C dalam gelap. Sel-sel dijalankan pada flow cytometer Guava EasyCyte (Cytek Biosciences BV) dan analisis data dilakukan menggunakan GuavaSoft 3.2. Persentase sel positif cTnT dihitung sebagai indeks efisiensi reprograming langsung in vitro.
Stabilitas Sifat Fisik dan Fungsional NP Hibrida Setelah Penyimpanan
Stabilitas fisik NP hibrida, yang dimuat dengan negmiR sebagai kontrol negatif, miRcombo atau dengan miR-1 untuk uji efisiensi transfeksi in vitro, dievaluasi pada kondisi penyimpanan yang berbeda, seperti: i) inkubasi suspensi NP hibrida pada suhu 4 °C; ii) pembekuan pada suhu −80 °C suspensi NP hibrida (1 mL) dengan/tanpa krioprotektan (trehalosa 012250, ACEF) diikuti dengan penyimpanan pada suhu −80 °C; iii) pengeringan beku suspensi NP hibrida (1 mL) dengan trehalosa diikuti dengan penyimpanan pada suhu −20 °C.
Untuk kondisi penyimpanan (i), suspensi NP hibrida disimpan pada suhu 4 °C selama waktu yang berbeda sebelum menganalisis pemeliharaan sifat fisik dan fungsional, berkenaan dengan suspensi NP segar. Stabilitas sifat fisik NP hibrida yang dimuat negmiR dan miRcombo yang disimpan pada suhu 4 °C dievaluasi dengan mengukur diameter hidrodinamik, PDI, dan potensi Z setelah 7, 14, 21, dan 28 hari penyimpanan, melalui analisis DLS, dibandingkan dengan suspensi NP yang baru disiapkan. Untuk menilai pemeliharaan sifat fungsional selama penyimpanan, uji sel in vitro dilakukan. AHCF diobati dengan NP hibrida yang dimuat miR-1 yang disimpan pada suhu 4 °C selama 48 jam, 7, dan 14 hari, dan penurunan regulasi TWF-1 dianalisis 48 jam pasca-transfeksi. Ekstraksi RNA dan analisis ddPCR dilakukan seperti yang dijelaskan dalam paragraf di atas.
Untuk kondisi penyimpanan (ii), suspensi NP hibrida yang baru disiapkan disentrifugasi (pada 15000 rpm, selama 15 menit pada suhu 4 °C) menggunakan sentrifus meja Allegra X 30 (Beckman Coulter) untuk menghilangkan supernatan. Kemudian, larutan air (1 mL) dengan berbagai konsentrasi trehalosa (0, 7, 10, 12% b/v) ditambahkan, sebelum dibekukan pada suhu -80 °C. NP hibrida beku disimpan pada suhu -80 °C selama 7 dan 14 hari. Untuk kondisi penyimpanan (iii), suspensi NP hibrida yang baru disiapkan disentrifugasi (pada 15000 rpm, selama 15 menit pada suhu 4 °C) menggunakan sentrifus meja Allegra X 30 untuk menghilangkan supernatan. Kemudian, larutan air (1 mL) dengan berbagai konsentrasi trehalosa (2,5, 5, 7, 10, 12, 13, 15, dan 18% b/v) ditambahkan, sebelum dibekukan pada suhu -80 °C selama 2 jam dan selanjutnya dikeringkan beku semalaman menggunakan Pengering Beku Cool Safe 4–15L (LaboGene, Lillerød, Denmark). Kemudian, bubuk yang dikeringkan beku disimpan pada suhu -20 °C selama 7 dan 14 hari. Untuk analisis lebih lanjut setelah kondisi penyimpanan (ii) dan (iii), NP hibrida beku dicairkan, sementara NP hibrida yang dikeringkan beku dilarutkan kembali dalam 1 mL air bebas RNase. Setelah pencairan atau dilarutkan kembali, NP hibrida dicuci dengan menggunakan langkah sentrifugasi pada 15000 rpm selama 15 menit pada suhu 4 °C dan kemudian disuspensikan kembali dalam air bebas RNase. Stabilitas sifat fisik NP hibrida yang dimuat negmiR setelah kondisi penyimpanan (ii) dan (iii) selama 0, 7, dan 14 hari dievaluasi dengan mengukur diameter hidrodinamik, PDI, dan potensi Z NP. Viabilitas sel AHCF yang ditransfeksi selama 24 jam dengan NP hibrida yang dimuat negmiR setelah kondisi penyimpanan (ii) dan (iii) selama 0, 7, dan 14 hari dievaluasi seperti yang dijelaskan dalam paragraf di atas. Untuk uji in vitro, AHCF diobati dengan NP hibrida yang dimuat miR-1 yang disimpan selama 0, 7, dan 14 hari dalam kondisi penyimpanan (ii) dan (iii), dan penurunan regulasi TWF-1 dianalisis 48 jam pasca-transfeksi. Ekstraksi RNA dan ddPCR dilakukan seperti yang dijelaskan dalam paragraf sebelumnya.
Analisis Kontaminasi Mikroba pada NP Hibrida Selama Penyimpanan
Analisis kontaminasi mikroba pada NP hibrida yang baru disiapkan dan NP hibrida beku dan kering beku (dengan adanya 12% b/v trehalosa) setelah penyimpanan masing-masing selama 0, 7, dan 14 hari pada suhu -80 dan -20 °C dilakukan melalui metode inokulasi langsung, mengikuti European Pharmacopeia (Ph. Eur. 2.6.1, 2008) [ 74 ] dan ISO 11737-2:2019 Sterilisasi produk perawatan kesehatan (Estimasi beban hayati). Suspensi NP hibrida (200 µL, 26,7 µg mL −1 ) dari setiap kondisi penyimpanan diinkubasi dalam 2,8 mL kaldu tripase-kedelai (TSB, untuk bakteri aerobik; STBMTSB12, Merk) dan kaldu tioglikolat (TGB, untuk bakteri anaerobik; STBMFTM12, Merk) masing-masing pada suhu 25 dan 37 °C. Setelah 1, 7, dan 14 hari inkubasi, keberadaan kontaminasi bakteri diselidiki dengan pengamatan visual kekeruhan, dengan metode unit pembentuk koloni (CFU) pada pelat agar padat dan dengan analisis spektroskopi. Untuk metode CFU, 100 µL suspensi NP hibrida pada setiap titik waktu disebarkan ke pelat agar padat dan diinkubasi selama 24 jam pada suhu 25 °C untuk sampel TSB dan pada suhu 37 °C untuk sampel TGB. Untuk analisis spektroskopi, 100 µL suspensi NP hibrida pada setiap titik waktu dianalisis menggunakan Varioskan LUX Multimode Microplate Reader (Life Technologies, Carlsbad, California, AS). Spektrum serapan diperoleh antara 400 dan 700 nm. Panjang gelombang serapan tunggal (457, 490, dan 600 nm), yang merupakan panjang gelombang khusus untuk kemungkinan kontaminasi mikroba, dianalisis. Semua analisis dilakukan dalam rangkap tiga. Setiap sampel dibandingkan dengan kontrol negatif.
Analisis Statistik
Semua pengukuran dilakukan dalam rangkap tiga. Data karakterisasi fisikokimia disajikan sebagai nilai rata-rata ± simpangan baku (SD). Analisis statistik dilakukan menggunakan uji Anova satu arah dan uji t Student . Untuk eksperimen biologi, hasilnya disajikan sebagai rata-rata ± galat baku rata-rata (SEM) dari eksperimen rangkap tiga. Analisis statistik dilakukan dengan uji t Student . Nilai- P dilaporkan sebagai * p < 0,05 dianggap signifikan secara statistik, ** p < 0,01 dianggap sangat signifikan, dan *** p < 0,0001 sangat signifikan. Semua grafik disiapkan menggunakan perangkat lunak GraphPad.
