Perangkat Nanobio Spektroskopi Serbaguna Canggih untuk Pemisahan dan Deteksi Vesikel Ekstraseluler Tanpa Label di Lab-on-a-Chip sebagai Biomarker Utama untuk Diagnostik Penyakit Kardiovaskular di Tempat Perawatan
Abstrak
Populasi global yang menua menghadirkan tantangan kesehatan masyarakat yang besar, dengan penyakit kardiovaskular (PKV) tetap menjadi penyebab utama kematian di seluruh dunia. Sering kali tanpa gejala pada tahap awal, PKV sering tidak terdiagnosis hingga terjadi kejadian kritis seperti infark miokard atau stroke. Untuk mengatasi kesenjangan ini, perangkat bionano lab-on-a-chip spektroskopi multiguna terintegrasi yang canggih telah dikembangkan untuk deteksi dini PKV melalui vesikel ekstraseluler (EV). EV, yang mencerminkan keadaan molekuler sel asalnya, dipisahkan dan dianalisis menggunakan spesifisitas molekuler gabungan spektroskopi Raman dengan klasifikasi yang digerakkan oleh AI dari biofluida klinis PKV. AIMSpec-LoC secara belum pernah terjadi sebelumnya mencapai pemisahan subtipe PKV yang cepat, bebas label, dan berbasis ukuran, termasuk PKV kecil, sedang, dan besar dari biofluida, sambil mempertahankan integritas PKV dan menghilangkan praproses yang ekstensif. Perangkat ini memungkinkan pembuatan profil molekuler multipleks secara real-time dari muatan EV, mengidentifikasi biomarker spesifik CVD dengan sensitivitas dan spesifisitas >96% dan menghubungkannya dengan perkembangan CVD, mencapai akurasi >97% dalam mengidentifikasi sidik jari molekuler spesifik penyakit. Perangkat bionanoteknologi ini menghasilkan kode batang kuantitatif untuk mendukung pemodelan prognostik dan evaluasi terapeutik, memberikan wawasan yang dapat ditindaklanjuti kepada dokter untuk diagnosis tepat waktu dan perawatan yang dipersonalisasi. Platform AIMSpec-LoC menawarkan solusi transformatif untuk diagnostik CVD di tempat perawatan, mengatasi kebutuhan kritis yang belum terpenuhi dalam pengobatan kardiovaskular, meningkatkan pengambilan keputusan klinis, meningkatkan kesehatan pasien, dan mengurangi beban global CVD.
1 Pendahuluan
Penyakit kardiovaskular adalah penyebab utama morbiditas dan mortalitas di seluruh dunia, dengan tingkat komplikasi yang tinggi. Pada tahun 2019, 20,5 juta orang meninggal karena CVD, yang mencakup 32% dari kematian global. [ 1 ] Meskipun, banyak CVD dapat dicegah dengan mengatasi faktor risiko perilaku untuk penyakit jantung dan stroke, seperti kurangnya aktivitas fisik dan penggunaan tembakau, belum ada penyakit arteri aterosklerotik yang mendasarinya yang telah diidentifikasi dan hanya kejadian jantung yang fatal termasuk stroke atau serangan jantung, yang sering kali merupakan tanda-tanda pertama penyakit. Pencegahan CVD yang tidak efisien meningkatkan kejadian kondisi kesehatan terkait kardiovaskular, yang berkontribusi pada tuntutan yang lebih tinggi pada sistem perawatan kesehatan. Selain itu, populasi lansia yang terus tumbuh meningkatkan permintaan dari layanan kesehatan dan sosial untuk jangka waktu yang lama karena pasien dengan banyak CVD memerlukan manajemen jangka panjang dengan kunjungan berulang ke profesional perawatan kesehatan. Oleh karena itu, sangat penting untuk mendeteksi CVD sedini mungkin untuk mengurangi beban utama pada sistem perawatan kesehatan melalui penyertaan manajemen, intervensi, dan pengobatan.
Pengukuran kuantitatif status penyakit pasien melalui biomarker spesifik kondisi sangat penting dalam praktik modern untuk memandu pengobatan terapeutik yang bijaksana. [ 2 , 3 ] Biomarker indikasi CVD dapat memberikan wawasan tentang jalur biologis yang mendasari patologi tertentu yang memungkinkan stratifikasi dan klasifikasi patologi yang efektif untuk tujuan memandu manajemen. [ 3 – 5 ] Namun, waktu khas untuk mendapatkan hasil dari banyak tes diagnostik dan prognostik khusus untuk CVD seperti elektrokardiogram, angiografi koroner CT, MRI dan tes radionukleotida seringkali lebih dari sebulan [ 6 ] Tes-tes ini mahal dan akses yang tertunda memberikan penghalang untuk memulai perawatan pencegahan yang efektif, yang mengarah pada kematian yang dapat dihindari. Metode diagnostik konvensional seringkali melibatkan prosedur invasif seperti, angiografi koroner pada CVD, dikaitkan dengan risiko kecil serangan jantung, stroke, infeksi dan ketidaknyamanan bagi pasien. [ 7 ] Dengan demikian, ada kebutuhan mendesak untuk pendekatan diagnostik yang cepat, andal, dan non-invasif. Pengembangan alat bantu di samping tempat tidur yang sekali pakai, sederhana, dan murah untuk mengukur potensi biomarker penyakit kardiovaskular dini, dari cairan biologis yang tersedia seperti plasma darah atau air liur, akan menjadi sangat penting dan merupakan langkah besar menuju penentuan status penyakit seseorang. Alat ini juga akan memungkinkan pengukuran akurat mengenai kemanjuran terapi dan intervensi klinis tertentu, yang menunjukkan bagaimana perkembangan klinis seseorang.
Dalam beberapa tahun terakhir, vesikel ekstraseluler telah muncul sebagai biomarker sirkulasi penyakit yang menjanjikan. [ 8 , 9 ] EV adalah membran terikat lipid, yang dilepaskan oleh sel ke dalam ruang ekstraseluler. Mereka hadir dalam sebagian besar cairan tubuh, termasuk darah, urin dan air liur, dan oleh karena itu, mudah diakses untuk analisis. [ 10 – 13 ] EV dianggap sebagai reservoir informasi penting karena mereka menyimpan bukti kunci yang berkaitan dengan sel-sel dari mana mereka berasal. Bertindak sebagai pembawa pesan intraseluler, peran mereka dalam potensi penyebaran penyakit semakin menarik minat. [ 14 – 17 ] Meskipun sebagian besar masih belum diketahui, ada beberapa rute untuk pembentukan EV, dengan subpopulasi dibagi menjadi tiga kelompok besar berdasarkan ukuran, kepadatan dan komposisinya, yang biasanya meliputi eksosom, mikrovesikel, dan badan apoptosis. [ 18 , 19 ] Eksosom terbentuk sebagai hasil dari tunas ke dalam membran endosomal yang menginduksi pembentukan badan multivesikular (MVB). MVB kemudian dilepaskan ke lingkungan ekstraseluler melalui fusi dengan membran plasma. [ 20 , 21 ] Setelah dilepaskan ke ruang parenkim atau ruang urin, eksosom dapat berpartisipasi dalam peristiwa pensinyalan molekuler. [ 22 ] Di sisi lain, mikrovesikel terbentuk melalui tunas langsung dari membran plasma. [ 23 ] Pembentukannya diinduksi dengan adanya stimulus seperti stres oksidatif, yang mendorong peristiwa seluler, misalnya, protein pengikat fosfolipid. Hal ini pada gilirannya, menyebabkan tunas dan pelepasan mikrovesikel dari plasma. [ 24 ] Badan apoptosis dilepaskan selama tahap akhir kematian sel dan mengandung banyak organel seluler, konten sitosol, dan bahan nuklir. [ 25 ] Meskipun setiap subkelompok EV menunjukkan perbedaan nyata dalam mekanisme pembentukannya, setelah disekresikan dari sel, sulit untuk membedakan satu subtipe EV dari yang lain. Vesikel-vesikel ini tidak mengandung penanda molekuler spesifik atau sifat deskriptif yang membedakan sub-kelompoknya. [ 26 ] Potensi keseluruhan sebagai biomarker utama, vaksin dan wadah pengiriman obat telah menarik minat yang semakin besar terhadap EV, yang membawa dan melindungi muatan seluler, termasuk asam nukleat, protein dan lipid dari tempat asalnya dan dengan demikian, mencerminkan keadaan fisiologis dan patologis sel induknya .27 – 29 ]Oleh karena itu, deteksi dan analisis EV menawarkan wawasan berharga tentang mekanisme penyakit, diagnosis, prognosis, serta respons terhadap terapi.
EV bersifat heterogen dalam asal, konstituen molekuler dan ukuran, dan sementara mereka hadir dalam serangkaian biofluida kompleks, ini terdiri dari jumlah struktur non-vesikular yang berbeda, yang dapat menghambat hasil analitis. [ 27 ] Oleh karena itu, isolasi dan pemisahan EV merupakan langkah pra-analitis yang diperlukan. Metode konvensional termasuk, misalnya, ultracentrifugasi, kromatografi pengecualian ukuran (SEC) dan pendekatan imunoafinitas yang digunakan untuk menyelidiki EV mengalami waktu throughput yang rendah dan memerlukan peralatan yang mahal, menyoroti meningkatnya permintaan untuk metode analitis yang lebih baik. [ 30 – 34 ] Mikrofluida baru-baru ini muncul sebagai teknik tambahan dalam penelitian EV [ 35 – 37 ] dengan teknologi berbasis lab-on-a-chip (LoC) yang menjanjikan untuk mengatasi banyak tantangan yang terkait dengan metode isolasi EV yang ada. Dengan memanfaatkan sistem mikrofluida, perangkat LoC dapat memberikan kontrol yang lebih baik atas aliran fluida, memungkinkan isolasi EV yang tepat dan efisien. [ 38 ] Sifat miniaturisasi perangkat ini memungkinkan pengurangan volume, sehingga cocok untuk sumber sampel yang terbatas atau sensitif terhadap waktu. Selain itu, platform LoC menawarkan peluang tambahan untuk otomatisasi, standarisasi, dan pemrosesan multipleks, yang mengarah pada peningkatan reproduktifitas dan skalabilitas protokol isolasi EV. [ 39 ] Miniaturisasi dan integrasi teknik analisis kuantitatif dalam chip, seperti metode pembuatan profil molekuler melalui spektroskopi Raman (RS), dapat memungkinkan fasilitasi lebih lanjut dari analisis EV terisolasi yang cepat, non-invasif, dan akurat di hilir.
Spektroskopi Raman adalah metode analitis yang sensitif, yang menyediakan sidik jari spektral unik dari analit target melalui hamburan cahaya yang tidak elastis. Ini memungkinkan analisis kuantitatif non-destruktif dari komposisi biokimia, tidak memerlukan persiapan sampel yang rumit dan menimbulkan deteksi yang secara inheren mudah dalam kondisi berair. Lebih jauh, portabilitasnya memungkinkan diagnostik point-of-care in-vivo yang andal. Oleh karena itu, teknologi spektroskopi Raman dapat menawarkan rute non-invasif bebas label untuk mengukur perubahan biokimia CVD pada tahap awal penyakit dengan integrasi langsung ke jalur perawatan kesehatan yang ada [ 40 , 41 ] Analisis EV yang non-invasif dan bebas label ini memberikan informasi molekuler terperinci tentang komposisi dan sifat strukturalnya dengan keuntungan lebih lanjut termasuk penghapusan kebutuhan pewarna atau label eksogen, yang dapat mengubah muatan EV atau memperkenalkan artefak serta memberikan spesifisitas molekuler yang tinggi, memungkinkan identifikasi dan kuantifikasi cepat berbagai biomolekul, misalnya, protein, lipid, asam nukleat dan metabolit dalam EV. [ 42 – 44 ] Melalui pemeriksaan dekat pita spektroskopi yang terkait dengan getaran molekuler tertentu, RS membedakan antara spesies molekuler dan memberikan wawasan ke dalam kelimpahan relatif mereka serta informasi mengenai struktur sekunder protein, konfirmasi asam nukleat dan urutan lipid dalam membran EV, menawarkan wawasan berharga secara keseluruhan ke dalam komposisi dan organisasi vesikel. [ 45 , 46 ] Integrasi RS dengan teknologi LoC untuk pemisahan, deteksi dan analisis EV karena itu memiliki potensi yang signifikan untuk memungkinkan isolasi yang efisien dan throughput tinggi bersama dengan lingkungan yang terkendali dan dapat direproduksi untuk analisis, sementara melakukan deteksi real-time dan in situ dari EV yang terisolasi, menghasilkan karakterisasi cepat dari komposisi molekuler mereka.
Karena tantangan yang terkait dengan karakterisasi dan klasifikasi EV menggunakan teknik analitis konvensional, serta kumpulan data berdimensi tinggi yang dihasilkan melalui teknik seperti flow cytometry, profil omik, dan RS, pembelajaran mesin (ML) dan kecerdasan buatan (AI) telah muncul sebagai solusi ampuh untuk mengatasi keterbatasan ini. [ 47 ] Berbagai algoritma ML telah diterapkan pada penelitian EV, termasuk model terbimbing seperti support vector machines (SVM), regresi logistik, analisis diskriminan linier (LDA) dan jaringan saraf yang dapat dilatih untuk mengklasifikasikan subtipe EV dan/atau memprediksi status penyakit. [ 48 – 51 ] Wang et al. misalnya, menggabungkan analisis LDA dengan elektrokimia untuk analisis EV tumor, di mana menggunakan perangkat elektrokimia mikrofluida terintegrasi dan mendeteksi target dengan kelimpahan rendah, penulis dapat mengidentifikasi pasien kanker payudara secara akurat dengan sensitivitas dan spesifisitas 100%. [ 52 ] Selain itu, Li et al. Bahasa Indonesia: menerapkan regresi logistik dan SVM dalam diagnosis kanker paru non-sel kecil (NSCLC), mencapai akurasi diagnostik sebesar 97,4% untuk kelompok pelatihan dan 91,7% untuk kelompok validasi saat mendeteksi ekspresi reseptor faktor pertumbuhan epidermal (EGFR) dan reseptor kemokin CXC 4 (CXCR4) dalam serum EV sebagai indikator dan prediktor NSCLC. [ 51 ] Pulliam dkk. juga menerapkan SVM untuk memprediksi gangguan neurokognitif terkait HIV pada orang yang terinfeksi HIV menggunakan protein EV neuronal plasma dengan nilai area di bawah kurva sebesar 0,82 dan Lee dkk . menggunakan berbagai metode ML termasuk regresi logistik, hutan acak, SVM dan Deep Neural Network (DNN) untuk memperoleh penanda kandidat dalam tingkat genus dan filum yang terkait dengan diagnosis kanker pankreas dari EV yang berasal dari darah dengan DNN menggunakan 11 metode ML lain yang berkinerja lebih baik dengan area di bawah kurva sebesar 0,96. [ 53 , 54 ] Demikian pula, metode tanpa pengawasan seperti pengelompokan k-means, pengelompokan hierarkis, dan analisis komponen utama (PCA) juga telah diterapkan dengan berbagai tingkat keberhasilan dalam eksplorasi heterogenitas EV dan untuk mengungkapkan pola intrinsik dalam kumpulan data EV yang kompleks. [ 48 – 50 , 55 ] Shin etal. misalnya, mengidentifikasi pola Raman yang terkait dengan eksosom normal dan kanker menggunakan PCA dan Dobra et al. menerapkan PCA untuk menentukan sEV lebih cocok untuk membedakan antara pasien yang didiagnosis dengan glioblastoma multiforme, metastasis otak kanker paru non-sel kecil, meningioma, dan pasien hernia diskus lumbal. [ 50 , 56 ] Integrasi pendekatan komputasional tidak hanya meningkatkan akurasi diagnostik dan memungkinkan wawasan yang lebih dalam ke dalam biologi EV tetapi juga mendorong bidang tersebut menuju solusi yang lebih kuat dan dapat diterapkan secara klinis.
Di sini, kami telah mengembangkan lab-on-a-chip spektroskopi serbaguna yang canggih dan portabel untuk isolasi, deteksi, dan analisis EV melalui sidik jari RS khusus untuk diagnosis tahap awal yang murah dan non-invasif. Desain dan pengembangan teknologi perangkat lab-on-a-chip Raman optofluidik unik kami untuk mendeteksi biomarker yang mengindikasikan CVD memungkinkan deteksi EV yang tepat waktu sebagai indikator penyakit utama, sebagai platform untuk menyediakan triase dan diagnostik yang transformatif. AIMSPec-LoC dengan cepat mengekstrak EV dari biofluida dan mendeteksinya sebagai penanda utama dengan sensitivitas, spesifisitas, dan ketepatan waktu yang tinggi. Teknologi lab-on-a-chip yang dikembangkan dikombinasikan dengan spektroskopi Raman selanjutnya divalidasi untuk mendeteksi indikator penyakit kardiovaskular dan radang usus, yang membangun alat analisis yang kuat untuk analisis biomolekuler. Data spektral yang diperoleh melalui AIMSPec-LoC selanjutnya diklasifikasikan menggunakan algoritma jaringan saraf tiruan canggih kami yang mengoptimalkan sendiri Kohonen index network (SKiNET) sebagai alat pendukung keputusan untuk pembacaan yang mudah bagi dokter. SKiNET didasarkan pada peta pengaturan sendiri (SOM) dengan klasifikasi melalui indeks diskriminan peta pengaturan sendiri (SOMDI). Melalui pemeriksaan perbedaan utama antara bobot neuron dan vektor bobot kelas, algoritma memungkinkan identifikasi perubahan spektral utama. Hal ini memungkinkan identifikasi jenis data yang diaktifkan oleh neuron tertentu, yang digunakan untuk memeriksa bobot di semua neuron dan mengekstraksi fitur menonjol yang termasuk dalam setiap kelas dengan menemukan bobot yang paling berkontribusi pada kelas tertentu. Puncak dalam SOMDI selanjutnya sesuai dengan cm −1dan mode yang paling berkontribusi pada pengelompokan yang diamati dalam SOM. Parameter pelatihan yang digunakan untuk SOM meliputi ukuran grid, laju pembelajaran, dan jumlah periode optimal, serta pemisahan kelas yang mengungkap perbedaan karakteristik akibat klasifikasi neuron tertentu. Hal ini memungkinkan dasar yang jelas untuk diferensiasi melalui vektor bobot karakteristik yang akan diturunkan dalam SOMDI. Dalam studi ini, SKiNET memungkinkan klasifikasi subtipe EV dan status penyakit yang akurat, mencapai akurasi tinggi untuk EV kecil, sekaligus memetakan perkembangan penyakit secara visual melalui kode batang spektral. Metrik kinerja ini melampaui yang dilaporkan oleh sebagian besar sistem ML berbasis label atau elektrokimia. Platform kami juga menawarkan fleksibilitas yang lebih besar untuk diagnostik waktu nyata dan penggunaan point-of-care yang dapat diskalakan, karena bentuknya yang ringkas, pemrosesan sampel minimal, dan kapasitas throughput tinggi. Secara keseluruhan, integrasi AIMSPec-LoC dengan SKiNET memberikan solusi diagnostik yang kuat, bebas label, dan multipleks, yang melampaui platform deteksi EV berbantuan ML terkini dalam hal resolusi, ketahanan, relevansi klinis, dan kemampuan penerapan praktis. AIMSPec-LoC selanjutnya terbukti mengatasi beberapa tantangan yang terkait dengan metodologi yang ada untuk isolasi EV. Misalnya, fraksinasi aliran medan (FFF) yang digunakan dalam isolasi EV, di mana sampel disuntikkan ke dalam ruang yang sering dipengaruhi oleh aliran silang dengan partikel yang lebih kecil yang keluar lebih awal, [ 57 ] memerlukan waktu 1 jam untuk dilakukan, memerlukan pra-persiapan sampel yang signifikan untuk menghilangkan sel dan serpihan yang lebih besar dan hanya dapat dioperasikan oleh spesialis yang sangat terlatih. Sebaliknya, AIMSPec-LoC tidak memerlukan pra-persiapan sampel dan menganalisis biofluida dalam keadaan aslinya. Teknik isolasi lebih lanjut yang umum diterapkan dalam studi EV mikrofluida adalah penangkapan imunoafinitas (IAC). IAC bergantung pada identifikasi antigenik komponen permukaan EV (terutama protein) dan meskipun cepat dan selektif ketika digunakan untuk persiapan atau analisis, satu kelemahan intrinsik dari teknik ini adalah persyaratan untuk pengetahuan sebelumnya tentang antigen permukaan yang akan ditargetkan, dan yang mungkin ada di beberapa subpopulasi EV. [ 58 ] Penargetan hanya satu antigen saja diperburuk dengan hilangnya populasi EV yang berpotensi penting.
Secara keseluruhan, dengan memanfaatkan kemampuan RS untuk menganalisis tanda-tanda molekuler yang kompleks, kami telah mengidentifikasi penanda EV spesifik penyakit yang terkait dengan CVD. Melalui analisis komprehensif yang dikombinasikan dengan algoritma komputasional canggih, pendekatan baru yang kami kembangkan untuk deteksi CVD yang akurat dan dini, pada akhirnya akan menghasilkan hasil pasien yang lebih baik dan manajemen penyakit yang lebih efektif. Mengukur perubahan abnormal pada biomarker spesifik akan menjadi indikasi CVD, memberikan penilaian kuantitatif pada tahap paling awal sekaligus membantu mengukur kerusakan. Hal ini akan ditafsirkan oleh dokter sebagai indikasi untuk memulai pengobatan sebelum penyakit lanjut berkembang. Dalam jangka panjang, platform ini akan diperluas ke aplikasi lebih lanjut, misalnya, pengenalan dini penyakit neurodegeneratif, degenerasi, dan intervensi tepat waktu yang secara khusus menargetkan identifikasi CVD pada individu yang sehat. Integrasi isolasi EV simultan dengan spektroskopi Raman sangat menjanjikan untuk diagnostik penyakit. Hal ini dapat meningkatkan penemuan penanda kardiovaskular masa depan untuk diagnostik dan intervensi dini serta memajukan pemahaman, pencegahan, dan pengobatan CVD dan kondisi merugikan terkait.
2 Hasil dan Pembahasan
Perangkat lab-on-a-chip unik yang mampu mengisolasi dan memisahkan vesikel ekstraseluler sebagai target utama penyakit telah dikembangkan, menawarkan kemampuan yang sangat serbaguna dengan waktu analisis yang lebih cepat dibandingkan dengan metode konvensional seperti ultracentrifugasi dan kemudian divalidasi untuk identifikasi penyakit kardiovaskular dan radang usus. Desain miniatur, menghilangkan kebutuhan untuk beberapa langkah pemisahan, mengurangi volume sampel yang diperlukan dan memungkinkan integrasi isolasi dan analisis hilir ke dalam satu platform ( Gambar 1 a ). Portabilitas dan kekompakan LoC sangat cocok untuk aplikasi point-of-care, yang memungkinkan penyebarannya di berbagai klinik untuk memberikan diagnostik waktu nyata.
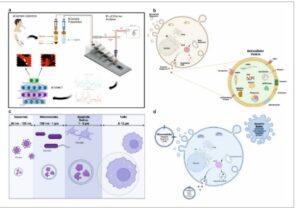
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Tinjauan Umum Prinsip Diagnostik EV. a). Skema metodologi LoC termasuk pengambilan sampel dari biofluida, misalnya, air liur dan darah, diikuti oleh persiapan sampel untuk mengisolasi plasma melalui sentrifugasi dan pengenceran air liur dengan isolasi on-chip, pemisahan dan deteksi Raman berikutnya dari EV yang diperoleh dari air liur dan plasma darah dan analisis cepat melalui algoritma jaringan saraf tiruan, SKiNET, yang bertindak sebagai alat pendukung keputusan dalam klasifikasi data yang diperoleh, keluaran dalam keadaan sakit serta subkelompok EV yang terisolasi (D). b). Biogenesis EV yang menggambarkan pembentukan eksosom melalui tunas ke dalam badan multivesikular (MVB) di dalam sel, yang menghasilkan pelepasan vesikel intraluminal sebagai eksosom ketika MVB menyatu dengan membran sel dan pembentukan mikrovesikel melalui tunas ke luar langsung atau pelepasan membran plasma. Komposisi dan struktur EV yang menggambarkan lapisan ganda fosfolipid yang mengelilingi protein (protein pensinyalan, protein MVB) dan asam nukleat (DNA dan RNA). Protein membran termasuk tetraspanin, MHC, reseptor, dan molekul adhesi (integrin). c). Kisaran ukuran khas dari tiga subkelompok EV utama dibandingkan dengan sel. Badan apoptosis berkisar antara 1–5 µm, mikrovesikel yang lebih kecil berkisar antara 100 hingga 1000 nm, tumpang tindih dengan bakteri dan eksosom umumnya didefinisikan sebagai vesikel dengan ukuran dalam kisaran 30–100 nm. d). Pembentukan EV yang menyoroti isi utama dan penanda permukaan setiap jenis vesikel. Eksosom mengandung ALIX, TSG101, mRNA dan tetraspanin sementara integrin, selektin dan CD40 merupakan karakteristik mikrovesikel dan badan apoptosis terutama terdiri dari kromatin, fragmen DNA dan protein yang terdegradasi.
AIMSpec LoC dirancang dan direkayasa untuk memungkinkan isolasi yang memadai dari berbagai populasi EV, termasuk EV kecil, sedang, dan besar dalam rentang ukuran masing-masing 40–100, 101–200, 201–500, dan 501–5000 nm. Selain itu, platform ini dirancang untuk memfasilitasi isolasi dan pemisahan hingga 1 ± 0,3 mL sampel pada konsentrasi akhir berkisar antara 1 × 106 –9 × 108 EV dari serangkaian biofluida, sementara secara bersamaan memungkinkan pemisahan EV ke dalam subkelompok berdasarkan ukuran masing-masing. Kemampuan LoC yang belum pernah terjadi sebelumnya dan dihasilkan untuk menganalisis berbagai vesikel secara paralel dari berbagai sumber cairan tubuh memberikan wawasan penting dan berharga tentang pelepasan EV spesifik jaringan dan peran potensialnya dalam berbagai penyakit dan proses biologis. Gambar 1 memberikan gambaran umum yang komprehensif dari pengaturan eksperimen, mengilustrasikan integrasi LoC yang dirancang, biogenesis EV dengan komponen utama alur kerja metodologis (Gambar 1a ) termasuk, pengumpulan sampel, isolasi pada chip, pemisahan dan analisis Raman berikutnya dengan klasifikasi data algoritma AI, yang semuanya dirancang dan direkayasa untuk mencapai keluaran kecepatan, spesifisitas, dan akurasi yang optimal. Secara bersamaan, ini menyoroti proses seluler yang terlibat dalam biogenesis berbagai subkelompok EV, misalnya, tunas luar EV dari membran plasma dan pelepasannya ke ruang ekstraseluler (Gambar 1b ) serta perbedaan berbasis ukuran representatif dari setiap kelompok (Gambar 1c ). Biasanya, platform mikro berfokus pada isolasi subtipe EV tertentu, baik eksosom atau mikrovesikel dan menggabungkan mekanisme penangkapan berdasarkan imunoafinitas atau pemilihan penanda permukaan. Di sini, kami memiliki perangkat LoC yang dibuat secara unik yang mampu melakukan isolasi EV spektrum luas, yang dirancang untuk menangkap berbagai subtipe, yang secara kolektif memungkinkan tidak hanya analisis komprehensif terhadap populasi EV yang ada dalam sampel tetapi juga memungkinkan karakterisasi EV dan muatannya yang lebih inklusif dan tidak bias.
LoC dirancang menggunakan membran nanoporous polietersulfon berdasarkan pendekatan pengecualian dan penyaringan berbasis ukuran ( Gambar 2 ), dibuat untuk memisahkan EV dari biofluida, di mana plasma yang disaring diperoleh dari 50 µL darah dalam <10 menit dengan kinerja serupa yang memungkinkan penyaringan 50 µL saliva (1:2v/v dalam PBS) dalam <15 menit. Karakterisasi komprehensif AIMSPec-LoC, penting dalam penilaian kinerja chip dan kesesuaiannya untuk isolasi dan pemisahan EV yang efisien, menggabungkan beberapa teknik termasuk, analisis pelacakan nanopartikel, mikroskopi optik, mikroskopi fluoresensi, dan hamburan cahaya dinamis, sesuai dengan rekomendasi masyarakat internasional untuk vesikel ekstraseluler dari setidaknya dua metode karakterisasi yang akan digunakan untuk EV. Penggunaan gabungan dari teknik-teknik analitis ini menyediakan evaluasi sistematis dari fungsionalitas LoC, distribusi ukuran EV dan efisiensi penangkapan serta menyoroti kekokohan dan kinerja keseluruhan chip dalam isolasi dan pemisahan EV, menyediakan wawasan lebih jauh untuk potensi integrasi langsungnya ke dalam jalur-jalur perawatan kesehatan yang ada sebagai modalitas diagnostik. LoC yang direkayasa terdiri dari enam lapisan PDMS yang direkatkan, dengan lapisan atas berfungsi sebagai saluran masuk sampel primer (Gambar 2a–d ). Setiap lapisan berikutnya terdiri dari saluran masuk sampel lebih lanjut dan sumur pengumpulan sampel. Membran PES, dengan berbagai ukuran (40, 100, 250, 500, dan 5000 nm) bertindak sebagai filter yang ditempatkan di antara setiap lapisan PDMS di dasar sumur pengumpulan sampel. Saluran kapiler (0,05 × 0,05mm 2 ) ditempatkan di lapisan dasar untuk membantu aliran fluida melalui chip dengan membran berpori dalam kontak fluida yang konstan. Sementara partikel atau EV yang lebih besar dari ukuran pori tidak dapat melewati membran dan terperangkap dalam sumur sampelnya masing-masing, partikel / EV yang lebih kecil melewati membran karena difusi yang lebih cepat. Membran tambahan (ukuran pori 40 nm) disertakan dalam desain untuk menjebak protein dan mengurangi kontaminasi (Gambar 2d ). Penempatan membran keseluruhan dan sumur pengumpulan dirancang untuk memaksimalkan pemulihan sampel. Distribusi ukuran dan konsentrasi EV yang ditangkap melalui LoC yang direkayasa kemudian dianalisis melalui NTA sambil memanfaatkan gerakan Brown partikel dalam larutan (59) Profil distribusi ukuran representatif dari EV yang diisolasi telah ditemukan berada dalam tiga rentang utama 41–100, 101–250, dan 251–500 nm, yang masing-masing menunjukkan EV kecil, sedang, dan besar (Gambar 2j ). Distribusi ukuran yang terdefinisi dengan baik dengan diameter rata-rata masing-masing 61 ± 23, 189 ± 84, dan 432 ± 143 nm menunjukkan keberhasilan isolasi EV dalam rentang yang diinginkan. [ 22 , 24 ]Konsentrasi EV rata-rata ditemukan sebesar 7,7 × 108 dan 2,2 × 108 partikel mL −1 di setiap sumur sampel yang diisolasi, yang mengonfirmasi kemampuan penangkapan yang efisien dari pemisahan EV berbasis plasma berdasarkan ukuran pori, yang menunjukkan CVD. Lebih jauh, distribusi ukuran partikel terisolasi yang lebih besar yang ditentukan melalui DLS mengungkapkan profil distribusi 501–5000 nm dengan populasi yang konsisten dengan EV besar [ 25 ] (Gambar 2h ).

Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Pembuatan dan Karakterisasi AIMSPec-LoC untuk Isolasi dan Pemisahan EV. a). Skema yang mengilustrasikan keseluruhan desain chip lengkap dengan analisis Raman EV analitis hilir terintegrasi. b). Diagram LoC beranotasi terperinci yang menunjukkan saluran masuk sampel di lapisan PDMS pertama dengan filter 5000, 500, 200, 100, dan 40 nm di lapisan berikutnya dan saluran kapiler, membantu aliran fluida dalam sistem. c). Skema aliran kapiler dalam lapisan dasar LoC (kiri) dengan pencitraan optik saluran kapiler (kanan atas) dan saluran mikrofluida (kanan bawah) yang menghubungkan saluran masuk sampel dan sumur pengambilan sampel. d). Tinjauan umum pembuatan LoC termasuk, pencetakan 3D (kiri atas), pengecoran PDMS (atas rapat dan kanan bawah) dan perakitan 3D (kiri bawah), menghasilkan prototipe model AIMSPec-LoC. (e) . Gambar mikroskop optik (kiri atas) dari filter nanopori berukuran pori 500 nm dengan gambar mikroskop fluoresensi yang sesuai (kiri bawah) dari EV 500–5000 nm yang dikumpulkan dan DLS yang diukur melalui Panalytical Zetasizer HPPS (sisi kanan) yang menunjukkan kelimpahan nanovesikel dalam kisaran 1000–5000 nm. f). Gambar SEM dari filter membran nanopori 100 nm menunjukkan EV dan gambar SEM representatif dari EV yang diisolasi. g). Gambar mikroskop fluoresensi dari pergerakan manik-manik fluoresensi, yang bertindak sebagai proksi visual untuk EV dalam saluran mikrofluida dan pengumpulan terkaitnya di sumur pengambilan sampel, yang menunjukkan efisiensi pemisahan LoC dan analisis pelacakan nanopartikel yang diukur (NanoSight N300) menunjukkan kelimpahan dan distribusi ukuran EV yang diisolasi untuk setiap ukuran filter.
Untuk menilai lebih lanjut dan mengevaluasi penangkapan EV berbasis ukuran tertentu, manik-manik polistirena fluoresen mulai dari 5 µm hingga 30 nm digunakan untuk merepresentasikan dimensi EV untuk setiap subkelompok yang dipelajari, yaitu, 1 dan 5 µm untuk EV besar, 0,2, 0,45, dan 0,5 µm untuk EV tengah, dan 0,04 dan 0,1 µm untuk EV kecil. Gambar mikroskop fluoresensi representatif dari distribusi berbasis ukuran menunjukkan partikel fluoresen yang mengalir melalui saluran mikrofluida (Gambar 1,i–j ) yang menunjukkan sinyal fluoresen intens yang sesuai dengan pelabelan sampel tertentu, yaitu manik-manik PS dalam kisaran 41–100 (merah), 101–250 (biru), dan 251–500 nm (hijau). Ini menunjukkan penangkapan spesifik rentang target dengan persilangan sinyal sampel yang dapat diabaikan dan efisiensi pemisahan keseluruhan sebesar 92% (dihitung dari jumlah total manik-manik yang dikumpulkan di semua membran filtrasi dibagi dengan jumlah yang dikumpulkan dari membran filter tunggal), yang menunjukkan kemampuan LoC untuk secara selektif menangkap EV berdasarkan ukuran, memberikan platform yang kuat untuk analisis hilir dan pembuatan profil molekuler yang cepat. Gambar mikroskopi optik dari struktur membran nanopori (Gambar 2j ) yang menunjukkan fitur permukaan dan internal untuk menentukan ukuran pori, bentuk dan distribusi, selanjutnya memungkinkan identifikasi cacat atau ketidakteraturan serta pemantauan waktu nyata untuk menghilangkan penyumbatan. Gambar SEM EV dalam larutan, yang ditangkap di permukaan membran nanopori dari setiap langkah filtrasi (Gambar 2k ), selanjutnya mengonfirmasi subkelompok EV yang diisolasi dengan rentang ukuran 40–100 dan 101–200 nm dan ukuran EV rata-rata masing-masing 61 ± 3 dan 189 ± 84 nm, sesuai dengan analisis NTA.
Penting untuk dicatat, chip yang dibuat memungkinkan isolasi EV dan subkelompok terkaitnya tanpa label melalui fungsi berbasis ukuran dan kapiler dengan menerapkan gaya g pada biopartikel, yang beberapa kali lipat lebih rendah daripada gaya khas yang diterapkan dalam ultracentrifugasi konvensional, mengurangi agregasi partikel secara keseluruhan dan kerusakan karena tegangan geser. LoC, sebagai teknik katalogisasi pasif, menunjukkan keuntungan lebih lanjut dibandingkan metode tradisional seperti ultracentrifugasi dan immunocapture, termasuk biaya sistem yang lebih rendah secara keseluruhan, tidak memerlukan medan gaya eksternal tambahan yang tidak seperti pompa jarum suntik yang rutin digunakan dalam sistem mikrofluida EV, [ 35 ] juga tidak memerlukan antibodi untuk menangkap EV. Desain rekayasa yang hemat biaya didasarkan pada gaya gravitasi yang dikombinasikan dengan saluran kapiler, yang memungkinkan aliran fluida throughput tinggi melalui LoC, menghasilkan chip yang lebih kecil dan lebih kompak daripada perangkat mikrofluida lainnya. [ 60 , 61 ] Masalah penyumbatan yang umum, sering dikaitkan dengan sistem mikrofluida serta deformasi saluran dihindari dalam AIMSPec-LoC karena dimensi saluran yang lebih besar dan laju aliran yang lebih rendah secara keseluruhan. Kemampuan untuk mengisolasi EV secara langsung dari air liur dan plasma darah menawarkan beberapa manfaat utama untuk penggunaan di klinik atau di samping tempat tidur termasuk, waktu yang cepat untuk mendapatkan hasil (<20 menit), portabilitas (75 × 25 × 50mm 3 ) dan akurasi tinggi (AUC 0,95-1). Ini juga memungkinkan kemudahan penyebaran di tempat terpencil atau dengan sumber daya terbatas untuk diagnosis dan perawatan yang tepat waktu bahkan di area dengan akses terbatas ke peralatan laboratorium, otomatisasi dan intervensi pengguna yang minimal mengurangi potensi kesalahan manusia, biaya per pengujian yang lebih rendah dengan konsumsi reagen yang berkurang serta skalabilitas yang melekat untuk produksi massal di masa mendatang.
Akhirnya, kemampuan unik dari LoC yang dirancang untuk mengisolasi EV dari berbagai biofluida, seperti air liur dan plasma darah, memungkinkan deteksi uji multipleks. Sementara perangkat mikrofluida biasanya berlaku untuk satu biofluida tunggal untuk penangkapan EV, [ 61 – 63 ] platform AIMSPec-LoC cocok untuk penangkapan dan isolasi EV multi-biofluida secara simultan, untuk memberikan gambaran umum yang lebih baik tentang status kesehatan pasien sekaligus mengurangi kebutuhan untuk beberapa pengujian yang mahal.
Efisiensi pemisahan keseluruhan LoC sebesar 92 ± 6%, dikonfirmasi oleh mikroskopi fluoresensi yang dikombinasikan dengan NTA (Gambar 2g,i ) ditemukan secara signifikan lebih tinggi daripada kromatografi pengecualian ukuran sebesar 67,7 ± 13,1% serta presipitasi berbasis polimer ≈82%. [ 64 ] Uji – t mengonfirmasi pemisahan yang signifikan secara statistik ( p** <0,01) antara populasi EV yang dikumpulkan dari saluran yang berbeda. Efisiensi pemisahan ini dapat ditingkatkan lebih lanjut setelah pengenceran (1:10) dari biofluida yang diuji, namun, ini akan mengorbankan throughput dan pengurangan proporsional dalam konsentrasi EV sampel akhir untuk analisis hilir. AIMSPec-LoC kami secara efisien memproses hingga 500 µL air liur dalam waktu 20 menit (≈1,5 mL jam −1 ), meningkat menjadi 650 µL (≈1,95 mL jam −1 ) untuk plasma darah (Gambar S1 dan S2 , Informasi Pendukung).
Sistem kami tidak bergantung pada gaya eksternal apa pun untuk isolasi EV [ 65 ] dan memiliki kemampuan unik untuk secara bersamaan mengisolasi kelompok ukuran berbeda dari EV besar, sedang, dan kecil dalam satu langkah. Ini kontras dengan “standar emas” ultracentrifugasi untuk isolasi EV, yang tidak mampu memisahkan beberapa kelompok EV secara bersamaan dan memerlukan gradien densitas lebih lanjut untuk mencapai pemurnian yang lebih tinggi. [ 30 ] Lebih jauh lagi, untuk mengatasi masalah umum dengan isolasi EV dari lipoprotein dan protein plasma yang mencemari co-elution, [ 66 ] kami menggunakan membran filter PES pengikat protein rendah, berhasil menjebak protein yang mencemari melalui filter 40 nm serta lipoprotein termasuk LDL dengan kisaran ukuran 25–35 nm. Sementara teknik tradisional seperti kromatografi pengecualian ukuran (SEC) efektif dalam menghilangkan protein, mereka tidak dapat secara efisien menghilangkan lipoprotein, memerlukan ultracentrifugasi gradien densitas untuk membantu dalam pengecualian kontaminan ini dan dengan demikian, pendekatan gabungan menderita kerugian EV yang signifikan. [ 67 , 68 ] Dalam AIMSPec-LoC, isolasi hibrida dan deteksi spektroskopi memungkinkan kemampuan multipleks sambil menghilangkan sinyal apa pun yang terkait dengan protein atau lipoprotein yang mengontaminasi. Lebih jauh, metode pengecualian ukuran sering mengalami penyumbatan dan penjebakan di membran, efisiensi yang buruk dan deformasi EV karena tekanan pra-membran. [ 69 , 70 ] Kelemahan ini dielakkan dalam AIMSPec-LoC melalui pengenalan filtrasi berurutan dengan langkah awal menggunakan filter berpori besar (5000 nm), diikuti oleh langkah-langkah filtrasi berurutan melalui filter berpori yang lebih kecil (450, 200, 100, dan 40 nm). Selain itu, menghilangkan kebutuhan akan pompa suntik eksternal atau pompa sentrifugal dan memasukkan saluran kapiler untuk mendorong aliran melalui sistem mengatasi kerusakan EV yang terkait dengan tekanan.
Mengidentifikasi dan mengkarakterisasi berbagai jenis EV dapat menjadi tantangan karena beberapa faktor termasuk ukurannya yang kecil (dengan tumpang tindih antara dua jenis utama EV, mikrovesikel dan eksosom), heterogenitas dan kurangnya metode isolasi dan karakterisasi yang terstandarisasi. Oleh karena itu, identifikasi biomarker yang terkait dengan EV dapat secara signifikan membantu dalam identifikasi dan karakterisasinya. Ini dapat memberikan karakteristik pembeda khusus EV dari partikel atau kontaminan lain dalam matriks biologis karena protein, lipid, atau asam nukleat tertentu berfungsi sebagai penanda unik untuk berbagai jenis EV (misalnya, CD9, CD63, CD82). Karena subkelompok EV menunjukkan profil biomarker yang berbeda, mengidentifikasi biomarker ini memungkinkan klasifikasi EV sambil memberikan informasi berharga tentang asal seluler, biogenesis, dan peran fungsionalnya. Selain itu, perubahan komposisi biomarker EV dikaitkan dengan berbagai penyakit. Identifikasi ini selanjutnya akan memiliki implikasi diagnostik, prognostik, serta terapeutik, dengan penelitian saat ini difokuskan pada eksplorasi potensi pemanfaatan yang terakhir untuk deteksi dini dan pemantauan penyakit seperti kanker, gangguan neurodegeneratif, dan penyakit kardiovaskular. Untuk lebih memvalidasi isolasi subkelompok EV, panel biomarker EV yang diketahui dianalisis (Gambar S3 dan S4 , Informasi Pendukung) untuk memperoleh sidik jari spektral Raman dan membandingkan tanda-tandanya dengan EV yang diisolasi dan dipisahkan melalui AIMSPec-LoC.
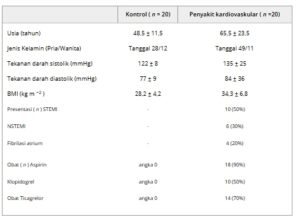
AIMSPec-LoC yang direkayasa secara mikro kemudian divalidasi melalui analisis sampel yang relevan secara klinis. Sidik jari biokimia EV yang berasal dari plasma darah dan air liur yang berkorelasi dengan CVD diselidiki melalui spektroskopi Raman. Melalui pemeriksaan SKiNET berikutnya terhadap pergeseran spektralnya, yang dihasilkan dari frekuensi getaran molekuler molekul tertentu termasuk asam amino, lemak dan nukleat, status penyakit pasien telah ditentukan. Plasma darah klinis dikumpulkan sebagai bagian dari studi CASCADE (Ref. Etika 19 /SW/0010), menyediakan sampel dari subjek CVD dan kontrol sehat ( Tabel 1 ) dengan EV berikutnya yang dikumpulkan dari LoC secara langsung dideteksi dan dianalisis melalui spektroskopi Raman (10 × 10µm 2 area sampel, laser 785 nm). Secara keseluruhan, total 4000 pengukuran dikumpulkan dari sampel plasma darah kelompok CVD ( n = 20), 20 relawan sehat bertindak sebagai kelompok kontrol (Metode).
Tabel 1. Demografi yang membandingkan parameter epidemiologi dan klinis pasien CVD.
Analisis SkiNET ANN tingkat lanjut pada EV yang dikumpulkan dari plasma darah pasien CVD mengungkapkan klaster yang terpisah dengan jelas, merangkum perbedaan spektral halus dari spektrum sidik jari molekuler, yang secara efektif membedakan tiga subkelompok EV dari plasma darah mentah ( Gambar 3 c ). Dalam SkiNET, yang terinspirasi oleh korteks visual di otak, SOM dilatih agar neuron di sekitarnya aktif menurut masukan serupa, yaitu spektrum Raman. Setiap neuron memiliki vektor bobot dengan panjang yang sama dengan jumlah variabel dalam spektrum. Dengan menundukkan jaringan pada sampel pelatihan selama sejumlah iterasi, bobot secara bertahap disesuaikan agar menjadi serupa dengan data masukan, untuk memfasilitasi aktivasi satu-satunya neuron untuk tanda spektral yang unik. Ini menghasilkan proyeksi data hiperspektral ke dalam ruang 2D, yang ditampilkan sebagai pengelompokan yang terlihat menurut kelas, misalnya, sampel, jenis penyakit, atau tingkat keparahan. SKiNET secara inheren terdiri dari SOMDI, yang menambahkan serangkaian vektor label ke setiap neuron dan memungkinkan untuk mengidentifikasi fitur paling menonjol yang menyebabkan aktivasi neuron tertentu ke label kelas. Semakin tinggi intensitas SOMDI, semakin besar pentingnya sentimeter terbalik tertentu di sepanjang sumbu spektrum. Selanjutnya, langkah pembelajaran terbimbing diperkenalkan untuk mengoptimalkan jaringan dan label kelas yang terkait dengan setiap neuron dengan cepat mengidentifikasi data baru yang disajikan ke SOM, menghasilkan informasi yang kaya dan spesifisitas klasifikasi tinggi secara bersamaan, bahkan untuk daya laser rendah dan waktu akuisisi singkat, yang mewakili pengaturan diagnostik dunia nyata. Neuron (segi enam) diwarnai menurut kelas modal yang diaktifkannya dari set pelatihan spektrum Raman dan neuron yang tidak memiliki kelas mayoritas atau tidak memiliki aktivasi dari data pelatihan muncul sebagai warna putih di SOM. Kombinasi RS dengan SKiNET untuk menyelidiki status penyakit pasien, mengidentifikasi fitur spektral mana, yang setara dengan perubahan biokimia, yang bertanggung jawab untuk pengelompokan dan dengan cepat me

Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Deteksi Spektral dan Diferensiasi Penyakit Kardiovaskular dari EV Plasma Darah. a). Ilustrasi kerusakan yang terjadi pada jantung setelah infark miokard dengan prosedur pemasangan stent yang khas ditunjukkan. Angiogram koroner (sisipan) biasanya digunakan untuk diagnosis klinis CVD. b). Uji protein BCA yang menunjukkan perbedaan konsentrasi protein pada setiap langkah filtrasi yang menunjukkan 3 subkelompok EV utama: EV besar, EV tengah, EV kecil, dan plasma darah mentah. c). SOM (sisipan)/SOMDI dari EV yang diklasifikasikan dengan akurasi 96,5 ± 0,4%. Subklasifikasi menurut subkelompok EV diwakili oleh segi enam biru untuk plasma darah mentah, merah untuk EV besar, hitam untuk EV tengah, dan merah untuk EV kecil. Spektrum Raman rata-rata representatif dari subkelompok EV yang sehat dan CVD (tidak sehat) dari d) EV besar, EV tengah, dan EV kecil.(e,f). Plot kotak dan kumis menggambarkan nilai minimum, maksimum, rentang interkuartil, kumis, dan median pada intensitas puncak yang diidentifikasi melalui SOMDI sebagai yang memiliki efek terbesar pada pengklasifikasi, yaitu, perubahan spektral yang paling penting dengan perubahan terbesar yang teramati sebesar 851, 960, 1003, dan 1657cm −1 . g) Sidik jari spektral Raman representatif dari berbagai biomarker yang menunjukkan penyakit kardiovaskular yang menarik, termasuk apolipoprotein B (ApoB), lipoprotein A (LpA), proprotein konvertase subtilisin/kexin tipe 9 (PSCK9), protein C-reaktif (CRP), d-dimer, interleukin-9 (IL-9), mieloperoksidase (MPO), faktor nekrosis tumor-alfa (TNF-α), copeptin, galectin-3, faktor pertumbuhan dan diferensiasi-15 (GDF-15), matriks metaloproteinase 9 (MMP9), peptida natriuretik tipe pro-B N-terminal (NT-proBNP), supresi tumorigenisitas 2 (ST2), interleukin-6 terlarut (SIL-6) dan peptida natriuretik atrium (ANP). Kode batang molekuler karakteristik yang diperoleh dari spektrum sidik jari rata-rata yang sesuai dengan diferensiasi spektral antara subkelompok EV dari h) plasma darah mentah, i) EV tengah, j) EV besar dan k) EV kecil.
Selanjutnya, kami melaksanakan profiling EV untuk memperoleh informasi tingkat molekuler termasuk komposisi EV serta mengidentifikasi biomolekul yang spesifik untuk EV, misalnya, lipid, protein dan asam nukleat. Ketika CVD terjadi secara klinis, metabolit dan kandungan protein dalam plasma darah dan air liur meningkat dan puncak spektroskopi yang menunjukkan perubahan ini dalam korelasi dalam spektrum yang terdeteksi. Intensitas puncak utama yang diinginkan pada 960, 1003, 1136 dan 1657cm −1 selanjutnya dapat digunakan tidak hanya untuk diferensiasi CVD tetapi juga, untuk memantau kemajuan pasca kejadian jantung atau inflamasi karena rasio puncak karakteristik berubah tergantung pada status patologis (Gambar 3a ), terlihat dari stenting yang diperoleh. Kami menggunakan AIMSPec-LoC hibrid dengan AI untuk menilai data profil spektroskopi pasien dan menganalisis kemampuan untuk membedakan CVD dari EV yang beredar dalam plasma darah, sambil mengidentifikasi perubahan biokimia yang mendasari yang terkait dengan penyakit tersebut (Gambar 3d–f ). Dari SOM/SOMDI kami menentukan akurasi klasifikasi intrinsik sebesar 97,1% untuk EV besar, 98,1% untuk EV tengah, dan 100% untuk EV kecil, yang dengan jelas membedakan antara CVD dan kelompok sehat ( Tabel 2 ).
Tabel 2. Diferensiasi Penyakit CVD melalui EV. Performa dan akurasi klasifikasi pasien sehat dan CVD dalam plasma darah dibandingkan dengan kontrol sehat termasuk sensitivitas, spesifisitas, nilai prediksi positif (PPV) dan nilai prediksi negatif (NPV).
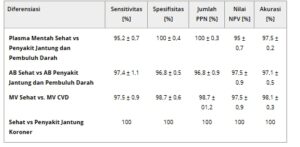
Untuk mengevaluasi diskriminasi populasi EV yang berbeda dalam sampel plasma darah pasien pasca kejadian jantung, spektrum yang diperoleh diberi kode batang melalui puncak dominan dari intensitas tertinggi dan perbedaan spektral, membandingkan antara kohort CVD dan kontrol (Gambar 2 j–m). Lebih jauh ke spektrum rata-rata, fitur spektral yang diekstraksi SOMDI (Gambar 3c ) yang paling menonjol , yang bertanggung jawab atas pengelompokan yang diamati dalam SOM (Gambar 3c , sisipan) mencakup 759, 785, 882, 960, 1003, 1124, 1131, 1307, 1336, 1440, 1600, dan 1657cm −1 . Dengan atribusi biokimia terperinci dari puncak-puncak ini, yang dirangkum dalam Tabel 3 , perubahan karakteristik yang paling menonjol dikaitkan dengan asam nukleat (720–820cm −1 ), fenilalanin (1003cm −1 ), tulang punggung glisin dan rantai samping prolin (1341–1348cm −1 ) dan penanda lipid dan protein dari kelompok CH dan CH 2 (1440cm −1 ), sedangkan protein, lipid dan asam amino mendominasi spektrum keseluruhan, sesuai dengan literatur tentang variasi muatan dalam subkelompok EV. [ 42 , 71 , 19 , 72 , 73 ]
Tabel 3. Spektroskopi Raman mendeteksi penugasan puncak spektral dominan dan karakteristik. [ 19 , 71 , 72 ]

Perbedaan utama lebih lanjut memberikan wawasan ke dalam pemisahan subkelompok yang terdeteksi serta plasma darah mentah pasien CVD (Gambar 3c / S5 dan S6 , Informasi Pendukung) dengan perbedaan intensitas utama yang terdeteksi pada 960cm −1 (struktur polisakarida), 1003cm −1 (fenilalanin), 1341 m −1 (tulang punggung glisin), 1440cm −1 (lipid dan protein) dan 1656cm −1 (Amida I/lipid). Untuk EV yang disaring, fraksi akhir yang mengandung EV kecil menghasilkan intensitas puncak yang secara signifikan lebih rendah pada 1440cm −1 namun intensitas yang meningkat pada 1341cm −1 ( p ***<0,0001), yang dikaitkan dengan tulang punggung glisin, sementara masing-masing dari tiga subkelompok EV menunjukkan puncak lipid dan protein yang kurang intens, yaitu, 1440 dan 1656 cm −1, daripada plasma darah mentah. Penurunan yang signifikan juga diukur dalam konsentrasi protein pada setiap langkah filtrasi berikutnya dalam LoC, yang berkaitan dengan plasma darah mentah, EV besar, sedang dan kecil (Gambar 3b ). Plasma darah diketahui mengandung berbagai macam protein termasuk albumin, faktor pembekuan, enzim dan hormon serta berbagai protein lain yang terlibat dalam respons imun, transportasi, dan regulasi. [ 74 ] Di sisi lain, kandungan protein EV bervariasi tergantung pada jenis dan kondisi sel dan ini diketahui membawa subset protein yang berasal dari sel asal mereka dengan muatan yang terlibat dalam komunikasi antar sel dan pensinyalan sel-ke-sel. Sementara EV dapat mengandung beragam protein, mereka biasanya hadir dalam konsentrasi yang jauh lebih rendah dibandingkan dengan plasma darah [ 75 ] (Gambar 3b ). Di antara tiga subkelompok EV, EV kecil menunjukkan puncak paling tidak kuat yang dikaitkan dengan protein sedangkan EV besar, yang paling intens. EV besar, seperti badan apoptosis dilepaskan selama kematian sel terprogram, yaitu apoptosis, dan ukurannya lebih besar dibandingkan dengan subkelompok EV lainnya dan mengandung beragam protein yang berasal dari sel yang sekarat. [ 25 , 76 ] EV kecil, seperti eksosom, yang jauh lebih kecil dan dibentuk oleh tunas ke dalam badan multivesikular, juga mengandung protein lebih lanjut termasuk, protein membran dan sitosol. Namun, mereka umumnya memiliki tingkat protein yang lebih rendah dibandingkan dengan badan apoptosis yang lebih besar karena ukurannya dan pengemasan kargo yang selektif selama biogenesisnya, yang sesuai dengan kandungan protein yang terukur lebih sedikit. [ 76 – 78 ]
Penentuan konsentrasi protein total dari subkelompok tertentu lebih lanjut berguna dalam menilai efisiensi pemisahan LoC yang dirancang untuk isolasi EV. Konsentrasi protein yang lebih tinggi dalam fraksi yang tertahan menunjukkan penangkapan dan pengayaan subkelompok yang lebih baik dan dengan demikian, efisiensi perangkat LoC yang lebih tinggi dalam mengisolasi populasi EV tertentu. Sebaliknya, jika konsentrasi protein serupa di kedua fraksi, itu menunjukkan keterbatasan dalam efisiensi pemisahan untuk subkelompok yang ditargetkan. Dalam AIMSPec-LoC, saat vesikel melewati platform, konsentrasi protein keseluruhan menurun, yang menunjukkan pemisahan berbasis ukuran yang efektif. Untuk lebih lanjut mengatasi tantangan yang terkait dengan isolasi dan pemisahan EV karena kontaminasi, LoC dirancang untuk memungkinkan protein yang mengontaminasi mengalir dan karena mayoritas lebih kecil dari EV, kontaminan ini kemudian terperangkap oleh filter 40 nm. Hal ini menghasilkan pemisahan kontaminan yang berhasil karena konsentrasi protein keseluruhan telah menurun selama plasma darah melewati setiap langkah penyaringan (Gambar 3b ), sesuai dengan efisiensi pemisahan 92% yang dihitung melalui kombinasi mikroskop fluoresensi dan NTA (Gambar 2i ).
Perbedaan signifikan secara statistik lebih lanjut ditemukan untuk pita dominan pada 1124, 1440, dan 1656cm −1 ( p ***<0,0001) yang diasosiasikan dengan lipid pada intensitas yang menurun pada EV dibandingkan dengan plasma darah mentah, dengan EV kecil menunjukkan level terendah (Gambar 3g,h ). Plasma darah mengandung berbagai macam lipid, termasuk trigliserida, kolesterol, fosfolipid, dan asam lemak, yang penting untuk fungsi fisiologis termasuk penyimpanan energi, struktur membran, dan pensinyalan. [ 74 ] Sebaliknya, ketika EV diisolasi, metode spesifik yang digunakan untuk memisahkan vesikel dari sebagian besar plasma darah biasanya menghilangkan lipid yang tidak diasosiasikan dengan EV, sehingga menghasilkan kandungan lipid yang relatif lebih rendah pada EV yang diisolasi dibandingkan dengan plasma mentah. [ 31 ] Pita pada 882cm −1 (fosfatidilkolin) dan 1553cm −1 (triptofan) menunjukkan peningkatan intensitas yang signifikan pada subkelompok EV relatif terhadap plasma darah mentah. Dikombinasikan dengan perubahan yang diamati pada puncak protein dan lipid (yaitu, 1124, 1440, 1656cm −1 ), pita ini dapat digunakan sebagai penanda spektral untuk karakterisasi EV, yang juga akan membantu dalam pengembangan studi lebih lanjut untuk menilai utilitas klinis dari teknologi yang dikembangkan.
Perbedaan spektrum EV yang menunjukkan penyakit ditemukan bervariasi secara signifikan dengan spektrum Raman representatif dari EV sehat dan EV yang berasal dari CVD untuk setiap subkelompok yang menunjukkan perubahan intensitas utama (Gambar 3d–f ). Baik EV tengah maupun EV kecil, menunjukkan peningkatan intensitas yang signifikan (≈17–68%) ( p **<0,001) dalam kelompok CVD pada pita 752cm −1 (asam nukleat), 851cm −1 (tirosin), 960cm −1 (struktur polisakarida), 1144cm −1 (lipid), 1440cm −1 (lipid dan protein) dan 1656cm −1 (Amida I/lipid) dengan peningkatan tambahan pada 1003cm −1 untuk EV kecil. Meningkatnya intensitas asam nukleat (Gambar 3e,f ) dapat dikaitkan dengan EV yang mewakili mekanisme komunikasi intraseluler penting melalui penahanan dan pengangkutan molekul bioaktif seperti protein dan asam mikroribonukleat (miR) ke sel target. [ 14 , 79 , 80 ] Oleh karena itu, EV memberikan efek yang menguntungkan, netral, atau berbahaya pada sel penerima, yang mencakup modulasi ekspresi gen dan memengaruhi jalur molekuler. Dalam kasus penyakit kardiovaskular, EV dapat dilepaskan oleh sel-sel yang berhubungan dengan kardiovaskular seperti trombosit, monosit, leukosit, dan kardiomiosit [ 8 ] dan mampu menginduksi perubahan patologis yang terkait dengan CVD karena komposisi protein dan miR yang ditransfer oleh EV, yang menjaga keseimbangan kardiovaskular, dapat diubah sehingga menimbulkan perkembangan CVD. [ 81 ] Pasien dengan CVD sering menunjukkan peningkatan kadar asam nukleat yang bersirkulasi dalam darah mereka, yang mengakibatkan pengemasannya di dalam EV dan pelepasan selanjutnya ke aliran darah. [ 82 ]
Peningkatan intensitas asam amino tirosin yang terdeteksi pada EV turunan CVD mengindikasikan peningkatan risiko CVD yang terkait. Tirosin adalah prekursor katekolamin, yang menyebabkan tekanan darah tinggi jika ditemukan dalam kadar yang meningkat di dalam tubuh. [ 83 ] Penelitian sebelumnya telah menunjukkan bahwa tirosin menyebabkan takikardia dan hipertensi dalam dosis kecil, sedangkan pada dosis yang lebih besar terjadi kebalikannya, yaitu bradikardia dan hipotensi. [ 84 ] Yang terkait erat dengan efek peningkatan kadar tirosin pada CVD adalah peningkatan konsentrasi fenilalanin. Pada dua subkelompok EV yang diselidiki, kami menemukan kedua puncak pada 1003cm −1 yang terkait dengan fenilalanin serta 851cm −1 yang terkait dengan tirosin meningkat pada pasien CVD. Peradangan dan aktivasi imunologi secara langsung terkait dengan timbulnya dan perkembangan CVD, dengan indikasi bahwa mereka selanjutnya menghambat konversi fenilalanin menjadi tirosin pada individu dengan gangguan klinis. Secara intrinsik, peningkatan konsentrasi fenilalanin dan rasio fenilalanin-tirosin yang lebih tinggi telah dikaitkan dengan penanda imunologi [ 85 ] dengan demikian, menunjukkan potensi biomarker spektral CVD. Perbedaan yang diamati dalam intensitas setiap subkelompok EV dibandingkan dengan plasma darah mentah untuk tirosin dan fenilalanin menunjukkan komposisi biokimia yang berbeda dari EV yang diisolasi melalui LoC. Sementara kadar asam amino dalam plasma telah digunakan untuk deteksi dini dan diagnosis penyakit seperti kanker serviks, kanker pankreas dan diabetes tipe 2, kadar asam amino yang berbeda dalam EV hanya dilaporkan dalam EV kecil yang dianalisis dengan kromatografi cair kinerja tinggi dengan fluoresensi, [ 86 ] di mana perbedaan yang jelas diamati antara EV kecil dan komposisi asam amino serum asli. Yang menarik, dalam penelitian oleh Onozata et al., histidin, arginin, asam glutamat, sisteina, lisin, dan tirosin ditemukan meningkat secara signifikan ( p *<0,05) dalam eksosom, yang menunjukkan bahwa asam amino tertentu diperkaya dalam eksosom. Kami juga telah mengidentifikasi peningkatan paling signifikan dalam asam amino (tirosin dan fenilalanin) dalam fraksi yang terkait dengan eksosom, sesuai dengan penelitian oleh Onozato et al. [ 86 ] Selain itu, puncak 1553cm −1 yang terkait dengan triptofan telah menunjukkan intensitas yang menurun secara signifikan ( p *<0,05) dalam plasma darah CVD di masing-masing dari tiga subkelompok EV. Pemecahan triptofan menjadi metabolit hilir dipercepat pada awal CVD melalui interferon- γ-peradangan yang dimediasi. [ 87 ] Yu et al. menentukan bahwa penurunan risiko CVD sangat berkorelasi dengan peningkatan kandungan triptofan plasma, sejalan dengan temuan yang disajikan di sini, dimana triptofan berhubungan terbalik dengan kejadian CVD. [ 88 ]
Untuk mengkategorikan lebih lanjut dan menentukan penanda molekuler spesifik penyakit dalam EV, RS digunakan untuk membuat profil dan mengklasifikasikan panel biomarker indikasi CVD. Panel biomarker CVD yang teridentifikasi termasuk apolipoprotein B (ApoB), lipoprotein A (LpA), proprotein konvertase subtilisin/kexin tipe 9 (PSCK9), protein C-reaktif (CRP), d-dimer, interleukin-9 (IL-9), mieloperoksidase (MPO), faktor nekrosis tumor-alfa (TNF-α), copeptin, galectin-3, faktor pertumbuhan dan diferensiasi-15 (GDF-15), matriks metaloproteinase 9 (MMP9), peptida natriuretik tipe pro-B terminal-N (NT-proBNP), supresi tumorigenisitas 2 (ST2), interleukin-6 terlarut (SIL-6) dan peptida natriuretik atrium (ANP) dipilih berdasarkan spesifisitasnya untuk CVD dan respons fisiologis yang diketahui pada pasien. Sidik jari spektral Raman rata-rata yang diperoleh dari panel biomarker ini ditunjukkan pada Gambar 3i . Sidik jari spektral dari yang sehat dibandingkan dengan yang CVD dengan ApoB, LpA, NT-ProBNP, PCSK9 dan IL-9 menunjukkan perbedaan yang signifikan secara statistik ( p *<0,05) dengan peningkatan kadar setiap penanda pada EV yang berasal dari CVD, yang kemungkinan besar disebabkan oleh aterosklerosis yang mempengaruhi arteri koroner, terutama dipengaruhi oleh kolesterol dan khususnya, kolesterol lipoprotein densitas rendah (LDL-C). Hal ini semakin diperkuat dengan keberhasilan obat penurun LDL-C, seperti statin serta studi Mendelian randomization, yang secara jelas menunjukkan peran kausatif LDL-C dalam penyakit kardiovaskular. [ 89 , 90 ] Misalnya, Leander et al., mengidentifikasi peran signifikan PCSK9 dalam regulasi LDL-C dan dengan demikian, menunjukkan potensi PCSK9 terlarut untuk bertindak sebagai indikator risiko penyakit kardiovaskular yang baru. [ 91 ] Lebih jauh, LpA, ApoB dan PCSK9 menunjukkan peningkatan intensitas pada 1315cm −1 dan juga antara 1200–1340cm −1 yang dikaitkan dengan lipid dan peningkatan regulasi Amida I (1600–1655cm −1 ) yang teridentifikasi pada NT-ProBNP (≈18%), IL-9 (≈14%) dan LpA (≈32%), menunjukkan peran penting lipid dan sitokin dalam timbulnya CVD dan menunjukkan potensinya sebagai indikator penting penyakit kardiovaskular (Tabel S1–S4 , Informasi Pendukung). Lebih jauh, melalui penerapan SKiNET dalam klasifikasi data, kode batang spektral dari subkelompok EV yang sehat dan sakit untuk CVD telah diturunkan dari spektrum sidik jari rata-rata yang sesuai yang dipilih dari pita dengan intensitas dan signifikansi tertinggi (Gambar 3j–m ) dengan fitur yang diekstraksi SOMDI dari SOM, yang menyoroti puncak Raman yang paling berpengaruh untuk setiap kelas. Ini menetapkan kode batang multipleks dari matriks biologis yang kompleks berdasarkan tanda tangan spektral yang berbeda yang dikombinasikan dengan algoritma SKiNET komputasional untuk klasifikasi cepat, melalui fitur-fitur utama dari analisis spektral yang direpresentasikan secara visual dalam peta Raman berwarna, yang menyediakan metode yang selektif dan sensitif untuk mendeteksi CVD. Selain EV plasma darah yang menawarkan peran instrumental dalam diagnosis penyakit, EV yang diisolasi dari air liur memiliki potensi diagnostik lebih lanjut yang penting, terutama karena karakteristiknya yang non-invasif dan mudah diakses. Sifat serbaguna dari AIMSPec-LoC yang dikembangkan yang mudah beradaptasi dengan biofluida yang berbeda, membuka jalan dalam diagnosis yang berhasil, dan pemantauan penyakit lebih lanjut. Kami menggunakan kurva receiver operating Characteristics (ROC) untuk menilai diferensiasi plasma darah sehat dan CVD serta saliva sehat dan IBD untuk setiap subkelompok EV dengan menghitung area di bawah kurva (AUC), memetakan rasio positif benar versus rasio negatif salah ( Gambar 4 ). Dari kurva ROC kami menentukan akurasi klasifikasi intrinsik dalam plasma darah yang berasal dari CVD sebesar 99% untuk EV kecil (Gambar 4a ), 95% untuk EV tengah (Gambar 4b ), 92% untuk EV besar (Gambar 4c ), dengan jelas membedakan antara kelompok sehat dan sakit, yang sangat penting untuk mengklasifikasikan CVD. Untuk dicatat, pendakian ROC yang curam dengan lintasan yang konsisten menuju sudut kiri atas, menunjukkan rasio positif palsu yang minimal sambil memaksimalkan prediksi positif benar dari klasifikasi. Ini penting ketika menilai model diagnostik atau prediktif, karena indikasi kemampuan untuk secara akurat mendeteksi kasus dan status penyakit yang relevan. AUC yang dihitung secara keseluruhan berkisar dari 0,92 hingga 0,99 dengan nilai yang lebih tinggi ditunjukkan untuk subkelompok EV eksosom dalam plasma dan saliva, sejalan dengan akurasi klasifikasi SOM (Gambar 3c ) dengan akurasi klasifikasi >96%. Nilai AUC ini menggarisbawahi kekokohan AIMSPec-LoC gabungan kami dengan klasifikasi AI intrinsik, yang menunjukkan kemampuan diskriminatif yang akurat, khususnya berharga dalam aplikasi diagnostik, di mana presisi dan spesifisitas merupakan hal yang sangat penting. Melalui kode batang spektral dari set data, masing-masing berfungsi sebagai sidik jari spektral, yang memungkinkan identifikasi dan karakterisasi biokimia individual tanpa memerlukan pengetahuan sebelumnya atau sampel referensi. Ini juga memungkinkan diferensiasi spesies yang berkerabat dekat dengan pita Raman yang sama serta setiap perubahan dalam kode batang, yang mungkin disebabkan oleh perkembangan penyakit atau interaksi obat, yang memperkuat kesesuaian AIMSPec-LoC untuk mendeteksi dan memantau keadaan pasien yang sakit secara non-invasif.

Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Plot ROC yang Mewakili Sensitivitas versus Spesifisitas 1. Plot ROC yang diperoleh dari penugasan pasca probabilitas diterapkan untuk menentukan keberhasilan dalam mengklasifikasikan plasma darah sehat dan yang berasal dari CVD untuk a) EV kecil, b) EV sedang, dan c) EV besar. AUC menunjukkan bahwa perubahan kadar protein dan lipid dari plasma dan EV yang berasal dari saliva merupakan penanda yang berharga untuk membedakan EV sehat dari EV yang menunjukkan CVD dengan EV yang menunjukkan CVD menunjukkan kinerja yang sangat baik dengan AUC sebesar 0,99 (95% CI 0,99–1,0), 0,95 (95% CI 0,94–0,96) dan 0,92 (95% CI 0,81–1,03) untuk EV kecil, EV sedang, dan EV besar.
Banyak penelitian sebelumnya bertujuan untuk mengkarakterisasi EV berdasarkan ukuran dan asal, menggunakan berbagai metodologi termasuk, sentrifugasi diferensial, ultracentrifugasi gradien densitas, NTA, DLS, flow cytometry, dan proteomik dan lipidomik berbasis spektrometri massa. [ 92 – 97 ] Beberapa metode telah berhasil mengonfirmasi heterogenitas populasi EV, dengan beberapa menunjukkan perbedaan fungsional berdasarkan ukuran. Misalnya, Kowal et al. mengidentifikasi muatan protein yang berbeda antara EV kecil dan besar yang diisolasi melalui sentrifugasi. [ 98 ] Mereka mengidentifikasi MHC I dan MHC II di semua EV, GP96 dan kemungkinan protein terkait ER lainnya sebagian besar hadir di EV besar, aktinin-4 dan mitofilin hadir di EV besar dan menengah tetapi tidak ada di EV kecil dan syntenin-1, TSG101, ADAM10, dan EHD4 hanya hadir di EV kecil dengan syntenin-1 dan TSG101 spesifik untuk EV kecil yang diperkaya tetraspanin yang mewakili eksosom. Demikian pula, Lischnig et al. juga mengidentifikasi berbagai protein yang diperkaya di EV kecil atau besar. [ 99 ] Penulis juga mengidentifikasi tetraspanin, ADAM, dan protein ESCRT diperkaya di EV kecil sedangkan protein ribosom, mitokondria, dan sitokinesis diperkaya di EV besar dengan demikian, menunjukkan penanda protein untuk EV besar dan kecil. juga menyarankan bahwa vesikel mungkin berbeda dalam ekspresi tetraspanin atau kandungan lipid. [ 100 ] Namun, mayoritas studi EV bergantung pada metode isolasi dan karakterisasi massal yang tidak memiliki resolusi untuk membedakan perbedaan biokimia pada tingkat subpopulasi EV individu, dan sering tidak dapat menilai beberapa modalitas molekuler secara bersamaan (misalnya, protein, lipid, dan asam amino). Selain itu, teknik seperti flow cytometry, meskipun berguna untuk deteksi penanda permukaan, dibatasi oleh kebutuhan untuk pelabelan, sensitivitas yang buruk untuk EV kecil (<200 nm) dan dapat menimbulkan bias terhadap penanda yang telah dipilih sebelumnya, oleh karena itu subtipe vesikel yang tidak berkarakterisasi atau minor dapat dikecualikan. [ 101 ] Sebaliknya, penelitian yang disajikan di sini menggunakan RS bebas label untuk menilai komposisi molekuler intrinsik EV kecil, sedang, dan besar, yang mengungkap perbedaan biokimia yang signifikan di antara subkelompok ini dalam hal fitur spektrum protein, lipid, dan asam amino. Tidak seperti pendekatan sebelumnya yang sering kali berfokus pada ukuran atau penanda permukaan tertentu, RS memungkinkan analisis “sidik jari” molekuler keseluruhan dari setiap populasi EV dalam keadaan yang diproses secara minimal. Yang penting, kami mengamati bahwa EV kecil, sedang, dan besar tidak hanya berbeda dalam tanda tangan spektrum Raman mereka, yang menunjukkan heterogenitas komposisi, tetapi masing-masing subkelompok ini juga menunjukkan perubahan intensitas Raman yang berbeda antara sampel plasma yang sehat dan CVD. Pemisahan berlapis multipleks ini – baik dalam ukuran maupun keadaan sakit – melampaui sebagian besar dari apa yang telah dilaporkan sebelumnya di mana sering kali populasi EV massal dari donor yang sakit dan sehat dievaluasi tanpa menyelesaikan heterogenitas dalam populasi. Selain itu, penelitian proteomik seperti yang dilakukan oleh Goetzl et al. dan Freeman et al. telah mengidentifikasi perubahan terkait penyakit pada muatan protein EV, namun analisis tersebut biasanya memerlukan pemrosesan ekstensif, volume sampel lebih besar, dan tidak mengkorelasikan temuan dengan ukuran EV. [ 102 , 103 ] Di sini, analisis Raman menangkap perbedaan biokimia yang terkait dengan CVD di seluruh populasi EV yang diselesaikan ukuran tanpa perlu pelabelan, fraksinasi, atau pengayaan sebelumnya, dan perbedaan spektral yang diamati sesuai dengan perubahan terkait penyakit yang diharapkan, seperti peningkatan puncak terkait lipid dan intensitas asam amino yang berubah, yang sebelumnya telah dilaporkan dalam profil plasma CVD. Lebih jauh, penggabungan ML ke dalam analisis spektral yang disajikan di sini memungkinkan klasifikasi subtipe EV dan status penyakit dengan akurasi tinggi. Teknik karakterisasi tradisional seperti NTA dan DLS yang berfokus pada parameter fisik murni tidak memiliki wawasan molekuler tersebut. Dengan menggabungkan data spektral berdimensi tinggi dengan ML, pola bernuansa yang memberikan wawasan mekanistik ke dalam biologi EV dan potensi utilitas klinis dalam diagnostik dan pemantauan dapat diungkap. Sementara pendekatan konvensional seperti flow cytometry dan proteomik telah menunjukkan kegunaan dalam karakterisasi EV, pendekatan tersebut sering kali menunjukkan sensitivitas yang lebih rendah untuk deteksi penyakit tahap awal dan memerlukan protokol multi-langkah yang kompleks. Sebaliknya, platform AIMSPec-LoC kami mencapai akurasi diagnostik >97% di seluruh subtipe EV, mengungguli banyak alat yang ada dalam hal kecepatan dan resolusi, terutama untuk EV kecil yang tidak terdeteksi dengan baik oleh flow cytometry (<200 nm). Lebih jauh lagi, integrasi spektroskopi Raman dengan teknologi lab-on-a-chip menawarkan solusi yang ringkas dan dapat diskalakan yang cocok untuk diagnostik point-of-care secara real-time, sedangkan sebagian besar metode konvensional kurang portabilitas dan terbatas pada pengaturan laboratorium khusus. 3 Kesimpulan Penyakit kardiovaskular sering didiagnosis hanya setelah kejadian akut yang mengancam jiwa seperti infark miokard atau stroke. Hal ini menggarisbawahi kebutuhan mendesak akan teknologi yang mampu mendeteksi perubahan biokimia halus yang mendahului kejadian ini, sehingga memungkinkan diagnosis dan intervensi dini. Studi kami mengatasi kesenjangan kritis ini dengan menghadirkan platform baru, AIMSPec-LoC, untuk isolasi dan analisis EV secara bersamaan, yang semakin dikenal sebagai biomarker yang kuat untuk CVD tahap awal. AIMSPec-LoC mencapai pemisahan dan analisis subtipe EV secara bersamaan, termasuk EV besar, sedang, dan kecil tanpa memerlukan praproses sampel yang ekstensif. Inovasi ini menjaga integritas dan muatan EV, memungkinkan pembuatan profil molekuler real-time yang multipleks. Dengan memberikan karakterisasi subpopulasi EV yang komprehensif dan tanda biokimianya dalam alur kerja tunggal yang efisien, platform ini memberikan wawasan baru yang substansial ke dalam patofisiologi CVD. Yang terpenting, AIMSPec-LoC menunjukkan kinerja diagnostik yang luar biasa, mencapai >96% sensitivitas dan spesifisitas dalam pendeteksian penanda EV spesifik penyakit di berbagai biofluida, yang menggarisbawahi relevansi klinis dan potensi translasinya. Desain platform memungkinkan skalabilitas untuk mengakomodasi volume sampel yang lebih besar, meningkatkan penerapannya untuk berbagai kebutuhan diagnostik. Lebih jauh lagi, integrasi dengan algoritma Raman genggam dan pembelajaran mesin yang canggih, seperti SKiNET, memungkinkan pembuatan kumpulan data berkode batang berdimensi tinggi, memfasilitasi pembuatan profil molekuler multipleks dan klasifikasi biomarker terkait EV yang kuat. Kemampuan ini tidak hanya mempercepat penemuan mekanisme penyakit tetapi juga menawarkan jalur menuju pemantauan perkembangan penyakit dan respons terapeutik secara real-time.
AIMSPec-LoC merupakan kemajuan teknologi yang signifikan dalam diagnostik non-invasif, yang mengatasi keterbatasan kritis pendekatan konvensional seperti biopsi jaringan dengan mengurangi ketidaknyamanan pasien dan meningkatkan keselamatan. Kemampuannya untuk menilai biomarker EV secara kuantitatif pada tahap awal penyakit kardiovaskular menjanjikan kemajuan dalam pengambilan keputusan klinis, memungkinkan intervensi terapeutik lebih awal, dan meningkatkan hasil pasien.
Karya ini menetapkan kerangka dasar untuk pengembangan pengukuran klinis in-vivo di masa mendatang menggunakan perangkat AIMSPec-LoC portabel. Di luar CVD, fleksibilitas platform ini memposisikannya sebagai alat yang berharga untuk ilmu dasar dan translasi tepat waktu yang terkait dengan interaksi kompleks antara organ dalam gagal jantung, penyakit kardiometabolik, dan multimorbiditas termasuk misalnya sumbu usus-jantung, interaksi neuro-jantung, respons imun, dan dampak penuaan pada hubungan organ. Kemampuan adaptasi AIMSPec-LoC terhadap beragam biomarker menawarkan potensi yang belum dimanfaatkan untuk meningkatkan akurasi diagnostik dan hasil pasien di seluruh spektrum kondisi jantung yang luas. Dengan memungkinkan intervensi tepat waktu, teknologi ini berpotensi untuk secara signifikan mengurangi morbiditas dan mortalitas yang terkait dengan CVD yang merusak, yang pada akhirnya mengubah manajemen perawatan kesehatan global.
4 Bagian Eksperimen
Sampel Klinis
Partisipan studi direkrut melalui Pusat Penelitian Penyakit Radang Usus dan Kardiovaskular di Rumah Sakit Ratu Elizabeth Birmingham (Inggris) sebagai bagian dari studi CASCADE dan TRAFIC) (Ref. Etika 19/SW/0010). Persetujuan tertulis diterima dari partisipan atau kuasa yang sah (keluarga atau profesional yang tidak terlibat langsung dalam studi) sebelum dimasukkan dalam studi. Studi ini disetujui oleh Layanan Etika Penelitian Nasional (referensi Komite Etika Penelitian RRK6508 dan ERN_22_0290). Baik studi TRAFIC maupun CASCADE mematuhi pedoman Deklarasi Helsinki. Sampel diperoleh dari klasifikasi CVD standar yang diterima secara luas berdasarkan kriteria klinis, yaitu panel darah lengkap serta didukung oleh pemindaian di rumah sakit termasuk elektrokardiogram untuk diagnosis CVD. Pasien dikategorikan menjadi HV, CVD. Semua pasien disesuaikan jenis kelamin dan usianya dengan HV. Demografi pasien ditunjukkan pada Tabel 1 . Sampel darah dari pasien di setiap kategori diperoleh di QEHB. Setelah dikumpulkan, sampel disentrifugasi terlebih dahulu pada kecepatan 2000×g selama 20 menit dan kemudian melalui siklus sentrifugasi lebih lanjut pada kecepatan 13.000×g selama 2 menit. Plasma darah yang diekstraksi disimpan pada suhu -80 °C hingga dilakukan analisis. Semua sampel diproses dalam waktu 2 jam setelah pungsi vena.
Pengumpulan dan Persiapan Plasma Darah
Sampel darah dikumpulkan dari Rumah Sakit Queen Elizabeth Birmingham dan Universitas Birmingham, Inggris dari 40 peserta. Di antara mereka, 20 orang didiagnosis secara klinis dengan penyakit kardiovaskular yang dikonfirmasi melalui praktik klinis terkini dan 20 peserta sisanya sehat tanpa masalah atau kondisi kesehatan yang diketahui. Plasma darah dipisahkan dari darah utuh menggunakan proses sentrifugasi 2 tahap; sentrifus awal pada 2000×g selama 20 menit, diikuti dengan pembuangan supernatan dan sentrifus lebih lanjut pada 13.000 × g selama 2 menit. Plasma kemudian diekstraksi dan disimpan pada suhu -80 °C. Selama proses rekrutmen, persetujuan tertulis diperoleh dari setiap peserta.
Chip Membran Nanopori
Semua lapisan dibuat menggunakan cetakan mikro cetak resin 3D dari resin tahan resolusi suhu tinggi (Siraya Tech, AS). Cetakan dicetak menggunakan printer resin LCD/MSLA monokrom yang dilengkapi dengan sumber cahaya 405 nm (Elegoo Mars3) dan selanjutnya, dicuci secara menyeluruh dalam isopropil selama 20 menit, dianil pada 120 °C dan akhirnya, diawetkan di bawah lampu ultraviolet (Elegoo, Cina) selama 20 menit untuk mencegah interaksi cetakan/PDMS. PDMS (Dow corning, AS) dicampur dalam rasio 5:1 dengan agen pengawet Sylgard 184 (Dow Corning, AS). Lubang akses berdiameter 6 mm dirancang untuk ruang masuk dan keluar, masing-masing. Filter membran polietersulfon (PES) Sterlitech berdiameter 25 mm dengan berbagai ukuran pori (5000, 500, 200, 100, dan 40 nm) ditempatkan di antara lapisan PDMS. Lapisan PDMS diikat melalui kombinasi plasma selama 10 menit diikuti dengan pemanggangan keras pada suhu 120 °C selama 30 menit.
Desain dan Fabrikasi Perangkat Lab-on-a-Chip
Chip mikrofluida yang dirancang terdiri dari 5 lapisan PDMS yang direkatkan pada slide kaca. Lapisan atas berisi sumur untuk saluran masuk sampel, di dasar sumur dan di antara lapisan atas dan tengah terdapat membran nanopori polietersulfon hidrofilik dengan ukuran pori 5000 µm untuk menyaring serpihan sel/partikel makanan. Air liur menetes melalui filter ke saluran masuk lapisan PDMS berikutnya, bergerak menuruni saluran mikrofluida dan ke area pengumpulan sampel yang berisi buffer PBS. Selanjutnya, air liur melewati membran filter lebih lanjut (500 nm) yang diapit di antara dua lapisan PDMS, tempat EV berukuran 5000–500 nm (EV besar) terperangkap dan terkumpul. Air liur terus menetes melalui tiga lapisan lebih lanjut dengan ukuran pori 200, 100, dan 40 nm untuk mengumpulkan dan menjebak EV dalam rentang ukuran 500–200 (EV tengah), 200–100 (EV kecil), 40–100 nm (EV kecil). Filter 40 nm digunakan untuk menjebak protein. Saluran kapiler digunakan untuk membantu aliran selama proses penyaringan. Sebelum injeksi sampel, 1 mL PBS disuntikkan ke dalam saluran masuk untuk membasahi terlebih dahulu membran filter. Saluran keluar sampel diisi dengan 100 µL PBS untuk membantu aliran kapiler di seluruh sistem. Setelah 10 menit, PBS saluran masuk diganti dengan 100 µL sampel. Pemisahan dilakukan pada suhu ruangan.
Analisis Pelacakan Nanopartikel
NTA NanoSight NS300 (Malvern, Inggris) digunakan untuk mengukur distribusi ukuran dan konsentrasi EV yang terkumpul. Sampel plasma darah diencerkan dengan PBS yang telah disaring sebelumnya dalam rasio 1:5 dengan air liur yang diencerkan 1:10 sesuai dengan konsentrasi partikel yang direkomendasikan per bingkai (20–100 partikel/bingkai). Untuk setiap pengukuran, lima video berdurasi 60 detik direkam. Setelah perekaman, perangkat lunak NanoSight NTA3.1 digunakan untuk menganalisis segmen video untuk setiap pengukuran EV dengan ambang deteksi 6.
Hamburan Cahaya Dinamis
Pengukuran DLS dilakukan menggunakan Malvern Panalytical Zetasizer HPPS yang dilengkapi dengan laser He-Ne 633 nm. Kuvet kuarsa volume rendah digunakan untuk analisis 15 µL sampel. Semua pengukuran dilakukan pada posisi tetap dengan peredam otomatis dan pada suhu terkontrol 25 °C. Lima pengukuran dirata-ratakan untuk setiap sampel EV.
Mikroskopi Fluoresensi
EV dianalisis menggunakan mikroskop Carl-Zeiss LSM780 yang dilengkapi dengan panjang gelombang eksitasi 405, 488, dan 514 nm untuk memvisualisasikan nanopartikel berwarna dengan lensa objektif ×50/×100. Semua gambar diproses menggunakan perangkat lunak ImageJ.
Mikroskop Elektron Pemindaian
EV dianalisis pada membran filter, dalam PBS dan dalam bentuk tetap. EV difiksasi pada wafer silikon menggunakan 2,5% glutaraldehida yang disiapkan dalam PBS selama 30 menit. Sampel kemudian didehidrasi secara berurutan dalam urutan etanol yang meningkat. Sampel dikeringkan pada suhu ruangan sebelum pengamatan SEM. Beberapa bingkai yang dipilih secara acak dari setiap sampel diambil untuk penilaian morfologi dan mikrograf elektron pemindaian diperoleh menggunakan Mikroskop Elektron Pemindaian Emisi Medan berbantuan termal (FESEM, LEO VP 1530/FEI Helios) dengan resolusi lateral 2–5 nm. Instrumen LEO ULTRA 55SEM termasuk pemancar Schottky (katode ZrO/W) juga digunakan untuk mencitrakan sampel dengan tegangan percepatan tipikal 2–5 kV.
Spektroskopi Raman
Spektroskopi Raman dilakukan langsung pada chip di setiap membran filter. Spektrum Raman diperoleh menggunakan mikroskop Raman confocal Renishaw InVia Qontor yang dilengkapi dengan mikroskop Leica DMLM (Renishaw PLC, Inggris). Laser eksitasi 785 nm digunakan dalam analisis dan cahaya laser difokuskan menggunakan objektif ×50. Daya keluaran pada sampel adalah 5 mW. Semua spektrum Raman diperoleh di wilayah sidik jari utama 700–1700cm −1 . Pemindaian peta diperoleh lebih dari 50 × 50µm 2 area untuk setiap sampel menggunakan ukuran langkah 5 µm antara titik peta, 10 akumulasi akuisisi 1 detik per spektrum. Singkatnya, 1 peta dengan 100 spektrum dikumpulkan per sampel untuk air liur dan plasma dan digunakan untuk pemrosesan dan analisis data. Semua data Raman diperoleh menggunakan WiRE 5.1 (Renishaw PLC, Inggris) yang juga diterapkan untuk pengurangan latar belakang polinomial dan penghilangan sinar kosmik. Spektrum dinormalisasi menggunakan variat normal standar (SNV) menggunakan Python (v.3.7). Rasio sinyal terhadap derau ditingkatkan menggunakan 10 spektrum yang dirata-ratakan di setiap lokasi peta.
Klasifikasi SKiNET
Analisis Multivariat dilakukan menggunakan SKiNET, bersama antarmuka web Raman Toolkit untuk membangun model SOM. Set data dikelompokkan dan dibagi menjadi data uji dan pelatihan (20:80). Validasi silang sepuluh kali lipat dilakukan pada data pelatihan dengan pengoptimalan ukuran grid, laju pembelajaran awal, dan jumlah langkah pelatihan. Model akhir yang digunakan untuk mengklasifikasikan data uji terdiri dari grid neuron berukuran 10 × 10, 46.080 langkah pelatihan (4 periode data) dan laju pembelajaran awal sebesar 0,1. Python digunakan untuk menyelesaikan kode batang multi-kimia data. Filter Savitzky-Golay diterapkan untuk menghitung turunan kedua dari setiap spektrum. Jendela penghalusan ditetapkan pada angka 21 dengan orde polinomial 2. Tinggi puncak maksimum dengan nilai absolut lebih dari 40% diberi nilai 1 dan nilai di bawah 40% diberi nilai 0. Nilai-nilai ditumpangkan pada spektrum yang dirata-ratakan dengan mengacu pada puncak-puncak utama yang diinginkan yang diidentifikasi, sehingga terciptalah kode batang karakteristik.
Analisis Statistik
Data spektral yang dikumpulkan dianalisis menggunakan IBM SPSS Statistics (IBM Corp., AS). Statistik deskriptif, termasuk rata-rata, deviasi standar, dan rentang dihitung untuk meringkas karakteristik demografis peserta studi. Signifikansi statistik dari perbedaan antara dua set data dinilai menggunakan uji Wilcoxon rank sum/Mann-Whitney U. Tingkat signifikansi untuk semua uji statistik ditetapkan pada 0,05. Nilai p <0,05 dianggap signifikan secara statistik. Perbandingan antar kelompok pada setiap waktu dan dalam kelompok dari waktu ke waktu dilakukan dengan analisis varians dan uji post hoc Tukey pada data yang ditransformasikan.
Kurva ROC dan Box Plot
Kurva ROC dihasilkan dari data profil pasien untuk titik potong yang berbeda menggunakan uji Mann-Whitney U non-parametrik dan Kruskal Wallis, yang dijalankan menggunakan perangkat lunak statistik SPSS. Setiap titik dalam kurva ROC mewakili pasangan sensitivitas/spesifisitas yang sesuai dengan ambang batas keputusan tertentu dan nilai diagnostik sensitivitas, spesifisitas, dan akurasi dihitung menggunakan persamaan standar. Tes dengan diskriminasi sempurna (tidak ada tumpang tindih dalam dua distribusi) memiliki kurva ROC yang melewati sudut kiri atas (sensitivitas 100%, spesifisitas 100%). Semakin dekat kurva ROC ke sudut kiri atas, semakin tinggi akurasi keseluruhan tes. Kotak plot dihasilkan menggunakan perangkat lunak Vertex42 LLC di mana setiap seri adalah bagan xy yang digunakan untuk mewakili kuartil dan memungkinkan data untuk menyertakan nilai negatif. Median direpresentasikan dengan penanda “x” dan penanda horizontal digunakan untuk Q 1 dan Q 3 tanpa memerlukan pergeseran data. Tingkat rata-rata perbandingan kelompok pasien dengan kelompok kontrol relawan sehat dilakukan dengan menggunakan uji -t 95% CIs berbasis normal dua sisi . Sensitivitas, akurasi, dan spesifisitas klasifikasi ditentukan berdasarkan hasil deteksi penyakit: Sensitivitas = (TP)/(TP+FN), Spesifisitas = (TN)/(TN+FP) dan Akurasi = (TP+TN)/(TP+TN+FN+FP) dengan TP menjadi “positif benar”, TN “negatif benar”, FP dan FN “positif palsu” dan “negatif palsu”.
