Alas Kawat Nano Silikon Memungkinkan Perekaman Biolistrik Canggih dalam Kultur Sel DRG Primer
Abstrak
Kultur sel ganglion akar dorsal primer (DRG) menyediakan model yang berharga untuk mempelajari transduksi sensorik in vitro, neuropati, dan nyeri kronis, karena mereka mereplikasi heterogenitas in vivo neuron DRG dan sel non-neuron. Namun, teknik patch-clamp tradisional bersifat invasif dan tidak dapat menangkap dinamika sel kolektif. Sementara array multielektroda planar (MEA) menawarkan alternatif non-invasif, mereka menderita kopling sel-elektroda yang buruk dan resolusi terbatas untuk mengidentifikasi jenis neuron DRG tertentu seperti nociceptor serat-C, target utama dalam penelitian nyeri kronis. Pekerjaan ini menunjukkan bahwa MEA berbasis tikar silikon nanowire (SiNW), sementara mempertahankan invasi yang berkurang, memungkinkan perekaman intraseluler berkelanjutan dari neuron dalam kultur sel DRG tikus primer. Didukung oleh lapisan pengumpan astrosit kortikal, tikar SiNW meningkatkan pertumbuhan neuron DRG dan sel glia yang melestarikan karakteristik morfologi dan fungsional sel in vivo. Terintegrasi ke dalam MEA yang terkompartementalisasi, mereka memungkinkan perekaman yang andal dari aktivitas neuronal yang dimodulasi obat di samping garis dasar yang terkait dengan lapisan astrosit. Sinyal yang terekam menunjukkan karakteristik potensial aksi intraseluler, yang menunjukkan akses intraseluler spontan oleh SiNW. Tanda elektrofisiologis yang berbeda memungkinkan identifikasi nociceptor serat C, sebagaimana dikonfirmasi oleh pengukuran patch-clamp. Platform ini merupakan alat yang ampuh untuk menyelidiki mekanisme nyeri in vitro, dengan aplikasi potensial dalam penelitian nyeri praklinis dan studi translasi farmakologis.
1 Pendahuluan
Neuron ganglion akar dorsal (DRG) adalah transduser utama dalam jalur sensorik. Mereka mendeteksi dan mengubah berbagai rangsangan eksternal, baik yang tidak berbahaya maupun yang menyakitkan, menjadi sinyal elektrokimia yang disampaikan ke dan diproses dalam sistem saraf pusat (SSP). [ 1 – 5 ] Neuron sensorik ini membentuk populasi yang heterogen dan kompleks, dengan berbagai jenis dan subtipe yang terspesialisasi dalam merasakan rangsangan termal, mekanis, atau kimia. [ 3 , 6 , 7 ] Badan sel mereka mengelompok dalam DRG, sementara akson mereka yang bercabang memperluas satu cabang ke sistem saraf tepi (PNS) dan yang lainnya ke SSP. Selain badan sel neuron sensorik, DRG juga mengandung sel-sel non-neuron, termasuk sel glia (misalnya, sel satelit dan sel Schwann), sel imun, dan sel vaskular, yang semuanya memainkan peran penting dalam mendukung fungsi ganglia. Budidaya sel DRG primer mempertahankan heterogenitas dan kompleksitas populasi sel ini, menyediakan model yang efektif untuk mempelajari mekanisme transduksi sensorik, neuropati, cedera saraf, dan nyeri kronis. [ 8 – 12 ] Namun, studi biolistrik neuron DRG biasanya bergantung pada rekaman patch-clamp sel tunggal. Meskipun sangat berharga untuk menentukan sifat elektrofisiologis sel apa pun, metode ini invasif, tidak cocok untuk studi jangka panjang, dan gagal menangkap dinamika ensemble neuron dan sel glia. Keterbatasan ini sangat relevan mengingat semakin banyaknya pengakuan bahwa sel glia DRG dapat memainkan peran penting dalam patologi PNS, terutama nyeri kronis. [ 13 – 16 ] Oleh karena itu, ada kebutuhan yang semakin meningkat untuk metode, yang memungkinkan perekaman aktivitas biolistrik dalam populasi neuron DRG yang berinteraksi dengan sel glia, untuk memajukan pemahaman kita tentang mekanisme nyeri dan pengembangan pengobatan terapeutik baru.
Perangkat multielectrode array (MEA) sangat cocok untuk perekaman non-invasif dan jangka panjang dari aktivitas biolistrik yang dihasilkan oleh kelompok sel elektrogenik, baik in vitro maupun in vivo. [ 17 – 19 ] Perangkat ini memungkinkan wawasan tentang dinamika kolektif, sinkronisasi, dan komunikasi antar sel. Studi terkini tentang pensinyalan listrik dalam kultur sel DRG sebagian besar memanfaatkan MEA planar metalik atau semikonduktor oksida logam komplementer (CMOS), tetapi pendekatan ini menghadapi keterbatasan yang signifikan. Secara khusus, kopling listrik yang buruk antara neuron dan elektroda [ 19 ] menghasilkan sinyal amplitudo rendah (puluhan hingga ratusan mikrovolt) [ 20 – 27 ] dan rasio sinyal terhadap derau yang rendah, yang memerlukan sumber daya komputasi yang signifikan untuk mengekstrak data dan memilah sinyal yang direkam. MEA planar juga gagal memberikan kekayaan informasi biolistrik yang diperoleh dari rekaman patch-clamp, seperti fitur khusus dalam bentuk ‘potensial aksi’ (AP), yang penting untuk mengidentifikasi jenis neuron sensorik tertentu. Misalnya, neuron nosiseptor serabut C, target utama dalam penelitian nyeri kronis, [ 28 , 29 ] menunjukkan “bahu” dalam fase jatuh AP mereka yang merupakan hasil dari dinamika saluran ion spesifik. [ 6 , 7 , 30 ] Fitur elektrofisiologis ini, dikombinasikan dengan diameter badan sel kecil (10–30 µm) dan responsivitas terhadap capsaicin (CAPS, agonis reseptor potensial transien saluran vanilloid 1, TRPV1), [ 31 , 32 ] umumnya digunakan untuk mengidentifikasi nosiseptor serabut C. MEA planar tidak memiliki resolusi untuk mendeteksi tanda-tanda listrik yang disebutkan di atas, sehingga membatasi aplikasinya dalam penelitian nyeri. Baru-baru ini, elektroda berstruktur nano, yang permukaannya menampilkan nanopilar atau nanowire, telah meningkatkan sensitivitas MEA dengan meningkatkan kopling sel-elektroda dan meningkatkan area penginderaan. [ 19 , 33 – 37 ] Nanostruktur ini memungkinkan mekanisme seperti penyerapan sel atau akses intraseluler, yang meningkatkan kualitas sinyal. Meskipun berhasil dalam monokultur neuron kortikal atau kardiomiosit, penerapannya pada kultur sel DRG kompleks, termasuk neuron dan sel glia, hingga kini masih belum banyak dieksplorasi. Pengecualian penting adalah transistor efek medan nanowire berbentuk U (U-NWFET), [ 38 ]yang dapat merekam AP intraseluler amplitudo penuh dari neuron DRG tunggal, yang menyelesaikan fitur bahu karakteristik bentuk AP mereka, mirip dengan rekaman patch-clamp. Namun, stabilitas perekaman terbatas pada beberapa puluh detik, bersama dengan kompleksitas tinggi dari proses desain dan fabrikasinya, menghambat skalabilitasnya untuk studi yang memerlukan pemantauan jangka panjang dan simultan dari beberapa neuron.
Di sini kami membahas keterbatasan dalam studi elektrofisiologi kultur sel DRG dengan teknologi MEA dengan memanfaatkan sifat antarmuka sel yang sangat baik dan kemampuan perekaman sinyal yang efektif dari tikar kawat nano silikon (SiNW). [ 39 – 47 ] Dibantu oleh astrosit kortikal tikus yang berfungsi sebagai lapisan pengumpan, tikar SiNW meningkatkan adhesi neuron DRG dan pertumbuhan neurit serta penyebaran sel glia perifer, menciptakan lingkungan yang mendukung untuk pertumbuhan dan interaksi sel. Diintegrasikan ke dalam MEA, tikar SiNW memungkinkan perekaman aktivitas listrik yang dimodulasi obat secara andal dari komponen neuronal dalam kultur sel DRG. Khususnya, sinyal yang direkam sangat menyerupai karakteristik AP dari nociceptor serat-C, terutama dengan mendeteksi keberadaan bahu dalam fase jatuh sinyal. Kesamaan ini didukung oleh analisis patch-clamp, yang menunjukkan bahwa SiNW memungkinkan akses intraseluler tanpa perlu teknik umum seperti elektroporasi, [ 48 , 49 ] optoporasi, [ 50 , 51 ] atau penyisipan mekanis yang difasilitasi oleh modifikasi permukaan fosfolipid dari probe yang berdiri bebas, [ 52 ] yang umum digunakan di sebagian besar MEA berstruktur nano yang dilaporkan. Karena penyembuhan diri yang cepat dari membran sel, metode ini biasanya memungkinkan akses intraseluler hanya selama puluhan detik, dan stimulus eksternal dapat diterapkan hanya sebentar tanpa mengganggu sistem secara signifikan. Akibatnya, pendekatan ini membatasi pengamatan pada sel-sel yang telah dipilih sebelumnya pada titik waktu tertentu, membatasi perekaman pada durasi pendek daripada memungkinkan pemantauan dinamika seluler kolektif yang berkelanjutan dan tidak bias.
Lebih jauh lagi, rekaman intraseluler telah diperoleh secara konsisten dengan NW_MEA selama periode yang panjang dari berbagai perangkat yang melibatkan spesimen dari hewan yang berbeda, menunjukkan ketahanan dan sensitivitas tinggi dari pendekatan yang diusulkan.
Akhirnya, kami menggarisbawahi bahwa integrasi astrosit dalam kultur sel DRG meningkatkan kompleksitas model dan relevansi fisiologis. Model ini menyediakan platform yang efektif untuk menyelidiki sinyal komunikasi antara SSP dan PNS, khususnya dalam konteks pemrosesan sinyal nyeri. Memang, bukti yang berkembang juga menyoroti peran penting astrosit dalam pemrosesan sinyal nyeri di dalam otak, yang menunjukkan bahwa disfungsi mereka (astrogliopati) juga dapat berkontribusi pada patofisiologi nyeri kronis. [ 53 – 55 ] Dengan menggabungkan relevansi fisiologis model ko-kultur PNS/SSP ini dengan sensitivitas tinggi MEA berbasis tikar SiNW, pendekatan kami menawarkan alat yang ampuh tidak hanya untuk penelitian dasar tentang mekanisme nyeri tetapi juga untuk studi translasi. Secara khusus, ini dapat digunakan untuk mengidentifikasi dan memvalidasi target terapi baru, seperti jalur pensinyalan neuron-glia, dan untuk menyaring kandidat obat potensial yang menargetkan interaksi neuron DRG dan astrosit.
2 Hasil
2.1 Kultur Sel Neuron-Glia DRG Primer Tikus pada Tikar SiNW: Karakterisasi Pertumbuhan dan Populasi
2.1.1 Kultur Sel Neuron-Glia DRG dan Lapisan Pengumpan Astrosit
Awalnya kami menyelidiki apakah tikar SiNW sendiri dapat mendukung pertumbuhan dan pematangan sel DRG. Substrat yang diuji meliputi tikar SiNW yang tumbuh melalui plasma enhanced chemical vapor deposition (PECVD) [ 40 , 42 , 46 ] pada slide kaca dan dilapisi dengan lapisan ganda Ti (20 nm)/Au (125 nm) (tikar Au/SiNW) untuk mereproduksi karakteristik permukaan elektroda dari MEA yang dikembangkan (Bagian 2.2 ). Gambar mikroskop elektron pemindaian (SEM) dari SiNW yang tumbuh (Gambar S1a , Informasi Pendukung) mengungkapkan tikar padat dari nanokabel yang tersusun dan berorientasi acak, panjang 2–3 µm dengan diameter dasar 50–80 nm. Setelah pengendapan logam, Au/SiNW (Gambar S1b , Informasi Pendukung) menunjukkan bentuk silinder dengan diameter dasar yang meningkat (120–180 nm) dan panjang yang tidak berubah.
Sel DRG, yang diisolasi dari tikus P11-P21, dikulturkan secara langsung pada alas Au/SiNW mengikuti protokol yang dirinci dalam Bagian Eksperimen. Analisis molekuler dan morfologi (Gambar S2 , Informasi Pendukung) menunjukkan bahwa platform berstruktur nano saja tidak mendukung perkembangan neuron dan glia DRG. Ini tidak mengherankan karena neuron primer sering kali memerlukan isyarat adhesi spesifik untuk menempel pada permukaan anorganik. Untuk mengatasi masalah ini sambil memastikan interaksi neuron-nanowire secara langsung, kami menghindari memfungsikan permukaan Au/SiNW dengan molekul adhesi. Sebagai gantinya, kami membudidayakan sel DRG dengan bantuan lapisan pengumpan astrosit, memanfaatkan sifat-sifat neuro-suportif astrosit yang terkenal. [ 56 , 57 ] Selain itu, penelitian kami sebelumnya [ 46 ] menunjukkan bahwa astrosit, yang ditanam langsung pada substrat Au/SiNW, menempel pada nanowire tanpa menimbulkan reaksi gliotik, sehingga mendukung perkembangan neuron. Setelah 5 hari in vitro (DIV), sel DRG disemai di atas lapisan astrosit (protokol di Bagian Eksperimen).
2.1.2 Viabilitas dan Morfologi Sel
Analisis viabilitas kultur yang ditanam pada substrat Au/SiNW dan kontrol (CTRL) dengan dukungan lapisan pengumpan astrosit dilakukan menggunakan FDA pada 3 DIV dan 7 DIV dari penanaman sel DRG. Sebagai CTRL, kami memanfaatkan substrat Si planar yang ditutupi oleh lapisan ganda Ti/Au yang sama seperti alas SiNW. Gambar FDA menunjukkan berbagai sel yang hidup, dengan morfologi yang berbeda, yang melekat pada substrat (Gambar S3 a -d , Informasi Pendukung). Analisis kuantitatif menunjukkan bahwa kedua substrat menunjukkan tren yang sama dalam pertumbuhan sel dari waktu ke waktu, dengan peningkatan jumlah sel dari 3 DIV menjadi 7 DIV, yang mengonfirmasi bahwa Au/SiNW mendukung adhesi, proliferasi, dan pertumbuhan populasi sel DRG.
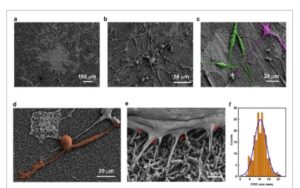
Untuk memperoleh wawasan yang lebih dalam mengenai karakteristik kultur sel astrosit/DRG, investigasi morfologi dengan SEM dilakukan pada sel-sel tetap setelah 5 DIV dari pelapisan sel DRG pada lapisan pengumpan astrosit. Kita dapat mengamati fitur seluler morfologi yang berbeda pada Gambar 1 a, b (gambar tambahan pada Gambar S4a , Informasi Pendukung). Selain bintik-bintik yang lebih terang dan lebih besar dari sel-sel berdiferensiasi seperti bintang, yang dapat dikaitkan dengan astrosit yang mendasarinya, dua morfologi sel DRG utama diamati. Suatu populasi menunjukkan badan sel berbentuk gelendong dengan proses yang panjang dan memanjang (Gambar 1c ), menyerupai sel glia perifer seperti sel Schwann dan sel satelit. [ 58 ] Kelompok lainnya menunjukkan badan sel yang bulat dan akson bercabang, karakteristik neuron DRG pseudo-unipolar [ 2 ] (Gambar 1d dan Gambar S4b , Informasi Pendukung). Gambar SEM miring pada Gambar 1e (juga Gambar S4c,d , Informasi Pendukung) memperlihatkan sel-sel mirip neuron DRG yang melekat pada lapisan nanowire padat di bawahnya, yang memberikan dukungan mekanis tanpa kegagalan struktural meskipun tipis. Selain itu, beberapa nanowire (ditunjukkan dengan panah merah pada Gambar 1e ) tampak tergabung ke dalam membran sel yang menciptakan beberapa titik kontak rapat membran sel-nanowire, yang diharapkan dapat meningkatkan kemampuan menangkap aktivitas listrik seluler secara efektif. Distribusi diameter soma untuk sel-sel mirip neuron DRG (Gambar 1f ) menyoroti prevalensi sel berukuran kecil, dengan diameter rata-rata ≈11 µm, yang konsisten dengan tipe nociceptor serat C (diameter antara 10–30 µm). [ 6 , 7 ]
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Karakterisasi SEM dari kultur sel astrosit/DRG pada substrat Au/SiNW. a) Gambar yang menunjukkan sel DRG di atas lapisan pengumpan astrosit, yang dilapiskan pada Au/SiNW. Bintik-bintik besar dan lebih terang di bawahnya dapat dikaitkan dengan astrosit. b) Gambar SEM memperlihatkan sel-sel dengan ciri khas, termasuk c) sel yang memperlihatkan badan berbentuk gelendong, dan d) sel dengan soma membulat dan proyeksi bercabang yang menyerupai sel glia dan neuron DRG. e) Gambar perbesaran tinggi yang diambil pada sudut miring 30° memperlihatkan nanokabel di bawah badan sel. f) Representasi distribusi ukuran sel mirip neuron DRG dalam sampel dan kecocokan Gaussian dari data.
2.1.3 Analisis Imunofluoresensi
Untuk mengkonfirmasi sifat populasi sel DRG yang disarankan oleh gambar SEM, kami memeriksa pola ekspresi untuk protein terkait pertumbuhan 43 (GAP-43), penanda kerucut pertumbuhan neuronal dan regenerasi akson [ 59 ] dan protein asam fibrilar glia (GFAP), penanda untuk astrosit, dan sel Schwann imatur non-mielinasi dan sel satelit. [ 60 ]
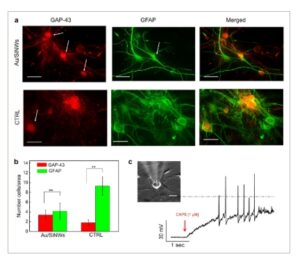
Pewarnaan imunofluoresensi ( Gambar 2 a ) menunjukkan ekspresi GAP-43 (merah) dan GFAP (hijau) pada substrat Au/SiNW (baris atas) dan CTRL (baris bawah). Lebih jauh lagi, neuron DRG menunjukkan badan sel bulat yang khas (sel yang diwarnai merah ditunjukkan oleh panah putih) dan akson yang panjang, sementara sel glia menunjukkan badan sel berbentuk memanjang (sel yang diwarnai hijau ditunjukkan oleh panah putih) dengan proyeksi yang memanjang, selaras dengan pengamatan SEM (Gambar 1a–c ). Meskipun sel berbentuk seperti bintang, yang dapat dikaitkan dengan astrosit, kurang menonjol karena posisinya di bawah neuron DRG, keberadaannya dikonfirmasi melalui gambar tambahan (Gambar S5 , Informasi Pendukung) yang diambil dari area tikar Au/SiNW tempat astrosit lebih dapat dibedakan. Untuk lebih memvalidasi karakterisasi populasi sel, kami melakukan pewarnaan imunofluoresensi tambahan menggunakan nuklei neuronal (NeuN), penanda khusus untuk nuklei neuron, dan 4′,6-diamidino-2-phenylindole (DAPI) yang memberi label pada semua nuklei sel. Analisis kuantitatif yang diperoleh dengan pewarnaan GAP-43/GFAP (Gambar 2b ) dan NeuN/DAPI (Gambar S6 , Informasi Pendukung) mengungkapkan keberadaan sel glia yang relatif lebih tinggi di CTRL dibandingkan dengan Au/SiNW. Dalam kasus apa pun, semua karakterisasi imunofluoresensi mengonfirmasi kemampuan tikar Au/SiNW untuk mendukung adhesi dan pertumbuhan untuk neuron dan sel glia.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Analisis imunofluoresensi dan patch-clamp dari kultur sel astrosit/DRG yang ditanam pada substrat Au/SiNW: Neuron DRG tumbuh pada lapisan pengumpan astrosit dan berdiferensiasi menjadi neuron sensitif CAPS. a) Gambar imunofluoresensi representatif dari sel DRG yang ditanam dengan astrosit pada substrat Au/SiNW (baris atas) dan CTRL (baris bawah) pada 5 DIV. Neuron diberi label dengan GAP-43 (pewarnaan merah), dan sel non-neuron dengan GFAP (pewarnaan hijau), yang masing-masing sesuai dengan gambar di kolom kiri dan tengah. Gambar yang digabungkan disajikan di kolom kanan. Skala batang: 50 µm. b) Plot batang yang melaporkan jumlah sel, dihitung dalam bidang pandang 40x gambar yang diambil, positif terhadap GAP-43 dan GFAP pada substrat Au/SiNW dan CTRL (N = 3 jumlah percobaan). Statistik adalah ANOVA satu arah. * p < 0,05, ** p < 0,01, *** p < 0,001. c) Rangkaian AP dari neuron DRG, yang ditimbulkan oleh penambahan CAPS [1µM]. Garis putus-putus menunjukkan potensi 0 mV. Pada sisipan, gambar mikroskop menunjukkan pipet mendekati neuron DRG dalam kultur. Neuron DRG yang dipilih untuk penjepitan patch adalah sel-sel dengan badan bulat.
2.1.4 Analisis Elektrofisiologi
Sifat fungsional neuron DRG dalam kultur dinilai menggunakan patch-clamp sel utuh. Astrosit/sel DRG dikultur dengan cara yang sama pada alas Au/SiNW dan CTRL. Untuk percobaan ini, substrat CTRL adalah slide kaca berlapis poli-D-lisin untuk memfasilitasi visualisasi neuron melalui substrat transparan. Mikroskopi medan terang (Gambar 2c , sisipan) mengonfirmasi penargetan pipet yang tepat dari neuron DRG. Awalnya rekaman diperoleh dalam mode penjepit arus mengikuti protokol yang dijelaskan dalam Bagian Eksperimen. Analisis komparatif sifat pasif neuron (Tabel S1 dan Catatan S1 , Informasi Pendukung) mengungkapkan penyelarasan yang erat antara kultur pada substrat Au/SiNW dan CTRL.
Secara berturut-turut, hipotesis keberadaan fenotip nociceptor serat C diselidiki melalui stimulasi dengan CAPS, agonis saluran TRPV1 [ 31 ] yang biasanya menimbulkan respons neuron DRG, khususnya respons nociceptor. Dengan demikian, kami mengukur respons terhadap CAPS [1 µM] neuron DRG (jumlah neuron DRG yang terekam, N = 12) dalam kultur pada Au/SiNW (N = 6) dan CTRL (N = 6) (detail lebih lanjut di Bagian Eksperimen). Eksperimen melibatkan spesimen dari sedikitnya tiga hewan berbeda dan substrat Au/SiNW dari berbagai kelompok produksi; rangkaian AP representatif ditunjukkan pada Gambar 2c . Sifat elektrofisiologi neuron DRG dengan respons positif terhadap stimulasi CAPS (dilaporkan dalam Tabel S2 dan dikomentari dalam Catatan S1 , Informasi Pendukung), termasuk potensial membran istirahat dan parameter lainnya, sangat selaras dengan nilai yang diamati dalam kelompok CTRL, serta dengan yang ditemukan dalam literatur untuk neuron nociceptor serat C.
Secara kolektif, hasil kami menunjukkan bahwa tikar Au/SiNW, dengan bantuan astrosit, secara efektif mendukung kultur neuron DRG dan sel glia dengan mempertahankan sifat morfologi dan biolistriknya. Lebih jauh, keberadaan neuron nociceptor serat C dalam kultur ini dikonfirmasi melalui stimulasi CAPS, yang menyoroti kegunaan platform sebagai sistem yang andal untuk mempelajari mekanisme nyeri kronis dan menyelidiki fungsionalitas nociceptor.
2.2 Konsep dan Pembuatan MEA Berbasis Matras SiNW
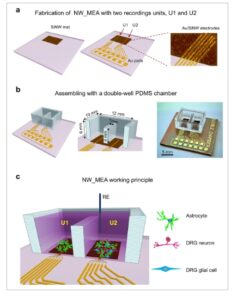
Kami merancang dan mengembangkan MEA multi-unit berdasarkan tikar SiNW (NW_MEA). Perangkat ini mencakup dua unit perekaman yang berbeda, yang diberi nama U1 dan U2. Mengingat kompleksitas populasi sel, ide utama dari desain ini adalah menggunakan satu unit untuk merekam aktivitas yang dihasilkan dalam populasi neuron DRG dan sel glia yang dikultur pada lapisan pengumpan astrosit, sementara unit lainnya memantau sinyal dasar dari monokultur astrosit dalam kondisi lingkungan yang identik dengan memberikan referensi yang andal untuk perbandingan.
Gambar 3a mengilustrasikan langkah-langkah fabrikasi utama (detail tambahan di Bagian Eksperimen) dari NW_MEA yang dikembangkan, yang dibangun di atas versi sebelumnya [ 42 ] dengan unit perekaman tunggal, yang berhasil diterapkan untuk merekam aktivitas listrik sel-sel neuroendokrin. Pertama, SiNW ditumbuhkan pada area yang dipilih (12 mm x 10 mm) dari slide kaca mikroskop (panel kiri). Secara berurutan, dua set enam elektroda berbentuk jari (25 µm x 8 mm, pitch 50 µm) dan jalur penghubung dibuat dengan penguapan termal dari lapisan ganda Ti (20 nm)/Au (125 nm) ke area berpola dari tikar SiNW isolasi, seperti yang ditunjukkan pada panel tengah dan kanan Gambar 3a . Gambar S1c,d , Informasi Pendukung, menunjukkan gambar SEM representatif dari satu set elektroda ini (disebut sebagai elektroda Au/SiNW) dan tampilan close-up terkait, masing-masing.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Desain NW_MEA dan prinsip kerjanya. a) Langkah-langkah pembuatan NW_MEA dengan dua unit kultur dan perekaman: Pertumbuhan alas SiNW pada area terpilih 12 mm x 10 mm dari slide kaca mikroskop dengan PECVD (panel kiri); pembuatan dua unit perekaman (U1 dan U2) dan bantalan Au eksternal (panel kanan). Setiap unit perekaman dibentuk oleh enam elektroda berbentuk jari, yang diperoleh dengan menguapkan lapisan ganda Ti/Au ke area terpilih alas SiNW (garis-garis kuning pada gambar panel kanan). Elektroda (disebut sebagai elektroda Au/SiNW) berukuran panjang 8 mm dan lebar 25 µm, dengan jarak 50 µm. Unit U1 dan U2 diberi jarak 5 mm. b) Ruang PDMS sumur ganda yang disesuaikan ditempatkan di atas dua unit perekaman (panel kiri dan tengah) dan foto perangkat lengkap yang representatif (panel kanan). c) Skema yang mengilustrasikan kondisi kerja dengan NW_MEA: pada U1, hanya astrosit yang dikultur dan direkam oleh elektroda; pada U2, lapisan astrosit mendukung pertumbuhan sel DRG, termasuk neuron dan sel glia, yang kemudian direkam oleh elektroda pada U2. Elektroda referensi (RE) umum digunakan bersama oleh kedua unit perekaman.
Rel penghubung planar (bantalan Au) digunakan untuk menghubungkan secara elektrik NW_MEA ke sistem akuisisi kebisingan rendah yang disesuaikan, yang dikembangkan sebelumnya [ 42 ] dan ditunjukkan pada Gambar S7 , Informasi Pendukung.
Bahasa Indonesia: Ruang sumur ganda polidimetilsiloksan (PDMS) yang disesuaikan diposisikan di atas dua unit perekaman, seperti yang ditunjukkan pada Gambar 3b (detail tambahan di Bagian Eksperimen dan pada Gambar S8 , Informasi Pendukung). Foto perangkat rakitan representatif ada di sisi kanan Gambar 3b . Desain ruang PDMS secara efektif membagi ruang menjadi dua kompartemen kultur sel dan perekaman. Dalam percobaan kami, U1 menampung monokultur astrosit, dan U2 menampung kultur neuron DRG dan sel glia pada lapisan astrosit (Gambar 3c ). Selama fase perekaman, media kultur diganti dengan larutan garam eksternal standar (EXT). Untuk menghubungkan dua kompartemen, volume larutan yang sesuai yang diperlukan untuk mengatasi penghalang PDMS ditambahkan, dan kedua kompartemen menggunakan elektroda referensi (RE) yang sama, seperti yang digambarkan pada Gambar 3c . Pendekatan ini memungkinkan perekaman simultan dalam kondisi serupa untuk kedua jenis kultur, sehingga memungkinkan kami membedakan kontribusi astrosit yang mendasarinya (direkam oleh kedua kelompok elektroda di U1 dan U2) dan sel DRG (hanya direkam oleh kelompok elektroda di U2).
Kami mengamati bahwa desain elektroda Au/SiNW berbeda secara signifikan dari yang tradisional, yang biasanya lebih kecil beberapa kali lipat. Karena interaksi mekanis antara permukaan mikro/nanostruktur dan sel dapat memengaruhi adhesi, proliferasi, morfologi, dan fungsionalitas, [ 61 ] desain yang diusulkan menawarkan cara sederhana untuk membuat MEA dengan nanotopografi yang seragam, mengurangi diskontinuitas antara area konduktif dan isolasi. Keseragaman ini memastikan fitur fisik yang konsisten di seluruh permukaan MEA, mendorong respons seluler yang seragam. Selain itu, menggabungkan MEA nanostruktur dengan kultur multiseluler, termasuk neuron dan sel glia yang berbeda, menghadapi beberapa tantangan yang terkait dengan proliferasi sel glia berlebihan yang khas secara in vitro. [ 62 ] Fenomena yang tidak diinginkan dapat terjadi termasuk enkapsulasi nanostruktur elektroda, respons inflamasi, atau pembentukan jaringan parut. [ 63 ] Peristiwa ini dapat menyembunyikan aktivitas biolistrik dari sebagian besar neuron dalam kultur multiseluler atau mencegah kontak fisiknya dengan elektroda. Ukuran elektroda kami yang lebih besar mengurangi masalah ini dengan meningkatkan area kontak dengan kultur, yang pada gilirannya meningkatkan kemampuan elektroda untuk terhubung secara elektrik dengan sejumlah neuron yang terletak berdekatan dan aktif menyala. Bersama-sama, faktor-faktor ini berkontribusi pada kemampuan platform untuk merekam sinyal neuron secara efektif. Namun, penting untuk dicatat bahwa sinyal yang direkam dari elektroda adalah jumlah kontribusi sel yang berbeda yang secara bersamaan aktif dan melekat padanya.
2.3 Perekaman Sinyal Neuronal dari Kultur Sel Astrosit/DRG menggunakan NW_MEA dengan Modulasi Farmakologis
2.3.1 Pengaturan Eksperimen dan Penilaian Dasar
Suspensi astrosit ditanam secara simultan pada kompartemen U1 dan U2 dari NW_MEA dan dipelihara dalam medium astrosit 10% FBS yang disuplemen. Setelah 5 DIV, sel DRG ditanam ke dalam U2, menggunakan medium astrosit yang sama (seperti skema pada Gambar 3c ). Perekaman dilakukan setelah 5 DIV penanaman sel DRG. Cakupan sel pada elektroda diverifikasi dengan mikroskop optik untuk sel hidup dan analisis SEM dari sel tetap sebelum dan sesudah perekaman, masing-masing. Pada U1, lapisan astrosit yang padat menyebar di seluruh elektroda ( Gambar 4 a(i) , Gambar S9a,b , Informasi Pendukung). Pada U2, gugusan astrosit dapat diidentifikasi pada bintik terang dan bintik besar di bawahnya, dan neuron DRG dan sel glia menyebar di atas elektroda ( Gambar 4a(iii) , Gambar S9c,d , Informasi Pendukung). Perekaman dilakukan setelah mengganti medium kultur dengan larutan EXT. Volume EXT 400 µL digunakan untuk memastikan pertukaran melintasi penghalang PDMS, yang memungkinkan komunikasi antara U1 dan U2 (Gambar 3c ). Sinyal direkam dari monokultur astrosit di U1 dan kultur sel neuron-glia astrosit/DRG di U2 selama empat intervensi farmakologis berurutan selama 25 menit. Gambar 4a(ii) menunjukkan jejak voltase dari U1 (monokultur astrosit), dan Gambar 4a(iv) menunjukkan jejak dari U2 (kultur neuron-glia astrosit/DRG). Sinyal yang direkam dalam larutan EXT menunjukkan tingkat gangguan, dengan nilai akar kuadrat rata-rata (RMS), dirata-ratakan lebih dari enam elektroda, sebesar 270 µV di U1 dan 280 µV di U2. Nilai-nilai ini sekitar lima kali lebih tinggi daripada nilai RMS yang diamati sebelum kultur sel (50 µV; Catatan S2 dan Gambar S10 , Informasi Pendukung) yang menyoroti dampak perlekatan sel pada kinerja elektroda. Lebih jauh lagi, nilai serupa yang diperoleh dari elektroda yang dilapisi dengan astrosit saja atau astrosit dan sel DRG menunjukkan bahwa kebisingan dasar terutama berasal dari lapisan astrosit karena ukuran selnya yang lebih besar dibandingkan dengan neuron DRG dan sel glia.

Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Rekaman aktivitas biolistrik dalam kultur sel neuron-glia astrosit/DRG menggunakan NW_MEA di bawah interogasi farmakologis. Tiga eksperimen independen menggunakan perangkat NW_MEA dari kelompok berbeda, yang melibatkan N = 3 hewan, diilustrasikan. a) Rekaman dari perangkat NW_MEA 1: ( i ) Gambar SEM dari monokultur astrosit dalam kompartemen U1 (skala batang: 100 µm), dan ( ii ) data mentah dari seluruh tegangan yang direkam vs. jejak waktu dari enam elektroda dalam U1 (C12-C17). ( iii ) Gambar SEM neuron DRG dan sel glia yang ditanamkan pada astrosit dalam kompartemen U2 (skala batang: 100 µm), dan ( iv ) data mentah dari seluruh tegangan yang direkam vs. jejak waktu dari enam elektroda dalam U2 (C18-C23). Periode aktivitas yang terdeteksi di bawah stimulasi farmakologis: hanya larutan EXT, setelah penambahan CAPS [50 µM], TTX [2 µM], dan CBX [50 µM]. Dalam sisipan, segmen rekaman jejak dari elektroda C20, C21, dan C22 sekitar 1 menit setelah penambahan CAPS. ( v ) Analisis kuantitatif jumlah lonjakan (panel kiri) selama seluruh rekaman dari elektroda C20, C21, dan C22. Hanya puncak dengan amplitudo lonjakan V maks > 1 mV (empat kali lebih besar dari nilai RMS) yang dipertimbangkan. Batang abu-abu, merah, hijau, dan magenta menunjukkan jumlah lonjakan dalam larutan EXT dan setelah penambahan CAPS [50 µm], TTX [2 µm], dan CBX [50 µm]. Plot biola di panel tengah dan kanan masing-masing menampilkan amplitudo lonjakan ( V maks ) dan distribusi frekuensi antar lonjakan (IS). Titik hitam dan titik putih masing-masing menunjukkan rata-rata dan median distribusi, garis vertikal menghubungkan persentil kelima dan kesembilan. b) Rekaman segmen jejak dari tiga elektroda (C18, C20, C21) di kompartemen U2 perangkat NW_MEA_2 setelah penambahan CAPS [50 µm] dalam larutan EXT. c) Segmen jejak representatif dari elektroda C19 di U2 perangkat NW_MEA 3. Aktivitas pensinyalan lemah awal dalam kultur ini setelah penambahan CAPS [50 µm] diikuti oleh aktivitas luar biasa yang ditunjukkan setelah pencucian, inkubasi ulang selama 20 menit, dan pemberian CAPS. Perekaman 6 menit dalam EXT dilakukan sebelum penambahan CAPS untuk memastikan pemulihan garis dasar. Hanya rekaman setelah penambahan CAPS yang ditampilkan untuk perbandingan. Perilaku ini, khusus untuk perangkat ini, mungkin disebabkan oleh kondisi awal yang tidak sepenuhnya optimal di lingkungan ekstraseluler, yang dipulihkan setelah pencucian. Periode inkubasi ulang kemungkinan memungkinkan stabilisasi saraf, sehingga menghasilkan rekaman selanjutnya yang lebih baik.
2.3.2 Rekaman dalam Modulasi Farmakologi
Pemberian farmakologis dilakukan untuk menyelidiki aktivitas neuronal dalam populasi sel neuron-glia DRG. Berdasarkan temuan patch-clamp, yang menunjukkan keberadaan fenotipe nociceptor serat C, kami pertama-tama menyelidiki efek CAPS. Setelah 6 menit perekaman dalam larutan EXT, CAPS [50 µM] ditambahkan. Penambahan CAPS ke kultur sel astrosit/DRG menimbulkan beberapa lonjakan, terutama pada saluran C20, C21, dan C22 (Gambar 4a(iv) ). Lonjakan ini mencapai amplitudo beberapa milivolt, secara signifikan lebih besar daripada yang biasanya direkam dalam kultur sel DRG dengan menggunakan teknologi MEA, [ 20 – 27 ] dan menunjukkan pola kuasi-periodik. Temuan ini menyoroti peningkatan sensitivitas NW_MEA dalam mendeteksi aktivitas neuronal. Penambahan tetradotoxin (TTX) [2 µM], penghambat aktivitas neuronal [ 64 ] yang memblokir saluran natrium berpagar tegangan (Nav), mengurangi amplitudo dan frekuensi lonjakan neuronal tetapi tidak sepenuhnya menekannya. Penekanan lengkap dicapai hanya setelah penambahan karbenoksolon (CBX) [50 µM], yang menghambat connexin 43 (Cx43), protein gap junction yang diekspresikan oleh astrosit dan sel glia satelit. [ 65 ] Sebaliknya , monokultur astrosit di U1 (Gambar 4a(ii) ) tidak menunjukkan perubahan yang terlihat sehubungan dengan tingkat kebisingan dasar, yang menunjukkan bahwa sinyal yang direkam di U2 berasal dari neuron. Eksperimen kontrol menggunakan elektroda Ti/Au planar pada slide kaca, yang dirancang identik dengan NW_MEA, merekam sinyal yang tidak luar biasa dari kultur sel neuron-glia astrosit/DRG (Gambar S11 , Informasi Pendukung), yang dilapisi menggunakan protokol yang sama. Hal ini menunjukkan peningkatan kemampuan perekaman NW_MEA disebabkan oleh peningkatan penggabungan sel-NW.
Analisis kuantitatif yang dilakukan pada rekaman dari C20, C21, dan C22 menunjukkan tren yang konsisten di seluruh tiga elektroda (Gambar 4a(v) ). Penambahan CAPS meningkatkan jumlah spike secara signifikan, yang menunjukkan pengurangan yang lemah setelah penambahan TTX dan pengurangan yang tiba-tiba setelah pemberian CBX (panel kiri, Gambar 4a(v) ). Distribusi luas amplitudo spike (Vmax ) diamati untuk setiap saluran setelah penambahan CAPS, yang menunjukkan kontribusi dari beberapa neuron (panel tengah, Gambar 4a(v) ). Distribusi frekuensi antar spike (IS) (panel kanan, Gambar 4a(v) ) menunjukkan kecenderungan ke frekuensi yang lebih rendah, dengan perbedaan minimal setelah paparan CAPS dan TTX.
Ketahanan sinyal setelah paparan TTX menunjukkan bahwa neuron DRG dalam kultur kami mengekspresikan saluran NaV yang sensitif terhadap TTX dan tidak sensitif terhadap TTX. Temuan ini sejalan dengan penelitian sebelumnya [ 66 ] yang menunjukkan bahwa populasi neuron DRG mengandung beberapa jenis saluran NaV berpagar tegangan dengan sifat farmakologis yang berbeda. Dengan demikian, hal ini tidak hanya menyoroti heterogenitas populasi neuron dalam kultur kami tetapi juga menunjukkan bahwa elektroda kami menangkap aktivitas dari berbagai jenis neuron dan dapat membedakan perilaku mereka yang berbeda ketika dimodulasi secara farmakologis. Di sisi lain, penghambatan sinyal lengkap setelah pengobatan CBX menyoroti potensi keterlibatan interaksi glia-neuron dalam memodulasi aktivitas neuron DRG yang sensitif terhadap CAPS, sesuai dengan bukti yang muncul tentang peran aktif sel glia dalam mekanisme nyeri. [ 53 – 55 ] Memahami interaksi ini sangat penting untuk mengembangkan pengobatan baru untuk berbagai gangguan neurologis di mana interaksi neuron-glia terganggu. Sementara mengakui pentingnya hasil ini, penyelidikan menyeluruh diperlukan yang berada di luar cakupan pekerjaan saat ini.
Percobaan perekaman yang berhasil diperoleh dari beberapa kultur sel neuron-glia astrosit/DRG yang berbeda, yang melibatkan spesimen hewan dan perangkat yang berbeda dari kelompok produksi yang berbeda (detail dalam Bagian Eksperimen). Gambar 4b,c menunjukkan rekaman representatif dari populasi sel neuron-glia astrosit/DRG pada dua perangkat yang berbeda, perangkat NW_MEA 2 dan perangkat NW_MEA 3: sel merespons secara koheren terhadap stimulasi neuron farmakologis meskipun perbedaan kecil diamati antara percobaan yang berbeda. Perbedaan ini dapat dikaitkan dengan variabilitas dalam efisiensi antarmuka nanowire-neuron. Selain itu, neuron DRG adalah populasi heterogen, yang terdiri dari berbagai jenis dan subtipe neuron dengan sifat fisiologis yang berbeda. [ 8 , 66 ] Variabilitas intrinsik dalam perilaku seluler ini dapat memengaruhi sinyal yang direkam, yang mengakibatkan sedikit perbedaan dalam amplitudo lonjakan yang diamati dan respons terhadap obat agonis dan antagonis yang diberikan.
2.3.3 Analisis Bentuk Spike dan Perbandingannya dengan Perekaman Patch-Clamp
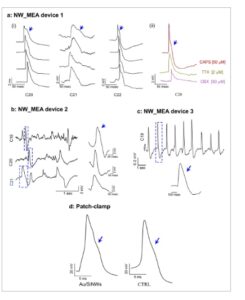
Pada Gambar 5 a(i) , tiga set representatif dari empat lonjakan individual, yang dipilih secara acak dari rekaman C20, C21, dan C22 perangkat NW_MEA 1 setelah penambahan CAPS ditampilkan.
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Analisis bentuk spike dan perbandingan patch clamp. a) Tiga set empat spike tunggal representatif yang diekstraksi secara acak dari jejak yang direkam oleh C20, C21, dan C22 dari perangkat NW_MEA 1 (ditunjukkan pada Gambar 4a(iv)) setelah penambahan CAPS (i). Spike individual representatif yang diekstraksi secara acak dari C20 setelah menambahkan CAPS (garis merah), TTX (garis biru), dan CBX (garis magenta) (ii). Bentuk spike pada (i) dan (ii) semuanya serupa, menunjukkan bentuk gelombang AP yang khas. Bahu terjadi pada fase jatuh dari semua jejak, seperti yang disorot oleh panah biru. b,c) Tampilan close-up dari segmen waktu yang dipilih dari C18, C20, dan C21 dari perangkat NW_MEA 2 (ditunjukkan pada Gambar 4b ), dan dari C19 dari perangkat NW_MEA 3 (ditunjukkan pada Gambar 4c ), masing-masing, setelah penambahan CAPS [50 µm]. Daerah yang diperbesar menunjukkan bentuk lonjakan khas yang masih menunjukkan fitur yang konsisten dengan sinyal AP dan kemunculan bahu pada fase jatuhnya bentuk gelombang seperti yang ditunjukkan oleh panah biru. d) Jejak AP patch-clamp representatif yang direkam dari neuron DRG responsif CAPS tunggal dalam kultur sel neuron-glia astrosit/DRG yang ditanam pada Au/SiNW (panel kiri) dan CTRL (panel kanan). Panah menunjukkan keberadaan bahu pada fase jatuhnya jejak AP, fitur khas neuron nociceptor serabut C.
Khususnya, bentuk gelombang menunjukkan profil seperti sinyal AP, dengan bahu yang menonjol pada fase jatuh seperti yang ditunjukkan oleh panah biru. Bentuk gelombang yang aneh ini bertahan bahkan setelah penambahan TTX dan CBX, seperti yang ditunjukkan pada Gambar 5a(ii) untuk elektroda C20, dan di seluruh eksperimen yang dilakukan yang melibatkan kultur yang berbeda dan perangkat NW_MEA (Gambar 5b,c ).
Menariknya, rekaman penjepit seluruh patch dari neuron DRG yang sensitif terhadap CAPS dalam populasi sel yang dikultur pada alas Au/SiNW dan substrat CTRL menunjukkan profil bentuk gelombang yang serupa. Profil ini mencakup bahu karakteristik pada fase jatuh AP (Gambar 5d ) yang merupakan ciri khas sinyal nociceptor serat C, yang dikaitkan dengan arus kalsium yang bergantung pada tegangan masuk dan arus saluran NaV yang tahan TTX yang sebagian menangkal arus kalium keluar selama fase jatuh. [ 30 ]
Temuan ini sangat menyarankan bahwa Au/SiNW memungkinkan akses intraseluler yang spontan dan stabil, konsisten dengan pengamatan terbaru pada nanostruktur serupa. [ 42 , 43 , 67 ] Kemampuan ini memungkinkan NW_MEA untuk menangkap fitur elektrofisiologi utama neuron nociceptor serat C dengan andal, sebuah tugas yang tetap menantang bagi MEA konvensional.
3 Diskusi
Secara keseluruhan, hasil kami menunjukkan bahwa NW_MEA memungkinkan perekaman intraseluler yang andal dan berkelanjutan dari aktivitas neuron yang dimodulasi obat dalam kultur DRG. Dalam kultur ini, tempat berbagai jenis dan subtipe neuron sensorik hidup berdampingan, [ 8 ] NW_MEA kami menawarkan potensi untuk pengamatan simultan perilaku biolistrik dari beberapa nociceptor, hanya dengan melacak sinyal-sinyal yang menunjukkan bahu dalam jejak yang direkam. Keunikan ini memberikan kesempatan untuk mengamati bagaimana perawatan obat memengaruhi nociceptor dari waktu ke waktu dan bagaimana respons kolektif mereka berkembang. Tidak seperti patch-clamp, yang terbatas pada perekaman sel tunggal untuk waktu yang singkat dan memerlukan identifikasi neuron nociceptif sebelumnya, platform kami menawarkan pendekatan yang lebih luas dan lebih efisien untuk mempelajari transmisi nyeri dan mengevaluasi respons obat secara in vitro.
Kami berhipotesis bahwa akses intraseluler NW_MEA terjadi melalui mekanisme seperti yang dilaporkan sebelumnya. [ 68 , 69 ] adhesi sel ke NW pada elektroda Au/SiNW dapat menyebabkan deformasi membran plasma terlokalisasi, meningkatkan permeabilitasnya dan menyebabkan pembentukan nanopore dalam lapisan lipid. Akibatnya, ujung atau bagian dari beberapa NW membentuk kontak langsung dengan sitosol, menangkap sinyal intraseluler yang sebanding dengan potensial membran. Gambar 1e , bersama dengan Gambar S4c,d , Informasi Pendukung, memang menunjukkan bahwa ujung nano kawat yang lebih panjang berada dalam kontak dekat dengan membran sel dan mungkin telah menembusnya. Proses ini sangat dipengaruhi oleh geometri nano kawat dan sifat mekanis sel. [ 68 , 69 ] Dengan demikian, variasi alami dalam panjang dan jumlah ujung/bagian NW yang terinternalisasi per sel diharapkan memengaruhi impedansi yang dihasilkan pada antarmuka elektroda-sel. Pada gilirannya, variabilitas dalam akses NW ke dalam sel-sel yang berbeda dapat berkontribusi pada distribusi amplitudo lonjakan yang diamati pada setiap elektroda (Gambar 4a(v) ), serta perbedaan di seluruh elektroda (Gambar 4a(v),b , dan 5a ) dan antara perangkat NW_MEA . Selain itu, kopling intraseluler melalui nanopore membran daripada pecahnya membran lengkap yang menjadi ciri teknik patch-clamp bersama dengan sifat listrik NW/sel yang berbeda, berkontribusi pada perbedaan amplitudo dan lebar pita yang diamati dari sinyal yang direkam oleh teknik NW_MEA dan patch-clamp.
Meskipun terdapat variasi intrinsik ini, NW_MEA kami adalah alat yang ampuh untuk menyelidiki aktivitas listrik seluler yang menawarkan keuntungan luar biasa dibandingkan elektroda nanostruktur lain yang dilaporkan yang menampilkan nanopilar atau nanokabel. Pertama, rekaman intraseluler dari beberapa neuron dalam kultur seluler dicapai tanpa memerlukan sinyal pemicu eksternal (listrik atau optik) [ 48 – 50 ] atau modifikasi kimia [ 52 ] untuk pori membran. Bahkan dalam kasus di mana probe SiNW yang berdiri sendiri mencapai entri spontan, [ 38 ] kontrol ketat atas kelengkungan nanokabel diperlukan, yang menambah kompleksitas pada proses fabrikasi. Kedua, rekaman stabil selama waktu perekaman (berlangsung hingga 25 menit dalam percobaan kami) sedangkan nanoelektroda lain, yang mengandalkan pori membran yang diinduksi, biasanya memungkinkan perekaman hanya selama beberapa puluh detik. Selain itu, rekaman intraseluler secara konsisten diperoleh di berbagai perangkat dan spesimen dari hewan yang berbeda, yang menunjukkan kekokohan dan sensitivitas tinggi dari pendekatan kami.
Akhirnya, NW_MEA yang diusulkan dapat dibuat menggunakan teknologi silikon bottom-up, berbiaya rendah, dan berproduksi tinggi pada suhu proses sedang (≈350 °C), yang kompatibel dengan substrat kaca dan polimer fleksibel seperti polimida. [ 70 , 71 ] Hal ini memungkinkan pembuatan perangkat secara langsung pada slide kaca mikroskop standar, sehingga memungkinkan pengamatan optik kultur sel secara real-time selama percobaan biologis melalui integrasi NW_MEA pada mikroskop optik konvensional.
Yang penting, fabrikasi SiNW pada film polimida [ 71 ] memungkinkan pengembangan NW_MEA yang fleksibel untuk merekam sinyal elektrofisiologis dalam organoid saraf, yang mewakili batas baru model sel in vitro. [ 72 ] Memang, susunan elektroda fleksibel dianggap sebagai salah satu strategi yang paling menjanjikan untuk berinteraksi dengan arsitektur organoid yang lunak dan kompleks [ 73 ] yang memungkinkan konfigurasi perangkat yang disesuaikan, seperti struktur seperti cangkang, jaring, pelipatan atau pembungkus untuk kultur sel 3D. Pendekatan kami secara unik dapat menggabungkan kemampuan beradaptasi mekanis substrat fleksibel dengan kinerja perekaman yang ditingkatkan dari elektroda berstruktur nano, menawarkan platform yang kuat untuk integrasi organoid–elektronik generasi berikutnya.
Beberapa keterbatasan harus dipertimbangkan dalam penelitian ini. Pertama, mekanisme akses intraseluler yang disediakan oleh NW memerlukan penyelidikan lebih lanjut, khususnya dengan menyetel kepadatan dan ukuran SiNW. Selain itu, karakteristik elektrokimia elektroda berbasis SiNW harus dimodelkan sebagai fungsi kepadatan dan ukuran NW untuk mengoptimalkan kinerja perangkat.
Kedua, ukuran elektroda kami yang lebih besar, dibandingkan dengan elektroda tradisional yang lebih kecil, secara intrinsik membatasi resolusi sel tunggal, karena setiap elektroda merekam aktivitas listrik beberapa neuron yang menempel padanya. Namun, amplitudo besar dari sinyal yang direkam memudahkan pengenalan dan penyortiran berbagai jenis bentuk gelombang saraf, yang memungkinkan untuk mengidentifikasi aktivitas berbagai subtipe neuron.
Ketiga, kuantitas CAPS yang dibutuhkan untuk menstimulasi aktivitas listrik pada neuron DRG yang dikultur pada NW_MEA adalah 50 kali lebih tinggi daripada yang dibutuhkan dengan teknik patch-clamp. Perbedaan ini dapat disebabkan oleh sifat hidrofobik CAPS, yang dapat menyebabkan molekul CAPS diserap oleh PDMS [ 74 ] dari ruang kultur sumur ganda NW_MEA kami. Selain itu, tidak seperti teknik patch-clamp yang bekerja dengan sel tunggal, metode kami melibatkan populasi sel yang mungkin memerlukan konten CAPS yang berbeda dalam larutan EXT untuk aktivasi neuron. Penelitian lebih lanjut untuk menilai perilaku ini direncanakan di masa mendatang.
4 Kesimpulan
Dalam studi ini, kami menunjukkan kemampuan untuk mencapai perekaman intraseluler berkelanjutan dari neuron DRG dalam populasi sel SSP dan PNS yang kompleks dan heterogen, menggunakan MEA berstruktur nano berdasarkan tikar SiNW. Platform SiNW memberikan beberapa keuntungan utama: i) mendukung kultur neuron DRG tikus primer dan sel glia, dengan bantuan lapisan pengumpan astrosit, yang mempertahankan sifat morfologi, molekuler, dan bioelektriknya yang unik; ii) memungkinkan akses intraseluler ke neuron; dan iii) memungkinkan perekaman AP yang stabil hingga 25 menit, menangkap detail utama untuk mengidentifikasi neuron nosiseptor serabut C, target mendasar dalam penelitian nyeri kronis.
Pekerjaan ini secara signifikan mendorong teknologi MEA berstruktur nano ke tingkat berikutnya, membuka jalan bagi studi in vitro yang lebih rinci tentang penginderaan saraf, transduksi, dan komunikasi. Pengujian NW_MEA dengan model sel PNS/CNS yang kompleks tidak hanya menunjukkan potensi perangkat tetapi juga memberikan pendekatan holistik dalam mempelajari mekanisme nyeri sesuai dengan fokus yang semakin besar terhadap peran penting sel glia PNS dan astrosit dalam nyeri kronis.
Akhirnya, arsitektur yang terkompartementalisasi dan teknologi fabrikasi yang fleksibel dari NW_MEA, bersama dengan kapasitas SiNW untuk berinteraksi secara efisien dengan populasi seluler yang beragam, menjadikan pendekatan kami sebagai alat yang ampuh untuk potensi aplikasi yang luas. Di luar penelitian tentang kultur bersama CNS dan PNS, kami memperkirakan penggunaannya dalam studi yang melibatkan sel elektrogenik yang dimodifikasi secara genetik dan jaringan yang direkayasa secara biologis, yang merupakan model penting dalam bidang biologi sintetis yang berkembang pesat.
5 Bagian Eksperimen
Pembuatan Mat SiNW dan NW_MEA
Tikar SiNW diproduksi dengan plasma enhanced chemical vapor deposition (PECVD) [ 75 – 77 ] pada area terpilih 12 mm × 10 mm dari slide kaca mikroskop. Untuk menginduksi pertumbuhan SiNW, film Au setebal 2 nm diuapkan secara selektif ke area spesifik, yang ditentukan menggunakan fotolitografi dan proses etsa basah. Pertumbuhan dilakukan dengan SiH 4 dan H 2 sebagai prekursor pada tekanan total 1 Torr dan suhu substrat 350 °C. Rasio aliran SiH 4 /(H 2 + SiH 4 ) ditetapkan menjadi 1:10. Frekuensi radio 13,6 MHz dengan daya ditetapkan pada 5 W digunakan untuk menyalakan plasma. Waktu pertumbuhan ditetapkan pada 7 menit. Lapisan SiNW yang padat, tersusun acak, dan berorientasi, panjangnya sekitar 2–3 µm, dengan diameter rata-rata di bagian bawah sekitar 50–80 nm, diperoleh seperti yang ditunjukkan pada Gambar S1a , Informasi Pendukung.
Untuk persiapan MEA, mat SiNW ditutupi oleh lapisan SiO2 pasif ( ketebalan 50 nm) yang diendapkan dengan resonansi siklotron elektron (ECR)-PECVD pada suhu ruangan, dimulai dari campuran gas O2 , SiH4 , dan He. Film isolasi diendapkan pada tekanan kerja 4 × 10−3 mbar dan pada daya gelombang mikro 800 W. Secara berurutan, dwilapis Ti (20 nm)/Au (125 nm) diuapkan untuk menghasilkan elektroda Au/SiNW dan jalur penghubung (Gambar 3a ), yang diperoleh melalui proses lepas landas dengan hanya menggunakan aseton. Untuk menghilangkan photoresist secara efektif dari permukaan sampel, proses lepas landas dilakukan selama 48 jam. Periode waktu ini memungkinkan aseton untuk mencapai dan menghilangkan photoresist secara menyeluruh dari zona mat NW yang kurang terekspos. Lapisan tipis Ti berfungsi semata-mata untuk meningkatkan daya rekat antara lapisan Au dan substrat. Lapisan SiO 2 yang mendasari SiNW menghindari hubungan arus pendek antara elektroda Au/SiNW yang dibuat. Elektroda Au/SiNW berukuran panjang 8 mm dan lebar 25 µm, dengan jarak 50 µm. Gambar SEM pada Gambar S1c,b , Informasi Pendukung memberikan tampilan atas susunan elektroda Au/SiNW dalam satu unit.
Kamar Kultur Sumur Ganda Polidimetilsiloksan (PDMS)
Pembuatan bilik sumur ganda melibatkan desain dan produksi cetakan dua bagian khusus, diilustrasikan dalam Gambar S8 , Informasi Pendukung. Cetakan dibuat melalui pencetakan 3D menggunakan Ultimaker S5, dengan ABS (akrilonitril-butadiena-stirena) sebagai bahan pembuatannya. Untuk meningkatkan kehalusan permukaan cetakan, meningkatkan kualitas keseluruhan dan hasil proses pembuatan bilik, potongan cetakan dikenakan uap aseton. Sebelum menuangkan PDMS cair, cetakan menjalani pembersihan menyeluruh dengan alkohol isopropil dan air deionisasi untuk menghilangkan potensi residu aseton. PDMS disiapkan dengan mencampur elastomer silikon dan bahan pengeras elastomer silikon dalam rasio 10:1, keduanya diperoleh dari Sylgard. Larutan diaduk selama 30 menit, diikuti oleh sonikasi selama 30 menit lagi untuk menghilangkan gelembung udara, sebelum dituangkan ke dalam cetakan ABS. Cetakan kemudian diletakkan di atas pelat panas pada suhu 50 °C selama minimal 4 jam dan dibiarkan semalam pada suhu kamar (RT), untuk menjamin dan mengoptimalkan proses pengerasan PDMS. Selanjutnya, bilik ganda PDMS diekstraksi dengan hati-hati dari tepi bilik. Setelah selesai, bilik tersebut diikat ke permukaan kaca perangkat dengan PDMS fase cair. Langkah terakhir dalam proses ini adalah pengeringan selama 2 jam pada pelat panas pada suhu 120 °C.
Astrosit Kortikal Tikus dan Sel DRG: Persiapan, Pemeliharaan, dan Penanaman Kultur
Kultur primer astrosit disiapkan dari anak tikus yang baru lahir (Sprague Dawley) antara hari pascanatal P 0–2 seperti dijelaskan dalam ref.[ 78 ] Secara singkat, korteks serebral neonatal yang tidak memiliki meningen digerus dengan lembut, disaring dengan saringan sel 70 µm dan ditanam dalam labu kultur sel T25 yang berisi Dulbecco’s Modified Eagle Medium (DMEM) dengan GlutaMAX dan glukosa tinggi yang disuplemen dengan 15% serum janin sapi (FBS) dan penisilin-streptomisin pada 100 U mL −1 dan 100 µg mL −1 , masing-masing. Labu disimpan dalam inkubator pada suhu 37 °C, 5% CO 2 , dan tingkat kelembapan yang tepat selama 2 minggu. Selama periode ini, kami mengganti medium sel setiap 2 hari, dan labu dikocok dengan lembut bila perlu untuk menghilangkan sel mikroglia yang tidak diinginkan. Ketika konfluensi tercapai, astrosit didispersikan menggunakan tripsin-EDTA 0,25%, dan suspensi sel ditanam kembali pada alas NW, substrat NW_MEA dan CTRL seperti yang dijelaskan di tempat lain. [ 46 ] Sel ditanam pada kepadatan 5–7 × 10 3 per cawan dan dipelihara dalam media kultur yang mengandung 10% FBS. Setelah 5 DIV dari sel yang ditanam kembali berkembang biak dan tumbuh sebagai lapisan pengumpan, sel DRG ditanam saat masih menggunakan media astrosit. Kultur primer sel DRG disiapkan dari tikus P11-21 pascanatal menurut protokol yang telah kami jelaskan di tempat lain. [ 79 ] Sel DRG disemai sebagai berikut: jumlah yang sama dari suspensi sel akhir diteteskan ke alas Au/SiNW yang telah dilapisi sebelumnya dengan sel astrosit dan ditempatkan dalam inkubator 37 °C, 5% CO 2 . Sel dipelihara dalam DMEM, Gibco yang dilengkapi dengan FBS (10%) dengan adanya NGF (50 ng mL −1 ) dan menghindari sitosinea-D-arabinofuranoside (AraC, 1,5 mg mL −1 ) agar tidak mengurangi ekspresi sel glia perifer. Kultur sel dikarakterisasi setelah 3, 5, dan 7 DIV dengan pencitraan optik dan confocal, dengan mikroskop elektron pemindaian (SEM) dan patch clamp.
Semua percobaan dilakukan sesuai dengan hukum Italia tentang perlindungan hewan laboratorium, dengan persetujuan komite bioetika Universitas Bologna dan Kementerian Kesehatan (ID 1138, nomor kode 2DBFE.N.3CN, nomor ex-protokol 360/2017-PR) dan di bawah pengawasan komisi veteriner untuk perawatan dan kenyamanan hewan di Universitas Bologna. Segala upaya dilakukan untuk meminimalkan jumlah hewan yang digunakan dan penderitaan mereka.
Viabilitas Sel
Biokompatibilitas kultur sel pada alas AuSiNW dan substrat planar Si yang dilapisi oleh lapisan ganda Ti/Au yang sama, yang digunakan sebagai CTRL, dievaluasi pada 3 dan 7 DIV dengan melakukan uji fluoresceine diacetate (FDA). Analisis kuantitatif dilakukan dengan menghitung semua sel hidup (hijau) menggunakan perangkat lunak Imagej, yang membedakan sel positif FDA yang dilapisi pada substrat Au/SiNW dan CTRL.
Imunostaining Kultur dan Mikroskopi Konfokal
Tingkat ekspresi protein 43 (GAP-43), protein asam fibrilar glia (GFAP), dan nukleus neuronal (NeuN) dalam kultur bersama yang ditanam pada substrat CTRL dan Au/SiNW dinilai. GAP-43 adalah protein yang dikodekan oleh gen gap-43, yang dicirikan sebagai protein pertumbuhan atau plastisitas karena tingkat ekspresinya yang tinggi dalam kerucut pertumbuhan neuronal selama fase perkembangan dan regenerasi akson. Di sisi lain, GFAP adalah penanda yang mapan untuk astrosit, dan juga diekspresikan dalam sel Schwann imatur yang tidak bermielin dan dalam sel satelit (PNS). [ 59 ] NeuN adalah penanda neuron dewasa, yang sebagian besar terlokalisasi dalam nukleus beberapa neuron.
Untuk pewarnaan imunofluoresensi, kultur sel yang ditanam pada substrat yang berbeda difiksasi dengan paraformaldehida (4%) dalam larutan penyangga fosfat (PBS, 0,1 M) selama 15 menit pada suhu kamar (20–24 °C). Setelah diblokir dengan bovine serum albumin (BSA, 0,03%) dan setelah permeabilisasi dengan Triton X100 (0,01%) dalam PBS selama 30 menit pada suhu kamar. Sampel kemudian diinkubasi semalam pada suhu 4 °C dengan antibodi primer (Abs) termasuk anti-GFAP kelinci (1:500, Abcam), anti-GAP43 tikus (1:2000, Sigma Aldrich); AB sekunder yang digunakan untuk imunofluoresensi termasuk anti-kelinci keledai terkonjugasi Alexa 488 dan anti-tikus keledai terkonjugasi Alexa Fluor 595 (Molecular Probes-Invitrogen, pengenceran 1:1000). Untuk mengidentifikasi inti neuron, pewarnaan protein inti neuron (NeuN) dilakukan dengan menggunakan antimouse NeuN (Abcam, pengenceran 1:250) dan antimouse keledai terkonjugasi Alexa 595 (Molecular Probes-Invitrogen, pengenceran 1:1000) sebagai antibodi sekunder. Penutup kaca kemudian dipasang dengan Prolong Anti-Fade, dan dengan 4′,6-diamidino-2-phenylindole (DAPI, Molecular Probes-Invitrogen) untuk pewarnaan inti. Gambar optik diperoleh dengan Mikroskop Konfokal FLUO-Spin Up Crest yang dilengkapi dengan lensa objektif 40 X dan kamera Photometrics, (Crisel Instruments).
Mikroskop Elektron Pemindaian
Morfologi tikar SiNW dan Au/SiNW, serta perangkat NW_MEA, diverifikasi oleh mikroskop elektron pemindaian emisi medan (FESEM) (ZEISS SIGMA 300) pada tegangan percepatan 5 kV. Ukuran NW ditentukan oleh pengukuran gabungan dari tampilan atas dan penampang melintang.
Untuk mengamati sel-sel yang diimobilisasi pada substrat dan NW_MEA, sel-sel tersebut difiksasi dengan 2,5% glutaraldehida I PBS pada suhu 4 °C, selama 1 jam. Setiap sampel kemudian dibilas tiga kali dalam PBS selama 5 menit sebelum diwarnai 1 jam dalam 1% Osmium tetra-Oksida (OsO4) pada suhu kamar; tiga pembilasan lebih lanjut dengan air suling kemudian dilakukan. Kemudian, sampel didehidrasi secara berurutan dalam etanol 50%, 75%, 95%, dan 99%. Spesimen yang dikeringkan dilapisi dengan emas yang diuapkan (ketebalan 10 nm) sebelum analisis dengan FESEM. Pengamatan dilakukan pada tegangan percepatan 5 kV. Diameter neuron diperoleh dari 10 gambar SEM tampak denah menggunakan alat garis dari program analisis gambar ImageJ. Neuron DRG diidentifikasi oleh badannya yang bulat. Untuk menghasilkan distribusi ukuran, ≈200 pengukuran diameter dilakukan, yang melibatkan tiga kultur sel neuron-glia astrosit/DRG yang berbeda dan spesimen dari tiga hewan yang berbeda. Histogram dibuat menggunakan ukuran bin yang menghasilkan ≈20 bin di seluruh distribusi. Distribusi histogram kemudian disesuaikan dengan fungsi Gaussian menggunakan perangkat lunak pemrosesan data Origin (OriginLab Corp.).
Elektrofisiologi Penjepit Sel Arus
Teknik patch-clamp sel utuh dalam mode current-clamp dikonfigurasi untuk merekam AP yang dihasilkan oleh neuron DRG tunggal yang disemai dengan sel glia dan astrosit pada substrat Au/SiNW dan penutup kaca yang dilapisi dengan poli-D-lisin, digunakan sebagai kontrol (CTRL). Neuron DRG dijepit tegangan pada potensi penahan −60mV dalam larutan garam EXT. Baik substrat CTRL maupun Au/SiNW ditempatkan dalam cawan Petri selama pengukuran. Pipet patch disiapkan dari kapiler kaca borosilikat berdinding tipis untuk memperoleh resistansi ujung 2–4 MΩ saat diisi dengan larutan EXT. Selanjutnya, serangkaian pulsa arus dari amplitudo 25 hingga 250 pA, dengan langkah tambahan 25 pA dan durasi 100 ms, disuntikkan untuk memunculkan AP. Penembakan neuron terjadi sebagai respons terhadap injeksi arus ambang, yang menyebabkan depolarisasi neuron. Arus membran diperkuat (MultiClamp 700B), disaring pada 2 kHz dan diperoleh pada laju sampel 5 kHz oleh penguat Axopatch 200B dalam mode voltage-clamp. Respons diperkuat, disaring low-pass pada 1 kHz, didigitalkan pada 20 kHz, disimpan, dan dianalisis dengan pCLAMP 10. Perhitungan AP dan sifat elektrofisiologis dilakukan seperti yang dijelaskan sebelumnya [ 80 ] bersama dengan analisis komparatif dari fitur pasif listrik utama yang dipamerkan oleh neuron DRG pada substrat CTRL dan Au/SiNW (Tabel S1 , Informasi Pendukung). Rekaman sel yang tidak mengekspresikan AP tidak dipertimbangkan untuk penelitian ini. Jumlah maksimal penyalaan dihitung dengan menghitung jumlah puncak AP yang melampaui batas sebagai respons terhadap pulsa injeksi arus 100 ms. Eksperimen dilakukan pada RT. Selain itu, untuk menguji sensitivitas neuron DRG tunggal terhadap CAPS, kami melakukan penjepitan patch sel utuh dalam mode penjepit arus dari sel yang terpapar ke CAPS [1 µm]. CAPS diterapkan secara terus-menerus ke sel menggunakan sistem perfusi gravitasi lokal selama sekitar 5 detik dalam larutan EXT. Pencucian (WO) dengan larutan EXT diterapkan pada setiap rangkaian percobaan untuk memulihkan potensi penahan awal (mV), setelah depolarisasi yang disebabkan oleh respons CAPS terhadap DRG.
Sistem Akuisisi Data untuk Perekaman dengan NW_MEA
Kami menggunakan platform perekaman khusus, yang dikembangkan sebelumnya, [ 42 ] yang terhubung ke sistem akuisisi digital (DAQ). Pada Gambar S7 , Informasi Pendukung, deskripsi terperinci dari platform lengkap. Secara singkat, platform ini terdiri dari kotak perekaman aluminium yang menampung NW _MEA dengan ruang kultur dan memasang papan antarmuka elektronik yang terhubung ke sistem DAQ. DAQ disusun oleh papan pengembangan ibu + anak komersial berdasarkan chip saraf Intan Technologies RHD2216, yang pada gilirannya menghubungkan perangkat lunak PC untuk penyimpanan dan visualisasi data (Intan RHX). Sistem dapat melakukan akuisisi 16-bit pada 16 saluran pada 30k Sampel/dtk per saluran. Selain itu, filter band pass digital dapat diatur dengan frekuensi cut-off yang lebih rendah dalam kisaran 0,1 ÷ 500 Hz dan frekuensi cut-off atas dalam kisaran 100 Hz ÷ 20 kHz untuk membatasi gangguan derau dan untuk penghapusan offset. Chip tersebut dirancang untuk perekaman intrakortikal atau ECoG dan memiliki derau masukan rendah yang khas sebesar 2,4 µVrms. Papan tersebut dilengkapi dengan konektor koaksial untuk memungkinkan penggunaan elektroda referensi eksternal dengan injeksi derau minimum dalam sistem. Kawat platina eksternal diikatkan ke inti elektroda koaksial dan digunakan sebagai referensi selama pengukuran.
Perekaman Neuronal dengan NW_MEA dalam Aplikasi Obat Farmakologi
Suspensi astrosit disemai secara bersamaan pada U1 dan U2 dari NW_MEA dan dipertahankan dengan suplemen DMEM 10%. Setelah 5 DIV, DRG hanya ditanam ke dalam U2, dengan mempertahankan monokultur astrosit di U1. Perekaman dilakukan dengan mengganti media kultur dengan larutan EXT standar setelah 5 DIV sel DRG ditanam. NW_MEA ditempatkan di slot kotak aluminium tertutup, untuk membatasi gangguan derau, dan dihubungkan dengan papan perekam. Elektroda referensi platina dimasukkan ke dalam larutan melalui lubang ad-hoc di kotak tertutup. Oleh karena itu, penyelarasan yang benar antara papan elektronik dan kontak sampel dilakukan dengan mengukur resistansi listrik antara dua pin yang sengaja dihubung singkat pada sampel, sementara keandalan listrik kontak diverifikasi melalui analisis impedansi awal pada 1 kHz. Pelat pemanas digunakan untuk mempertahankan suhu kotak pada 37 °C selama percobaan. Akhirnya, perangkat lunak akuisisi dimulai dengan memilih parameter berikut: lebar pita penguat 1–7500 Hz, laju pengambilan sampel = 30k Sampel/dtk. Filter notch 50 Hz diadopsi untuk lebih mengurangi interferensi siklus AC. Pertama, aktivitas dasar selama 6 menit dalam larutan EXT direkam, diikuti oleh perekaman uji farmakologis selama 5 menit: i) CAPS [50 µM]; ii) TTX [2 µM]; iii) CBX [50 µM], ditambahkan ke U1 dan U2. WO dengan larutan EXT diterapkan pada setiap kondisi.
Solusi dan Bahan Kimia
Semua garam dan bahan kimia yang digunakan untuk penyelidikan adalah yang memiliki tingkat kemurnian tertinggi (SIGMA ALDRICH). Untuk percobaan elektrofisiologi patch-clamp dan perekaman listrik, larutan garam mandi standar, larutan EXT, adalah (milimolar): 140 NaCl, 4 KCl, 2 MgCl 2 , 2 CaCl 2 , 10 HEPES, 5 glukosa, pH 7,4 dengan NaOH dan osmolalitas disesuaikan menjadi ≈315 mOsm dengan manitol. Larutan intraseluler (pipet) terdiri dari (milimolar): 144 KCl, 2 MgCl 2 , 5 EGTA, 10 HEPES, pH 7,2 dengan KOH dan osmolalitas ≈295 mOsm.
Analisis Statistik
Analisis Statistik—Eksperimen Patch-Clamp : Data dilaporkan sebagai rata-rata rata-rata ± standar error (SE) dari jumlah sel yang ditambal dan direkam (N). Eksperimen dilakukan beberapa kali (n = 7) pada kultur primer yang berbeda, yang ditanam pada substrat CTRL dan Au/SiNW yang baru. Analisis dan statistik sifat membran elektrofisiologis dilakukan dengan Origin Micro Cal Ver 6.0. Data dibandingkan dengan ANOVA satu arah dengan uji pasca Bonferroni atau uji t siswa . * p < 0,05, ** p < 0,01, *** p < 0,001 uji t independen
Analisis Statistik—Perekaman NW_MEA : Rekaman dilakukan dari lima kultur sel neuron-glia astrosit/DRG, yang masing-masing terdiri dari spesimen dari tiga hewan berbeda dan menggunakan lima perangkat dari kelompok fabrikasi berbeda. Data diperoleh dalam format biner (*.rhd) untuk meningkatkan efisiensi kompresi. Setelah konversi ke format ASCII berdasarkan struktur data, protokol analisis khusus diterapkan pada plot temporal. Awalnya, algoritma penghalusan digunakan menggunakan jendela 50 titik (jendela 1,6 ms @ 30k Sampel/dtk) yang diterapkan pada nilai rata-rata. Lebar jendela yang dipilih bertujuan untuk meminimalkan dampak sinyal palsu pada jalur sinyal tanpa mengubah amplitudonya secara signifikan. Algoritma penyortiran puncak diterapkan dengan ambang batas tegangan yang ditetapkan pada dan 1 mV, dan kerangka waktu minimum 10 ms antara dua puncak berbeda. Strategi ini secara efektif mengurangi deteksi puncak artefak tanpa mengorbankan retensi data yang bermakna.
Untuk meningkatkan akurasi data, semua puncak yang diidentifikasi sebagai artefak oleh algoritma penyortiran puncak dikecualikan. Data yang dihasilkan kemudian digunakan untuk menilai distribusi kejadian dalam hal frekuensi dan amplitudo.
